Bekanntmachung eines Beschlusses des Gemeinsamen Bundesausschusses über eine Änderung der Kinder-Richtlinie: Prüfung der Kinder-Richtlinie aufgrund aktualisierter Anforderungen an die Durchführung genetischer Reihenuntersuchungen gemäß § 23 Absatz 2 Nummer 6 des Gendiagnostikgesetzes: Erweitertes Neugeborenen-Screening und Mukoviszidose-Screening
Bundesministerium für Gesundheit
Bekanntmachung
eines Beschlusses des Gemeinsamen Bundesausschusses
über eine Änderung der Kinder-Richtlinie:
Prüfung der Kinder-Richtlinie aufgrund aktualisierter Anforderungen
an die Durchführung genetischer Reihenuntersuchungen
gemäß § 23 Absatz 2 Nummer 6 des Gendiagnostikgesetzes:
Erweitertes Neugeborenen-Screening und Mukoviszidose-Screening
Der Gemeinsame Bundesausschuss (G-BA) hat in seiner Sitzung am 21. März 2024 beschlossen, die Richtlinie über die Früherkennung von Krankheiten bei Kindern (Kinder-Richtlinie) in der Fassung vom 18. Juni 2015 (BAnz AT 18.08.2016 B1), die zuletzt durch die Bekanntmachung des Beschlusses vom 12. Mai 2023 (BAnz AT 12.07.2023 B2) geändert worden ist, wie folgt zu ändern:
Kapitel C Abschnitt I „Erweitertes Neugeborenen-Screening“ wird wie folgt geändert:
- 1.
-
§ 16 wird wie folgt geändert:
- a)
-
Absatz 1 wird wie folgt geändert:
- aa)
-
In Satz 1 werden die Wörter „Eltern (Personensorgeberechtigten)“ durch die Wörter „Personensorgeberechtigten (im Folgenden „Eltern“ genannt)“ ersetzt, nach dem Wort „durch“ die Wörter „die gemäß § 19 Absatz 1 verantwortliche Ärztin oder“ eingefügt und nach dem Wort „Arzt“ die Angabe „(§ 19 Absatz 1)“ gestrichen.
- bb)
-
In Satz 2 werden die Wörter „oder einen Entbindungspfleger“ gestrichen und nach dem Wort „an“ die Wörter „eine Ärztin oder“ eingefügt.
- b)
-
Absatz 2 wird wie folgt geändert:
- aa)
-
In Satz 3 wird das Wort „Richtlinie“ durch das Wort „Richtlinien“ ersetzt.
- bb)
-
Es werden folgende Sätze angefügt:
„Die Aufklärung umfasst auch die Informationen zur Verarbeitung der personenbezogenen Daten. Den Eltern ist vom Leistungserbringer, der die Geburt des Kindes verantwortlich geleitet hat (im Folgenden „Einsender“ genannt), der Name des beauftragten Labors schriftlich im Untersuchungsheft für Kinder auszuhändigen, mit der Aufforderung den Labornamen bei weiteren erforderlichen Laboruntersuchungen der veranlassenden Ärztin oder dem veranlassenden Arzt mitzuteilen.“
- c)
-
Absatz 3 wird wie folgt geändert:
- aa)
-
In Satz 2 wird das Wort „Personensorgeberechtigten“ durch das Wort „Eltern“ ersetzt.
- bb)
-
Satz 3 wird wie folgt gefasst:
„Die Einwilligung umfasst den Umfang der genetischen Untersuchung auf die unter § 17 genannten Zielkrankheiten und den Umfang der mit der Filterpapierkarte weiterzugebenden und zu verarbeitenden personenbezogenen Daten sowie die Befundübermittlung von der Laborärztin oder vom Laborarzt an die Eltern gemäß § 22 Absatz 1.“
- cc)
-
Nach Satz 3 wird folgender Satz eingefügt:
„Teil der Einwilligung ist auch das Einverständnis für den Fall eines auffälligen Befunds in die Befundweitergabe durch die Laborärztin oder den Laborarzt an eine behandelnde Ärztin oder einen behandelnden Arzt im Krankenhaus gemäß § 22 Absatz 2 sowie an eine von den Eltern im Zuge der Befundweiterleitung ausgewählte spezialisierte Einrichtung und die Kontaktaufnahme gemäß § 22a Absatz 1 und 2 sowie das Erinnerungsmanagement gemäß § 22b.“
- dd)
-
In dem neuen Satz 5 wird das Wort „(Personensorgeberechtigten)“ gestrichen.
- ee)
-
In dem neuen Satz 6 werden die Wörter „die Labore“ durch die Wörter „das Labor“ ersetzt und nach dem Wort „dürfen“ die Wörter „und dass die Befundübermittlung an sie durch die Laborärztin oder den Laborarzt erfolgt“ eingefügt.
- ff)
-
In dem neuen Satz 7 wird das Wort „auch“ gestrichen.
- d)
-
Folgender Absatz 4 wird angefügt:
„(4) Die Befundweitergabe durch die Laborärztin oder den Laborarzt an eine von den Eltern ausgewählte spezialisierte Einrichtung inklusive der Kontaktaufnahme derselbigen mit den Eltern gemäß § 22a Absatz 1 und 2 sowie an die behandelnde Ärztin oder den behandelnden Arzt im Krankenhaus nach § 22 Absatz 2 und das Erinnerungsmanagement gemäß § 22b sowie die dazu erforderliche Verarbeitung von personenbezogenen Daten dürfen nur nach vorheriger Information der Eltern und mit ihrer nach Mitteilung eines auffälligen Befunds erklärten ausdrücklichen Einwilligung erfolgen. Die Einwilligung kann jederzeit schriftlich oder mündlich mit Wirkung für die Zukunft gegenüber der aufklärenden Person widerrufen werden.“
- 2.
-
§ 17 wird wie folgt geändert:
- a)
-
In Absatz 2 wird nach Satz 1 folgender Satz eingefügt:
„Für das Screening auf die Zielkrankheit Nummer 2 erfolgt nach einem ersten auffälligen Befund, zur nochmaligen Überprüfung dieses Befunds aus der ersten Trockenblutkarte die Ermittlung eines Steroidprofils mittels Tandemmassenspektrometrie.“
- b)
-
Absatz 3 wird wie folgt geändert:
- aa)
-
In Satz 3 werden die Wörter „Nutzung, Speicherung oder Weitergabe“ durch die Wörter „weitere Verarbeitung“ ersetzt.
- bb)
-
In Satz 4 werden die Wörter „dem Zweck“ durch die Wörter „den Zwecken“ ersetzt und nach dem Wort „behandeln“ die Wörter „sowie für die Qualitätssicherung des jeweiligen Analyseverfahrens des beauftragten Labors, um die Anzahl falsch-positiver und falsch-negativer Screeningbefunde zu verringern“ eingefügt.
- 3.
-
§ 18 wird wie folgt geändert:
- a)
-
Nach Absatz 1 wird folgender Absatz 2 eingefügt:
„(2) Die Bezeichnung „auffälliger Befund“ umfasst den Verdacht auf das Vorliegen einer Zielerkrankung nach erster Trockenblutkarte sowie den Verdacht auf das Vorliegen einer Zielerkrankung nach zweiter Trockenblutkarte. Als positiver Screeningbefund wird im erweiterten Neugeborenen-Screening ein auffälliger Befund bezeichnet, der das abschließende Ergebnis des Screenings darstellt. Dies ist der auffällige Befund nach zweiter Trockenblutkarte, der auffällige Befund nach erster Trockenblutkarte für die Zielerkrankungen Sichelzellkrankheit und 5q-assoziierte spinale Muskelatrophie gemäß § 17 Absatz 1 Nummer 15 und 16 sowie der auffällige Befund mit hochgradigem Krankheitsverdacht nach erster Trockenblutkarte.“
- b)
-
Der bisherige Absatz 2 wird Absatz 3 und wie folgt geändert:
- aa)
-
In Satz 1 werden die Wörter „zuverlässigen Diagnose ist bei einem ersten auffälligen Befund“ durch die Wörter „Überprüfung eines ersten auffälligen Befunds“ ersetzt, nach dem Wort „wurde,“ das Wort „ist“ eingefügt und nach dem Wort „Trockenblutkarte“ das Wort „(Kontrollkarte)“ eingefügt.
- bb)
-
In Satz 3 wird nach dem Wort „dem“ das Wort „Befund“ durch die Wörter „positiven Screeningbefund“ ersetzt.
- cc)
-
In Satz 4 werden nach dem Wort „Arzt/“ die Wörter „eine dafür“ eingefügt.
- c)
-
Nach Absatz 3 wird folgender Absatz 4 eingefügt:
„(4) Abweichend von Absatz 3 Satz 1 erfolgt im Rahmen der ersten Laboruntersuchung für die Zielkrankheit Adrenogenitales Syndrom nach § 17 Absatz 1 Nummer 2 nach einem ersten auffälligen Befund zur nochmaligen Überprüfung dieses Befunds aus der ersten Trockenblutkarte die Laboranalyse gemäß § 17 Absatz 2 Satz 2. Wird der erste auffällige Befund durch eine interne Validierungsuntersuchung bestätigt, ist eine zweite Laboruntersuchung anhand einer zweiten Trockenblutkarte oder eine Abklärungsdiagnostik durchzuführen und Absatz 3 findet im Übrigen Anwendung.“
- d)
-
Der bisherige Absatz 3 wird Absatz 5 und wie folgt geändert:
- aa)
-
In Satz 1 wird die Angabe „2“ durch die Angabe „3“ ersetzt und nach der Angabe „16“ werden die Wörter „oder wenn bereits nach der ersten Laboruntersuchung aus laborärztlicher Sicht ein hochgradiger Krankheitsverdacht besteht,“ eingefügt.
- bb)
-
In Satz 2 wird das Wort „diese“ durch das Wort „die“ ersetzt und das Wort „Befund“ durch die Wörter „positiven Screeningbefund“ ersetzt.
- cc)
-
In Satz 3 wird das Wort „Screeningergebnisses“ durch das Wort „Screeningbefunds“ ersetzt.
- e)
-
Der bisherige Absatz 4 wird Absatz 6.
- 4.
-
§ 19 wird wie folgt gefasst:„§ 19
Verantwortlichkeiten
(1) Der Leistungserbringer, der die Geburt des Kindes verantwortlich geleitet hat, ist für die Aufklärung, Einholung der Einwilligung, Entnahme der Blutprobe und Probenübermittlung an das Labor verantwortlich. Er hat das Labor mit der Analyse der zugesandten Proben zu beauftragen.
(2) Wurde die Geburt durch eine Hebamme verantwortlich geleitet, so soll sie/er in gegenseitigem Einvernehmen eine gemäß Absatz 1 verantwortliche Ärztin/einen verantwortlichen Arzt benennen. Ist eine Benennung ausnahmsweise nicht möglich, haben die Hebammen die Aufklärung, Einholung der Einwilligung, Entnahme der Blutprobe und Probenübermittlung an das Labor in eigener Verantwortung durchzuführen, wenn die Rückfragemöglichkeit an eine Ärztin/einen Arzt gewährleistet ist.
(3) Die Probenübermittlung erfolgt an eine(n) nach § 23 berechtigte(n) Laborärztin/Laborarzt, die/der die Verantwortung für die Laboruntersuchungen nach § 17 und im Falle der vorliegenden Einwilligung nach § 16 die Befundübermittlungen an die Eltern nach § 22 sowie die Befundweitergabe an eine behandelnde Ärztin oder einen behandelnden Arzt im Krankenhaus nach § 22 Absatz 2 sowie an die spezialisierte Einrichtung und Beauftragung dieser zur Kontaktaufnahme mit den Eltern nach § 22a Absatz 1 und 2 trägt.
(4) Die/der die U2-Früherkennungsuntersuchung beim Neugeborenen durchführende Ärztin/Arzt hat sich bei der Untersuchung zu vergewissern, dass die Entnahme der Blutprobe für das erweiterte Neugeborenen-Screening dokumentiert wurde. Ist das Screening nicht dokumentiert, so hat sie/er das Screening nach dieser Richtlinie anzubieten.“
- 5.
-
§ 20 wird wie folgt geändert:
- a)
-
In Absatz 2 Satz 3 wird das Wort „(Personensorgeberechtigten)“ gestrichen, das Wort „einer“ durch das Wort „eines“ ersetzt und werden die Wörter „zweiten Laboruntersuchung“ durch das Wort „Zweitscreenings“ ersetzt.
- b)
-
In Absatz 3 werden nach dem Wort „soll“ die Wörter „unabhängig von der Lebensstunde“ eingefügt.
- c)
-
Folgender Absatz 5 wird angefügt:
„(5) Soweit die ausdrückliche Einwilligung der Eltern in die weiteren Untersuchungen nach § 18 und § 20 Absatz 2 Satz 3 und Absatz 4 sowie in die dazu erforderliche Verarbeitung von personenbezogenen Daten entsprechend § 16 Absatz 3 vorliegt, ist das Labor der ersten Untersuchung auch für die weiteren Untersuchungen nach § 18 und § 20 Absatz 2 Satz 3 und Absatz 4 zu beauftragen.“
- 6.
-
§ 21 wird wie folgt geändert:
- a)
-
Die Überschrift wird wie folgt gefasst:„§ 21
Probenentnahme, Bearbeitung und Dokumentation“.
- b)
-
Absatz 5 wird wie folgt gefasst:
„(5) Um die wichtige Übermittlung eines auffälligen Befunds an die Eltern innerhalb von 72 Stunden ab Probenabnahme zu erreichen, soll der Versand der Probe ab Probenabnahme innerhalb von 24 Stunden erfolgen.“
- c)
-
Nach Absatz 6 wird folgender Absatz 7 angefügt:
„(7) Die Laborärztin oder der Laborarzt bestätigt dem Einsender den Eingang der Blutprobe.“
- 7.
-
§ 22 wird wie folgt gefasst:„§ 22
Befundübermittlung
(1) Wenn die Untersuchung aus der Blutprobe des Kindes im Labor einen auffälligen Befund ergibt, sind die Eltern zur Abwendung unmittelbarer Gefahren für die Gesundheit des Kindes und zur Gewährleistung einer schnellstmöglichen weiteren Diagnostik unverzüglich durch die/den für die Befundübermittlung verantwortliche Laborärztin oder verantwortlichen Laborarzt mündlich zu unterrichten.
Für diese Befundübermittlung ist die Einwilligung gemäß § 16 Absatz 3 Satz 3 Voraussetzung. Die Eltern sind zur Veranlassung der Entnahme einer weiteren Blutprobe oder zur weiteren Abklärung gemäß § 18 aufzufordern. Bei der Befundübermittlung durch die Laborärztin oder den Laborarzt an die Eltern ist auf die Notwendigkeit einer schnellen, fachkompetenten Abklärung und Weiterbetreuung ausdrücklich und mit Bezug auf die befundete Zielkrankheit hinzuweisen. Die Eltern sind über die nächsterreichbaren, auf die jeweilige Zielerkrankung spezialisierten pädiatrischen Einrichtungen mit 24-stündiger Erreichbarkeit sowie deren Kontaktdaten mit Telefonnummern zu informieren.(2) Für den Fall, dass das Neugeborene zum Zeitpunkt der Unterrichtung im Krankenhaus behandelt wird, wird abweichend von Absatz 1 zusätzlich zu den Eltern auch die oder der dort behandelnde Ärztin oder Arzt über den auffälligen Befund unterrichtet. Sie oder er ist zur Veranlassung der Entnahme einer weiteren Blutprobe oder zur weiteren Abklärung gemäß § 18 aufzufordern. Es gilt § 16 Absatz 4. Der behandelnden Ärztin oder dem behandelnden Arzt sind auch Kontaktmöglichkeiten (insbesondere Telefonnummern) zu den nächsterreichbaren, auf die jeweilige Zielerkrankung spezialisierten pädiatrischen Einrichtungen mit 24-stündiger Erreichbarkeit zum Zwecke der Absprache der weiteren Vorgehensweise mitzuteilen.
(3) Datum und Uhrzeit der Befundübermittlung, der Informationsempfänger und das vereinbarte Vorgehen sind durch die Laborärztin oder den Laborarzt zu dokumentieren.
(4) Für ihre Erreichbarkeit zum Zeitpunkt der möglichen Befundübermittlung sind die Telefonnummern und Adressen der Eltern auf einem abtrennbaren Teil der Filterpapierkarte anzugeben. Die schriftliche Einwilligung der Eltern gemäß § 16 umfasst grundsätzlich die Verarbeitung der personenbezogenen Daten, insbesondere der Telefonnummer und Adresse, zum Zwecke der unmittelbaren Kontaktaufnahme im Sinne von Absatz 1. Nach abgeschlossener Diagnostik, Befundübermittlung und Abrechnung sowie eventueller Abklärungsdiagnostik sind die Kontaktdaten unverzüglich zu löschen und die weiteren personenbezogenen Daten zu pseudonymisieren.
(5) Die Eltern werden ohne Vorliegen eines auffälligen Befunds nur auf ihre ausdrückliche Nachfrage von der Laborärztin oder von dem Laborarzt informiert.“
- 8.
-
Nach § 22 werden folgende §§ 22a, 22b eingefügt:„§ 22a
Befundweitergabe
(1) Mit der Mitteilung eines positiven Screeningbefunds nach § 22 Absatz 1 ist darauf hinzuweisen, dass eine Abklärungsdiagnostik durchzuführen ist. Die Eltern sind ergänzend darüber zu informieren, dass eine Befundweitergabe zum Zwecke der schnellen Terminvereinbarung für eine Abklärungsdiagnostik an eine entsprechende spezialisierte Einrichtung ihrer Wahl durch die Laborärztin oder den Laborarzt erfolgen kann.
(2) Die Laborärztin oder der Laborarzt übermittelt den Befund an eine von den Eltern ausgewählte spezialisierte Einrichtung. Die spezialisierte Einrichtung kontaktiert die Eltern für die Vereinbarung eines Termins zur Abklärungsdiagnostik. Es gilt § 16 Absatz 4.
(3) Die spezialisierte Einrichtung teilt nach Abschluss der Abklärungsdiagnostik den Befund dem für die erste Screeninguntersuchung zuständigen Labor zum Zwecke der Qualitätssicherung des Analyseverfahrens des Labors nach § 26 Absatz 3 mit. Die Befundweitergabe nach Satz 1 und eine dazu erforderliche Verarbeitung von personenbezogenen Daten dürfen nur mit schriftlicher oder in elektronischer Form vorliegender Einwilligung und nach vorheriger Information der Eltern nach der Mitteilung des Ergebnisses der Abklärungsdiagnostik erfolgen.
§ 22bErinnerungsmanagement
(1) Geht keine angeforderte Kontrollkarte nach § 18 Absatz 3 im Labor ein, kontaktiert die Laborärztin oder der Laborarzt die Eltern, um auf die Notwendigkeit der Abnahme einer Kontrollkarte hinzuweisen.
(2) Geht keine Zweitscreeningkarte nach § 20 Absatz 2 oder 4 im Labor ein, kontaktiert die Laborärztin oder der Laborarzt die Eltern, um auf die Notwendigkeit der Abnahme einer Zweitscreeningkarte hinzuweisen.
(3) Sind die Eltern nicht in der spezialisierten Einrichtung ihrer Wahl erschienen oder haben keinen Termin für die Abklärungsdiagnostik mit dieser vereinbart, meldet die spezialisierte Einrichtung dies unverzüglich an das für die erste Screeninguntersuchung zuständige Labor zurück. Hat die Laborärztin oder der Laborarzt keinen Befund der Abklärungsdiagnostik bis zu diesem Zeitpunkt der Rückmeldung erhalten, kontaktiert dieser beziehungsweise diese die Eltern, um nochmals auf die Notwendigkeit einer schnellen, fachkompetenten Abklärung und Weiterbetreuung hinzuweisen.
(4) Für die Verarbeitung der personenbezogenen Daten nach den Absätzen 1 bis 3 ist eine Einwilligung nach § 16 Absatz 4 einzuholen.“
- 9.
-
§ 26 wird wie folgt geändert:
- a)
-
Nach Absatz 2 wird folgender Absatz 3 eingefügt:
„(3) Es ist sicherzustellen, dass die für die Analyseverfahren festgelegten Grenzwerte laborintern stetig überprüft werden, um falsch-positive Screeningbefunde zu verringern und falsch-negative Befunde zu vermeiden. Hierfür erfolgt ein laborinterner Abgleich der Befunde der jeweiligen Neugeborenen aus dem Screening und der nach § 22a übermittelten Befunde aus der Abklärungsdiagnostik.“
- b)
-
Der bisherige Absatz 3 wird Absatz 4 und wie folgt geändert:
- aa)
-
Die Wörter „am Tage des Proben-Eingangs“ werden durch die Wörter „innerhalb von 24 Stunden nach Proben-Eingang“ ersetzt und das Wort „pathologische“ wird durch das Wort „auffällige“ ersetzt und nach dem Wort „Befunde“ das Wort „unverzüglich“ eingefügt.
- bb)
-
Folgende Sätze werden angefügt:
„Stellt das Labor Unregelmäßigkeiten bei dem Betropfen der Trockenblutkarten oder dem Probenversand fest, wird der Einsender darüber informiert. Bei wiederholten Unregelmäßigkeiten sollen dem Einsender zeitnah weitere Maßnahmen angeboten werden.“
- c)
-
Nach Absatz 4 werden folgende Absätze 5 und 6 eingefügt:„(5) Zur jährlichen Überprüfung des erweiterten Neugeborenen-Screenings müssen die die Laborleistungen erbringenden Ärztinnen und Ärzte im zweiten Quartal jedes Jahres der durch den G-BA gemäß § 28 Absatz 1 beauftragten unabhängigen wissenschaftlichen Institution sowohl patientenanonymisierte, aggregierte Daten als auch die Ergebnisse der Abklärungsdiagnostik in anonymisierter Form in Fällen von positiven Screeningbefunden über ihre Leistungen nach dieser Richtlinie im vorangegangenen Jahr vorlegen.(6) Folgende Daten sind nach Absatz 5 zu übermitteln:Labordaten:
- –
-
Angaben zum Labor
Methoden allgemein:- –
-
Analyse-Methoden (inklusive Kit), Filterpapier, Zielparameter, Cut-offs
Organisation:- –
-
Angaben zur Organisation (zum Beispiel Tracking, Anbindung an andere Versorgungsstrukturen)
- –
-
Anzahl der durch die Einsender eingesandten Leerkarten
- –
-
Anzahl der abgelehnten Screenings
Prozesszeiten:- –
-
Abnahmezeitpunkt (Zeitspanne zwischen Geburt und Blutabnahme)
- –
-
Versandzeit (Zeitspanne zwischen Blutentnahme und Laboreingang)
- –
-
Befundübermittlungszeit (Zeitspanne zwischen Laboreingang und Befundübermittlung)
Gesamtzahlen:- –
-
Anzahl der Erstscreenings (differenziert nach Abnahme- und Gestationsalter, Bundesland)
- –
-
Anzahl der angeforderten Folgeuntersuchungen (bei Entlassung vor vollendeten 36 Lebensstunden sowie Geburt vor vollendeten 32 Schwangerschaftswochen) – ohne Recall – und eingegangenen Folgekarten differenziert nach:
- –
-
Abnahme- und
- –
-
Gestationsalter,
- –
-
Probenqualität,
- –
-
Sonstigem (zum Beispiel Medikamente, Transfusion)
Recall:- –
-
Anzahl der Recalls (Kontrolluntersuchung wegen einer auffälligen ersten Trockenblutkarte), differenziert nach
- –
-
Krankheiten
- –
-
verstorbene Kinder nach Recall
- –
-
durch Kontrollkarte unauffällig
- –
-
Kontrollkarte nicht eingegangen
- –
-
Anzahl der Befunde mit hochgradigem Krankheitsverdacht, bei denen direkt die Abklärungsdiagnostik angefordert wurde
- –
-
Angaben zur Abklärungsdiagnostik (angefordert, bestätigt, offen, unauffällig)
Screeningbefunde bei angeforderter Abklärungsdiagnostik:- –
-
Screeningbefunde und Zeitpunkt des Erstscreenings
- –
-
diagnostische Maßnahmen und Ergebnis
Falsch-negative Befunde:- –
-
Sofern vorhanden, Hinweise auf falsch-negative Befunde“
- d)
-
Der bisherige Absatz 4 wird Absatz 7 und wie folgt gefasst:
„(7) Zum Zwecke der einheitlichen Dokumentation stellt die unabhängige wissenschaftliche Institution den Laboren detaillierte Vorlagen für die Übermittlung der Daten zur Verfügung.“
- e)
-
Folgender Absatz 8 wird angefügt:
„(8) Die gemäß § 28 Absatz 1 beauftragte unabhängige wissenschaftliche Institution stellt Auswertungen der Daten in einem Screeningreport dem G-BA jährlich zur Verfügung. Der Screeningreport enthält die Auswertung der Daten aus dem vorletzten Jahr.“
- 10.
-
In § 27 Absatz 1 werden die Wörter „auf dem Mustervordruck nach“ durch die Wörter „gemäß den Vorgaben in der“ ersetzt und wird vor den Wörtern „der eingesandten“ das Wort „auf“ eingefügt.
- 11.
-
§ 28 wird wie folgt gefasst:„§ 28
Evaluation
(1) Der G-BA beauftragt eine unabhängige wissenschaftliche Institution mit der Erstellung eines jährlichen Screeningreports zur Überprüfung des erweiterten Neugeborenen-Screenings auf der Grundlage der im § 26 Absatz 6 definierten Daten. Der Screeningreport wird dem G-BA jährlich zur Verfügung gestellt und auf der Internetseite des G-BA veröffentlicht.
(2) Ergeben sich aus dem Screeningreport weitere Evaluationsfragestellungen, ist zu prüfen, ob eine anlassbezogene Evaluation erfolgen soll. Im Falle der Notwendigkeit einer anlassbezogenen Evaluation beauftragt der G-BA dazu eine unabhängige wissenschaftliche Institution. Der G-BA wird in einem gesonderten Beschluss die Kriterien festlegen, nach denen die anlassbezogene Evaluation durchgeführt wird.“
Kapitel C Abschnitt II „Screening auf Mukoviszidose“ wird wie folgt geändert:
- 1.
-
§ 32 wird wie folgt geändert:
- a)
-
In Absatz 1 Satz 2 werden die Wörter „(z.B. Eltern)“ durch die Wörter „(im Folgenden „Eltern“ genannt)“ ersetzt und nach den Wörtern „durch die“ die Wörter „gemäß § 35“ eingefügt.
- b)
-
In Absatz 2 Satz 1 werden die Wörter „oder einen Entbindungspfleger“ gestrichen.
- c)
-
Absatz 3 wird wie folgt geändert:
- aa)
-
In Satz 1 werden nach dem Wort „Untersuchung“ die Wörter „sowie die Informationen zur Verarbeitung der personenbezogenen Daten“ eingefügt.
- bb)
-
Folgender Satz wird angefügt:
„Den Eltern ist vom Leistungserbringer gemäß § 35 Absatz 1 und 3 der Name des beauftragten Labors schriftlich im Untersuchungsheft für Kinder auszuhändigen, mit der Aufforderung den Labornamen bei weiteren erforderlichen Laboruntersuchungen der veranlassenden Ärztin oder dem veranlassenden Arzt mitzuteilen.“
- d)
-
Absatz 4 wird wie folgt geändert:
- aa)
-
Satz 2 wird durch folgende Sätze ersetzt:
„Die Einwilligung umfasst alle Bestandteile der Untersuchung und den Umfang der mit der Filterpapierkarte weiterzugebenden und zu verarbeitenden personenbezogenen Daten sowie die Befundübermittlung von der Laborärztin oder dem Laborarzt an die Eltern gemäß § 37 Absatz 1. Teil der Einwilligung ist auch das Einverständnis für den Fall eines auffälligen Befunds in die Befundweitergabe durch die Laborärztin oder den Laborarzt an eine behandelnde Ärztin oder einen behandelnden Arzt im Krankenhaus gemäß § 37 Absatz 3 sowie an eine von den Eltern im Zuge der Befundweiterleitung ausgewählte spezialisierte Einrichtung und die Kontaktaufnahme gemäß § 37a Absatz 1 und 2 sowie das Erinnerungsmanagement gemäß § 37b.“
- bb)
-
In Satz 3 wird das Wort „Personensorgeberechtigten“ durch das Wort „Elternteils“ ersetzt.
- cc)
-
In Satz 4 werden die Wörter „die Labore“ durch die Wörter „das Labor“ ersetzt und nach dem Wort „dürfen“ die Wörter „und dass die Befundübermittlung an sie durch die Laborärztin oder den Laborarzt erfolgt“ eingefügt.
- dd)
-
In Satz 5 wird das Wort „auch“ gestrichen.
- e)
-
Folgender Absatz 5 wird angefügt:
„(5) Die Befundweitergabe durch die Laborärztin oder den Laborarzt an eine von den Eltern ausgewählte spezialisierte Einrichtung inklusive der Kontaktaufnahme derselbigen mit den Eltern gemäß § 37a Absatz 1 und 2 sowie an die behandelnde Ärztin oder den behandelnden Arzt im Krankenhaus nach § 37 Absatz 3 und an eine behandelnde Ärztin oder einen behandelnden Arzt nach § 37 Absatz 2 und das Erinnerungsmanagement gemäß § 37b sowie die dazu erforderliche Verarbeitung von personenbezogenen Daten dürfen nur nach vorheriger Information der Eltern und mit ihrer nach Mitteilung eines auffälligen Befunds erklärten ausdrücklichen Einwilligung erfolgen. Die Einwilligung kann jederzeit schriftlich oder mündlich mit Wirkung für die Zukunft gegenüber der aufklärenden Person widerrufen werden.“
- 2.
-
§ 34 wird wie folgt gefasst:„§ 34
Grundsätze des Screening-Verfahrens
(1) Ergibt das Screening einen positiven Befund, sind die Eltern zeitnah, spätestens innerhalb von 14 Kalendertagen über das Ergebnis zu informieren, um eine Abklärung in der Regel durch einen Schweißtest (gegebenenfalls alternative Konfirmationsdiagnostik) und bei Bestätigung die anschließende Therapieeinleitung zu ermöglichen.
(2) Die im Rahmen des Screenings erhobenen Daten dürfen ausschließlich zu den Zwecken verwendet werden, die vorgenannte Zielkrankheit zu erkennen und zu behandeln sowie für die Qualitätssicherung des jeweiligen Analyseverfahrens des beauftragten Labors, um die Anzahl falsch-positiver und falsch-negativer Screeningbefunde zu verringern.“
- 3.
-
§ 35 wird wie folgt geändert:
- a)
-
Die Überschrift wird wie folgt gefasst:„§ 35
Verantwortlichkeiten“.
- b)
-
Absatz 1 wird wie folgt gefasst:
„(1) Der Leistungserbringer, der die Geburt des Kindes verantwortlich geleitet hat, ist für die Aufklärung, Einholung der Einwilligung, Entnahme der Blutprobe und Probenübermittlung an das Labor verantwortlich. Er hat das Labor mit der Analyse der zugesandten Proben zu beauftragen.“
- c)
-
In Absatz 2 werden die Wörter „oder einen Entbindungspfleger“ gestrichen.
- d)
-
Absatz 3 wird wie folgt gefasst:
„(3) Die oder der die U2- und/oder U3-Früherkennungsuntersuchung durchführende Ärztin oder Arzt hat sich zu vergewissern, dass das Screening auf Mukoviszidose dokumentiert wurde. Sofern bis zu einem Alter des Kindes von vier Lebenswochen noch keine ärztliche Aufklärung über ein Screening auf Mukoviszidose erfolgt ist, muss die Ärztin oder der Arzt die Eltern aufklären und gegebenenfalls das Screening auf Mukoviszidose veranlassen. Es gilt Absatz 1 entsprechend.“
- e)
-
Nach Absatz 3 wird folgender Absatz 4 eingefügt:
„(4) Die Probenübermittlung erfolgt an eine oder einen nach § 38 berechtigte Laborärztin oder berechtigten Laborarzt, die oder der die Verantwortung für die Laboruntersuchung nach § 33 und im Falle der vorliegenden Einwilligung nach § 32 die Befundübermittlungen an die Eltern nach § 37 sowie die Befundweitergabe an eine behandelnde Ärztin oder einen behandelnden Arzt im Krankenhaus nach § 37 Absatz 3 sowie an die spezialisierte Einrichtung und Beauftragung dieser zur Kontaktaufnahme mit den Eltern nach § 37a Absatz 1 und 2 trägt.“
- f)
-
Der bisherige Absatz 4 wird Absatz 5.
- 4.
-
§ 36 wird wie folgt geändert:
- 1.
-
In Absatz 1 wird nach der Angabe „§ 21“ die Angabe „Absatz 1 bis 4, 6 und 7“ eingefügt.
- 2.
-
In Absatz 2 Satz 1 werden die Wörter „oder einen Entbindungspfleger“ gestrichen.
- 3.
-
Folgender Absatz 4 wird angefügt:
„(4) Soweit die ausdrückliche Einwilligung der Eltern in die weitere Untersuchung nach Absatz 3 sowie in die dazu erforderliche Verarbeitung von personenbezogenen Daten entsprechend § 32 Absatz 3 vorliegt, ist das Labor der ersten Untersuchung auch für das Zweitscreening zu beauftragen.“
- 5.
-
§ 37 wird wie folgt gefasst:„§ 37
Befundübermittlung
(1) Ein positiver Screeningbefund gemäß § 33 wird von der verantwortlichen Laborärztin oder vom verantwortlichen Laborarzt mündlich den Eltern mitgeteilt.
Für diese Befundübermittlung ist die Einwilligung gemäß § 32 Absatz 4 Satz 2 Voraussetzung. Die Eltern sind zur Veranlassung der weiteren Abklärung gemäß § 34 Absatz 1 aufzufordern. Einzelheiten zum Ergebnis der DNA-Mutationsanalyse werden im Rahmen des Screenings nicht mitgeteilt. Bei der Befundübermittlung durch die Laborärztin oder den Laborarzt an die Eltern ist auf die Notwendigkeit einer fachkompetenten Abklärung und Weiterbetreuung hinzuweisen. Die Eltern sind über eine auf die Diagnose und Behandlung der Mukoviszidose spezialisierte Einrichtung sowie deren Kontaktdaten mit Telefonnummern zu informieren.
(2) Wenn die Eltern in die Weitergabe der Ergebnisse an die behandelnde Ärztin/den behandelnden Arzt nach § 32 Absatz 5 eingewilligt haben, hat das Labor bei Vorliegen eines abklärungsbedürftigen Schweißtests (Chloridbestimmung mittels Pilocarpin-Iontophorese) oder einer anderen abklärungsbedürftigen Konfirmationsdiagnostik, Einzelheiten zur DNA-Mutationsanalyse des Screenings an die behandelnde Ärztin/den behandelnden Arzt weiterzugeben.
(3) Für den Fall, dass das Neugeborene zum Zeitpunkt der Befundübermittlung im Krankenhaus behandelt wird, wird abweichend von Absatz 1 zusätzlich zu den Eltern auch die behandelnde Ärztin oder der behandelnde Arzt über den positiven Screeningbefund unterrichtet. Sie oder er ist zur Veranlassung der weiteren Abklärung gemäß § 34 Absatz 1 aufzufordern. Es gilt § 32 Absatz 5. Der behandelnden Ärztin oder dem behandelnden Arzt sind auch die Kontaktmöglichkeiten (insbesondere Telefonnummern) von einer auf Mukoviszidose spezialisierten pädiatrischen Einrichtung zum Zwecke der Absprache der weiteren Vorgehensweise mitzuteilen.
(4) Das Datum der Befundübermittlung, der Informationsempfänger und das vereinbarte Vorgehen sind durch die Laborärztin oder den Laborarzt zu dokumentieren.
(5) Die Eltern werden bei Vorliegen eines negativen Screeningbefunds nur auf ihren ausdrücklichen Wunsch vom Labor informiert.
(6) Für ihre Erreichbarkeit zum Zeitpunkt der möglichen Befundübermittlung sind die Telefonnummer und Adresse der Eltern auf einem abtrennbaren Teil der Filterpapierkarte anzugeben. Die schriftliche Einwilligung der Eltern gemäß § 32 umfasst grundsätzlich die Verarbeitung der personenbezogenen Daten, insbesondere der Telefonnummer und Adresse, zum Zwecke der Kontaktaufnahme im Sinne von Absatz 1. Nach abgeschlossener Diagnostik, Befundübermittlung und Abrechnung sowie eventueller Abklärungsdiagnostik sind die Kontaktdaten unverzüglich zu löschen und die weiteren personenbezogenen Daten zu pseudonymisieren.“
- 6.
-
Nach § 37 werden folgende §§ 37a, 37b eingefügt:„§ 37a
Befundweitergabe nach Abklärungsdiagnostik
(1) Mit der Mitteilung eines positiven Screeningbefunds nach § 37 Absatz 1 ist darauf hinzuweisen, dass eine Abklärungsdiagnostik durchzuführen ist. Die Eltern sind ergänzend darüber zu informieren, dass eine Befundweitergabe zum Zwecke der schnellen Terminvereinbarung für eine Abklärungsdiagnostik an eine entsprechende spezialisierte Einrichtung ihrer Wahl durch die Laborärztin oder den Laborarzt erfolgen kann.
(2) Die Laborärztin oder der Laborarzt übermittelt den Befund an eine von den Eltern ausgewählte spezialisierte Einrichtung. Die spezialisierte Einrichtung kontaktiert die Eltern für die Vereinbarung eines Termins zur Abklärungsdiagnostik. Es gilt § 32 Absatz 5.
(3) Die spezialisierte Einrichtung teilt nach Abschluss der Abklärungsdiagnostik den Befund dem für die Screeninguntersuchung zuständigen Labor zum Zwecke der Qualitätssicherung des Analyseverfahrens des Labors nach § 40 Absatz 2 mit. Die Befundweitergabe nach Satz 1 und eine dazu erforderliche Verarbeitung von personenbezogenen Daten darf nur mit schriftlicher oder in elektronischer Form vorliegender Einwilligung und nach vorheriger Information der Eltern nach der Mitteilung des Ergebnisses der Abklärungsdiagnostik erfolgen.
§ 37bErinnerungsmanagement
(1) Geht keine Zweitscreeningkarte nach § 36 Absatz 3 im Labor ein, kontaktiert die Laborärztin oder der Laborarzt die Eltern, um auf die Notwendigkeit der Abnahme einer Zweitscreeningkarte hinzuweisen.
(2) Sind die Eltern nicht in der spezialisierten Einrichtung ihrer Wahl erschienen oder haben keinen Termin für die Abklärungsdiagnostik mit dieser vereinbart, meldet die spezialisierte Einrichtung dies unverzüglich an das für die erste Screeninguntersuchung zuständige Labor zurück. Hat die Laborärztin oder der Laborarzt keinen Befund der Abklärungsdiagnostik bis zu diesem Zeitpunkt der Rückmeldung erhalten, kontaktiert diese beziehungsweise dieser die Eltern, um nochmals auf die Notwendigkeit einer schnellen, fachkompetenten Abklärung und Weiterbetreuung hinzuweisen.
(3) Für die Verarbeitung der personenbezogenen Daten nach Absatz 1 und Absatz 2 ist eine Einwilligung nach § 32 Absatz 5 einzuholen.“
- 7.
-
In § 38 werden die Wörter „abweichend vom § 26 Absatz 4“ gestrichen.
- 8.
-
§ 40 wird wie folgt gefasst:
„(1) Als Anforderungen an die Qualitätssicherung der Labore gelten auch für das Screening auf Mukoviszidose die Regelungen des § 26 Absatz 1 bis 3 und 5 bis 8 entsprechend mit der Maßgabe, dass abweichend von § 26 Absatz 6 der Bericht Angaben zu
- –
-
der Zahl der untersuchten Proben (Erstscreenings),
- –
-
der Anzahl der abgelehnten Screenings,
- –
-
der Anzahl der auffälligen Screeningbefunde,
- –
-
der Zeitspanne zwischen Probeneingang und Mitteilung des Screeningbefunds,
- –
-
der Anzahl und Art der gemäß § 37 mitgeteilten Screeningergebnisse und
- –
-
der Anzahl der aufgrund auffälliger Konfirmationsdiagnostik angeforderten und mitgeteilten DNA-Mutationsanalysen sowie
- –
-
den Ergebnissen der einzelnen Untersuchungsschritte,
- –
-
den IRT-Bestimmungen gesamt,
- –
-
den IRT ≥ 99,9 Perzentile (failsafe),
- –
-
den IRT ≥ 99 Perzentile < 99,9 Perzentile,
- –
-
den durchgeführten PAP-Untersuchungen,
- –
-
PAP ≥ 87,5 Perzentile,
- –
-
den durchgeführten Mutationsanalysen,
- –
-
den Mutationsanalysen mit unauffälligem Ergebnis,
- –
-
1 oder 2 Mutationen,
- –
-
den vorliegenden Befunden der Konfirmationsdiagnostik,
- –
-
der Anzahl der Schweißtests,
- –
-
der Leitfähigkeit,
- –
-
2 Mutationen in der Konfirmation oder Screening,
- –
-
Mekonium Ileus,
- –
-
der Anzahl der CFSPID-Fälle (Cystic Fibrosis Screen Positive, Inconclusive Diagnosis)
enthalten muss. Sofern vorhanden, sind Hinweise auf falsch-negative Befunde zu berichten.
(2) Es ist sicherzustellen, dass die für die Analyseverfahren festgelegten Grenzwerte laborintern stetig überprüft werden, um die Testgüte der Analyseverfahren zu optimieren. Hierfür erfolgt ein laborinterner Abgleich der Befunde der jeweiligen Neugeborenen aus dem Screening und der nach § 37a übermittelten Befunde aus der Abklärungsdiagnostik.
(3) Zur jährlichen Überprüfung des Mukoviszidose-Screenings müssen die die Laborleistungen erbringenden Ärztinnen und Ärzte im ersten Quartal jedes Jahres der durch den G-BA gemäß § 28 Absatz 1 beauftragten Stelle sowohl patientenanonymisierte, aggregierte Daten als auch die Ergebnisse der Abklärungsdiagnostik in anonymisierter Form in Fällen von positiven Screeningbefunden über ihre Leistungen nach dieser Richtlinie im vorangegangenen Jahr vorlegen.
(4) Zum Zwecke der einheitlichen Dokumentation stellt die unabhängige wissenschaftliche Institution den Laboren detaillierte Vorlagen für die Übermittlung der Daten zur Verfügung.“
- 9.
-
§ 42 wird wie folgt gefasst:„§ 42
Evaluation
Die unabhängige wissenschaftliche Institution nach § 28 Absatz 1 Satz 1 wird durch den G-BA beauftragt, den jährlichen Screeningreport gemäß § 28 Absatz 1 Satz 1 neben der Überprüfung des erweiterten Neugeborenen-Screenings auch zur Überprüfung des Mukoviszidose-Screenings auf der Grundlage der gemäß § 40 Absatz 1 definierten Daten zu erstellen. § 28 gilt entsprechend.“
Die Anlage 2 „Elterninformation zum Screening auf Mukoviszidose“ wird wie folgt geändert:
- 1.
-
Der Abschnitt „2. Wie kann Mukoviszidose behandelt werden?“ wird wie folgt geändert:
- a)
-
Der Satz „Zurzeit gibt es keine heilende Therapie bei Mukoviszidose.“ wird gestrichen.
- b)
-
Der Satz „Allerdings können Krankheitszeichen durch verschiedene Therapieansätze verbessert oder gelindert werden, so dass die Lebenserwartung von Mukoviszidose-Patienten kontinuierlich gestiegen ist.“ wird wie folgt gefasst: „Die Krankheitszeichen dieser angeborenen Störung können durch verschiedene Therapieansätze verbessert oder gelindert werden, so dass die Lebenserwartung von Mukoviszidose-Patienten kontinuierlich gestiegen ist.“
- c)
-
Die Wörter „besonders kalorienreichen“ werden durch das Wort „bedarfsangepassten“ ersetzt.
- 2.
-
Der Abschnitt „4. Wie wird die Reihenuntersuchung auf Mukoviszidose durchgeführt?“ wird wie folgt geändert:
- a)
-
Die Wörter „oder einen Entbindungspfleger“ werden gestrichen.
- b)
-
Vor dem Satz „Die Blutprobe Ihres Kindes wird nach der Untersuchung vernichtet.“ werden folgende Sätze eingefügt: „Wenn Sie weitere Fragen zur Durchführung des Neugeborenen-Screenings haben, können Sie sich an Ihre Ärztin oder Ihren Arzt wenden oder im Labor anrufen. Die Kontaktdaten des Labors finden Sie im Untersuchungsheft ihres Kindes.“
- 3.
-
Der Abschnitt „5. Wie werden Sie über das Reihenuntersuchungsergebnis informiert und was folgt danach?“ wird wie folgt gefasst:
„Das Labor teilt Ihnen innerhalb von 14 Tagen mit, ob der Befund kontrollbedürftig ist. Über ein normales Ergebnis werden Sie nur auf Ihre ausdrückliche Nachfrage informiert. Bei einem kontrollbedürftigen Ergebnis wird Ihnen von einer Ärztin oder einem Arzt mitgeteilt, in welcher spezialisierten Einrichtung Sie mit Ihrem Kind eine Abklärungsuntersuchung durchführen lassen können. Diese ist notwendig, um den Screeningbefund zu überprüfen und eventuell Therapiemaßnahmen einzuleiten. Über die Art der Untersuchung und die Therapiemöglichkeiten werden Sie in dieser Einrichtung umfassend aufgeklärt. Ein kontrollbedürftiges Ergebnis bedeutet noch nicht, dass Ihr Kind Mukoviszidose hat. Nur eins von fünf Kindern mit einem kontrollbedürftigen Ergebnis hat tatsächlich Mukoviszidose. Jedoch ist die Wahrscheinlichkeit für eine sogenannte Anlageträgerschaft erhöht. Die Anlageträger sind gesund, können jedoch diese Anlage an ihre Nachkommen weitergeben. In jedem Fall wird Ihnen eine genetische Beratung angeboten, damit Sie sich ausführlich über die Bedeutung dieses Ergebnisses informieren können. In der spezialisierten Einrichtung für Mukoviszidose wird zunächst eine Bestätigungsuntersuchung, in der Regel ein Schweißtest, durchgeführt und alles Weitere mit Ihnen besprochen. Dieser Schweißtest ist ungefährlich und schmerzfrei und belastet Ihr Kind nicht. Das Ergebnis wird Ihnen spätestens am Folgetag nach der Untersuchung mitgeteilt. Möglicherweise sind weitere Untersuchungen erforderlich.“
- 4.
-
Der Abschnitt „6. Sie entscheiden für Ihr Kind!“ wird wie folgt geändert:
- a)
-
Der Satz „Das durchführende Labor übermittelt die Ergebnisse direkt der verantwortlichen Person, die beauftragt ist, Sie bei einem positiven Befund zu kontaktieren.“ wird gestrichen.
- b)
-
Die Sätze „Ihre Einwilligung umfasst nur die Durchführung der Reihenuntersuchung auf Mukoviszidose sowie die Weitergabe der hierfür erforderlichen personenbezogenen Daten. Wir sind mit der Durchführung der Reihenuntersuchung auf Mukoviszidose und der Übermittlung der hierfür erforderlichen Angaben einverstanden:“ werden durch folgende Sätze ersetzt: „Ihre Einwilligung umfasst die Reihenuntersuchung auf Mukoviszidose sowie die Verarbeitung der hierfür erforderlichen personenbezogenen Daten. Wir sind mit der Durchführung der Reihenuntersuchung auf Mukoviszidose, der Verarbeitung der hierfür vorgesehenen Angaben und im Falle eines auffälligen Befunds mit der Befundübermittlung durch die Laborärztin/den Laborarzt einverstanden. Auch sind wir im Falle eines auffälligen Befunds einverstanden mit der Befundweitergabe an eine von uns noch auszuwählende spezialisierte Einrichtung, in der die Abklärungsuntersuchung durchgeführt werden kann, sowie mit der Weitergabe unserer Kontaktdaten an diese zum Zweck der Kontaktaufnahme mit uns. Wenn sich das Kind noch im Krankenhaus befindet, darf ein auffälliger Befund der behandelnden Ärztin/dem behandelnden Arzt im Krankenhaus durch die Laborärztin/den Laborarzt übermittelt werden, wenn wir hierin nach Befundübermittlung an uns eingewilligt haben. Im Falle eines nicht abgeklärten auffälligen Befunds sowie einer fehlenden Zweitscreeningkarte sind wir mit der Kontaktaufnahme der Laborärztin/des Laborarztes zwecks Erinnerung einverstanden. Wir nehmen zur Kenntnis, dass wir im Zuge einer Mitteilung eines auffälligen Befunds am Telefon von der Laborärztin/von dem Laborarzt über das weitere mögliche Vorgehen informiert werden. In diesem Gespräch werden wir um Einwilligung in die 1. Befundweitergabe an eine eventuell im Krankenhaus behandelnde Ärztin oder behandelnden Arzt, 2. Befundweitergabe an eine von uns dann auszuwählende spezialisierte Einrichtung und 3. in die Kontaktaufnahme derselben mit uns sowie die Kontaktaufnahme der Laborärztin/des Laborarztes zwecks Erinnerung gebeten.“
Die Anlage 3 „Elterninformation zum Erweiterten Neugeborenen-Screening“ wird wie folgt geändert:
- 1.
-
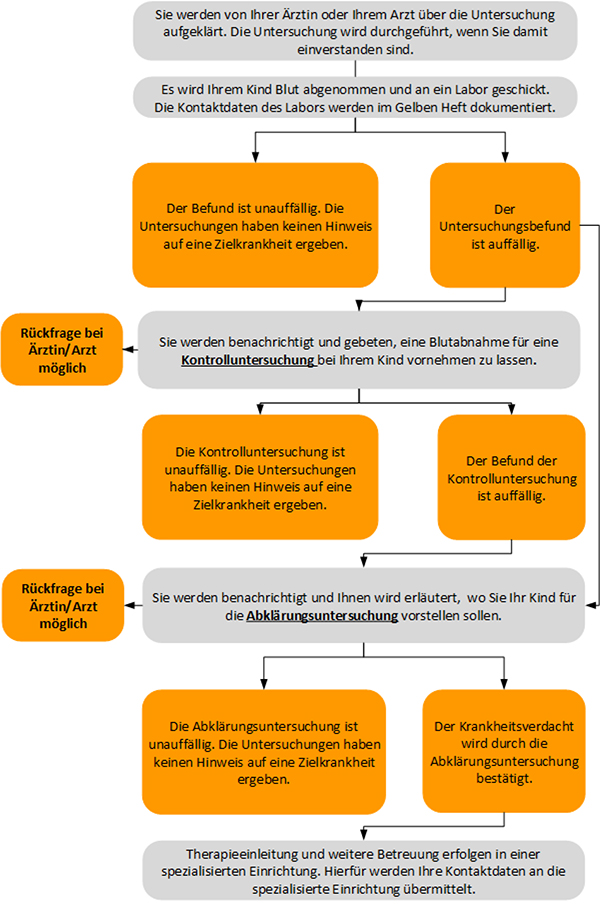
Folgende Abbildung wird nach der Überschrift „Elterninformation zum Erweiterten Neugeborenen-Screening“ eingefügt:
- 2.
-
Der Abschnitt „Warum werden Früherkennungsuntersuchungen durchgeführt?“ wird wie folgt geändert:
- a)
-
In dem Satz „Deshalb finden seit über 30 Jahren bei allen Neugeborenen Blutuntersuchungen statt.“ werden die Wörter „seit über 30 Jahren“ gestrichen.
- b)
-
In dem Satz „Diese Untersuchung wurde nun wesentlich verbessert, weitere behandelbare Erkrankungen sind in die Untersuchung eingeschlossen worden.“ werden die Wörter „Untersuchung wurde nun wesentlich verbessert“ durch die Wörter „Untersuchungen werden stetig weiterentwickelt“ ersetzt.
- 3.
-
Dem Abschnitt „Wann und wie wird untersucht?“ wird folgender Satz angefügt:
„Wenn Sie weitere Fragen zur Durchführung des Neugeborenen-Screenings haben, können Sie sich an Ihre Ärztin oder Ihren Arzt wenden oder im Labor anrufen. Die Kontaktdaten des Labors finden Sie im Untersuchungsheft ihres Kindes.“
- 4.
-
Der Abschnitt „Wer erfährt das Testergebnis?“ wird wie folgt geändert:
- a)
-
Der Satz „In jedem Falle erhält der Einsender der Blutprobe innerhalb weniger Tage einen schriftlichen Befund vom Screeninglabor.“ wird gestrichen.
- b)
-
Der Satz „In dringenden Fällen wird unverzüglich zusätzlich direkt mit Ihnen Kontakt aufgenommen.“ wird wie folgt gefasst: „Bei auffälligen Untersuchungsergebnissen wird unverzüglich direkt mit Ihnen Kontakt aufgenommen.“
- c)
-
Nach dem Satz „Unauffällige Untersuchungsergebnisse werden Ihnen nur auf Ihre persönliche Nachfrage hin mitgeteilt.“ wird folgender Satz angefügt: „Die Kontaktdaten des Labors, an das die Blutprobe geschickt wurde, werden im Untersuchungsheft für Kinder dokumentiert.“
- 5.
-
In dem Abschnitt „Was bedeutet das Testergebnis?“ werden nach dem Satz „Eine Wiederholung eines Testes kann aber auch notwendig sein, wenn zum Beispiel der Zeitpunkt der Blutabnahme nicht optimal war.“ folgende Sätze angefügt: „In diesen Fällen sollte – vorausgesetzt Sie willigen darin ein – dasselbe Labor die Tests durchführen. Wenn Sie Fragen zur Wiederholung der Untersuchung haben, können Sie im Labor anrufen.“
- 6.
-
Nach dem Abschnitt „Was bedeutet das Testergebnis?“ wird folgender Abschnitt eingefügt:
„Was müssen Sie tun, wenn der Screeningbefund auffällig ist?
Ihnen wird von einer Ärztin oder einem Arzt mitgeteilt, in welcher spezialisierten Einrichtung Sie mit Ihrem Kind eine Abklärungsuntersuchung durchführen lassen können. Diese ist notwendig, um den Screeningbefund zu überprüfen und eventuell Therapiemaßnahmen einzuleiten. Über die Art der Untersuchung und die Therapiemöglichkeiten werden Sie in dieser Einrichtung umfassend aufgeklärt.“
- 7.
-
Der Abschnitt „Können diese Krankheiten geheilt werden?“ wird wie folgt geändert:
- a)
-
Die Überschrift „Können diese Krankheiten geheilt werden?“ wird wie folgt gefasst: „Wie werden diese Krankheiten behandelt?“
- b)
-
Der Satz „Alle genannten Stoffwechseldefekte, endokrinen und neuromuskulären Störungen sowie Blut- und Immundefekte sind angeboren und können in den meisten Fällen nicht geheilt werden.“ wird gestrichen.
- c)
-
Der Satz „Jedoch können die Auswirkungen dieser angeborenen Störungen mit einer entsprechend frühzeitigen Behandlung vermieden oder zumindest vermindert werden.“ wird wie folgt gefasst: „Die Auswirkungen dieser angeborenen Störungen können mit einer entsprechend frühzeitigen Behandlung vermieden oder zumindest vermindert werden.“
- d)
-
In dem Satz „Ihr Einverständnis umfasst nur die oben genannten Zielerkrankungen sowie die Weitergabe der personenbezogenen Angaben zur Durchführung des erweiterten Neugeborenen-Screenings.“ wird das Wort „nur“ durch die Wörter „das erweiterte Neugeborenen-Screening auf“ und das Wort „Weitergabe“ durch das Wort „Verarbeitung“ ersetzt.
- e)
-
Der Satz „Wir sind mit der Durchführung der Untersuchung und der Übermittlung der hierfür vorgesehenen Angaben einverstanden.“ wird wie folgt gefasst: „Wir sind mit der Durchführung der Untersuchung, der Verarbeitung der hierfür vorgesehenen Angaben und im Falle eines auffälligen Befunds mit der Befundübermittlung durch die Laborärztin/den Laborarzt einverstanden.“
- f)
-
Dem Abschnitt werden folgende Sätze angefügt:
„Auch sind wir im Falle eines auffälligen Befunds einverstanden mit der Befundweitergabe an eine von uns noch auszuwählende spezialisierte Einrichtung, in der die Abklärungsuntersuchung durchgeführt werden kann, sowie mit der Weitergabe unserer Kontaktdaten an diese zum Zweck der Kontaktaufnahme mit uns. Wenn sich das Kind noch im Krankenhaus befindet, darf ein auffälliger Befund der behandelnden Ärztin/dem behandelnden Arzt im Krankenhaus durch die Laborärztin/den Laborarzt übermittelt werden, wenn wir hierin nach Befundübermittlung an uns eingewilligt haben. Im Falle eines nicht abgeklärten auffälligen Befunds sowie einer fehlenden Zweitscreeningkarte sind wir mit der Kontaktaufnahme der Laborärztin/des Laborarztes zwecks Erinnerung einverstanden. Wir nehmen zur Kenntnis, dass wir im Zuge einer Mitteilung eines auffälligen Befunds am Telefon von der Laborärztin/von dem Laborarzt über das weitere mögliche Vorgehen informiert werden. In diesem Gespräch werden wir um Einwilligung in die 1. Befundweitergabe an eine eventuell im Krankenhaus behandelnde Ärztin oder einen im Krankenhaus behandelnden Arzt, 2. Befundweitergabe an eine von uns dann auszuwählende spezialisierte Einrichtung und 3. in die Kontaktaufnahme derselben mit uns sowie die Kontaktaufnahme der Laborärztin/des Laborarztes zwecks Erinnerung gebeten.“
Die Änderungen der Richtlinie treten am Tag nach der Veröffentlichung im Bundesanzeiger in Kraft. Sie sind erst nach Ablauf von sechs Monaten ab ihrem Inkrafttreten anzuwenden. Bis zu diesem Zeitpunkt gilt die Richtlinie in ihrer vor dem Inkrafttreten dieses Beschlusses geltenden Fassung.
Die Tragenden Gründe zu diesem Beschluss werden auf den Internetseiten des G-BA unter www.g-ba.de veröffentlicht.
Gemeinsamer Bundesausschuss
gemäß § 91 SGB V
Der Vorsitzende







Neueste Kommentare