Bundesamt
für Verbraucherschutz und Lebensmittelsicherheit
Bekanntmachung
der Arbeit der Zentralen Kommission
für die Biologische Sicherheit im Jahr 2021
(BVL 124/2022/4)
32. Bericht nach Inkrafttreten des Gentechnikgesetzes
Nachfolgend wird der vorgenannte Bericht über die Arbeit der Zentralen Kommission für die Biologische Sicherheit im Jahr 2021 bekannt gegeben (Anlage).
Berlin, den 12. April 2022
(BVL 45040)
Bundesamt
für Verbraucherschutz und Lebensmittelsicherheit
Im Auftrag
Dr. Anke Stein
Gliederung
1 Einleitung
1.1 Grundlagen der ZKBS
1.2 Entwicklung der Gentechnik in der Bundesrepublik Deutschland und in anderen Mitgliedstaaten der Europäischen Union
2 Zusammensetzung der ZKBS
3 Beratungstätigkeit der ZKBS im Jahre 2021
3.1 Arbeitsweise
3.2 Arbeitskreise
3.3 Beratung der Bundesregierung, der zuständigen Landesbehörden und des BVL
3.4 Risikobewertung von Spender- und Empfängerorganismen
3.5 Sicherheitseinstufung gentechnischer Arbeiten und Bewertung sicherheitstechnischer Maßnahmen von gentechnischen Anlagen
3.6 Allgemeine Stellungnahmen und Berichte
3.7 Stellungnahmen zu Freisetzungen
3.8 Stellungnahmen zu Inverkehrbringen
3.9 Berichte über Themen von allgemeiner Bedeutung
Abkürzungen
| ATMP | Arzneimittel für neuartige Therapien |
| BfN | Bundesamt für Naturschutz |
| BfR | Bundesinstitut für Risikobewertung |
| BMEL | Bundesministerium für Ernährung und Landwirtschaft |
| BVL | Bundesamt für Verbraucherschutz und Lebensmittelsicherheit |
| EFSA | European Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) |
| EG | Europäische Gemeinschaft |
| EMA | European Medicines Agency (Europäische Arzneimittel-Agentur) |
| EU | Europäische Union |
| EuGH | Europäischer Gerichtshof |
| FLI | Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit |
| GenTG | Gentechnikgesetz |
| GenTSV | Gentechnik-Sicherheitsverordnung |
| GVO | gentechnisch veränderter Organismus |
| JKI | Julius Kühn-Institut, Bundesforschungsinstitut für Kulturpflanzen |
| PEI | Paul-Ehrlich-Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel |
| RKI | Robert Koch-Institut, Bundesinstitut für die öffentliche Gesundheit |
| ZKBS | Zentrale Kommission für die Biologische Sicherheit |
Fachliche Abkürzungen werden im Text erklärt.
1 Einleitung
1.1 Grundlagen der ZKBS
Die Zentrale Kommission für die Biologische Sicherheit (ZKBS) ist eine Sachverständigenkommission, die sich aus 20 Mitgliedern und 20 stellvertretenden Mitgliedern zusammensetzt. Die Mitglieder sind Expertinnen bzw. Experten verschiedener Fachrichtungen und werden von Expertinnen bzw. Experten der gleichen Fachrichtung vertreten. Die vertretenen Fachgebiete sind im Gentechnikgesetz (GenTG) vorgegeben. Die ZKBS prüft und bewertet sicherheitsrelevante Fragen zur Gentechnik nach den Vorschriften des GenTG und berät die Bundesregierung und die Bundesländer. Sie gibt gegenüber den zuständigen Behörden Stellungnahmen ab, insbesondere zur Risikobewertung von Mikroorganismen, zur Sicherheitseinstufung gentechnischer Arbeiten, zu erforderlichen Sicherheitsmaßnahmen in gentechnischen Anlagen und zu möglichen Risiken einer Freisetzung oder des Inverkehrbringens von gentechnisch veränderten Organismen (GVO). Sie berücksichtigt bei ihren Empfehlungen die internationale Entwicklung auf dem Gebiet der gentechnischen Sicherheit. Die Mitglieder der ZKBS und ihre Stellvertretenden versehen ihre Tätigkeit entsprechend dem GenTG ehrenamtlich.
Die ZKBS hat ihre Geschäftsstelle am Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL), das zum Geschäftsbereich des Bundesministeriums für Ernährung und Landwirtschaft (BMEL) gehört. Die Mitglieder der ZKBS und ihre Stellvertreter und Stellvertreterinnen werden vom BMEL im Einvernehmen mit den Bundesministerien für Bildung und Forschung, für Wirtschaft und Energie, für Arbeit und Soziales, für Gesundheit sowie für Umwelt, Naturschutz und nukleare Sicherheit für die Dauer von drei Jahren berufen. Eine Wiederberufung ist zulässig.
Die ZKBS hat eine Vorsitzende, der zwei Stellvertreter zur Seite stehen. Die Kommission fasst ihre Beschlüsse entweder auf einer der regelmäßigen Sitzungen oder in einem schriftlichen Verfahren. Die Mitglieder der ZKBS und ihre Stellvertreterinnen und Stellvertreter sind zur Verschwiegenheit verpflichtet. Die Sitzungen sind nicht öffentlich, jedoch veröffentlicht die ZKBS allgemeine Stellungnahmen und berichtet jährlich der Öffentlichkeit über ihre Arbeit.
1.2 Entwicklung der Gentechnik in der Bundesrepublik Deutschland und in anderen Mitgliedstaaten der Europäischen Union
Gentechnische Arbeiten und gentechnische Anlagen
Unter dem Begriff „gentechnische Arbeiten“ werden insbesondere die Erzeugung von GVO und der Umgang mit GVO zusammengefasst. Gentechnische Arbeiten müssen abhängig von ihrer Sicherheitsstufe bei der zuständigen Landesbehörde angezeigt, angemeldet oder genehmigt und in einer gentechnischen Anlage durchgeführt werden, die ebenfalls abhängig von der Sicherheitsstufe angezeigt, angemeldet oder genehmigt werden muss. Gentechnische Anlagen können Laboratorien, Produktionsanlagen, Gewächshäuser und/oder Tierräume sein.
Grundsätzlich holt die zuständige Behörde vor der Entscheidung über eine Genehmigung eine Stellungnahme der ZKBS zur sicherheitstechnischen Einstufung der vorgesehenen gentechnischen Arbeiten und zu den erforderlichen sicherheitstechnischen Maßnahmen ein. Dabei handelt es sich in der Regel um gentechnische Arbeiten der Sicherheitsstufen 3 oder 4 und um gentechnische Anlagen mit Sicherheitsmaßnahmen der Stufen 3 oder 4. Die zuständige Behörde bittet aber die ZKBS auch um Stellungnahmen zu solchen gentechnischen Arbeiten der Sicherheitsstufe 2, die nicht mit anderen Arbeiten vergleichbar sind, zu denen die ZKBS in der Vergangenheit bereits eine Stellungnahme abgegeben hat, oder zu solchen gentechnischen Arbeiten, deren Zuordnung zur Sicherheitsstufe 1 unsicher ist.
Seit Inkrafttreten des GenTG im Jahre 1990 wurden der ZKBS 2 183 Erstanträge auf Sicherheitseinstufung gentechnischer Arbeiten und/oder auf Bewertung der erforderlichen sicherheitstechnischen Maßnahmen vorgelegt. Im Berichtsjahr wurden 59 Erst- oder Erweiterungsanträge eingereicht, die ZKBS gab hierzu 52 Stellungnahmen ab.
In Deutschland sind insgesamt 6 720 gentechnische Anlagen angezeigt, angemeldet oder genehmigt (Stand: Dezember 2021). Tabelle 1 listet die gentechnischen Anlagen nach der Stufe der Sicherheitsmaßnahmen auf. Tabelle 2 fasst die je nach Sicherheitsstufe in Deutschland angezeigten, angemeldeten oder genehmigten gentechnischen Arbeiten zusammen.
- Tabelle 1
-
Angezeigte, angemeldete oder genehmigte gentechnische Anlagen in Deutschland
(Stand: Dezember 2021)
| Stufe | Anzahl |
|---|---|
| S1 | 4 765 |
| S2 | 1 853 |
| S3 | 97 |
| S4 | 5 |
Im Vergleich zu den vergangenen fünf Jahren ist die Gesamtzahl von 6 000 bis 7 000 gentechnischen Anlagen der Stufen 1 bis 4 weitgehend stabil geblieben. Den größten Anteil nehmen die Anlagen der Sicherheitsstufen 1 und 2 ein (siehe Abbildung 1).
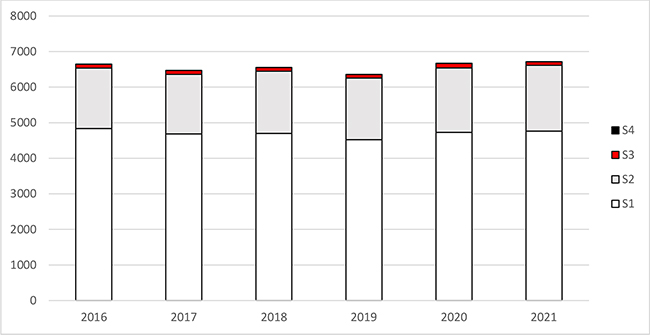
Abbildung 1: Dargestellt sind die Zahlen der angezeigten, angemeldeten oder genehmigten gentechnischen Anlagen Deutschlands, differenziert nach Sicherheitsstufe (S1-S4) in den Jahren 2016 bis 2021.
- Tabelle 2
-
Derzeit angezeigte, angemeldete oder genehmigte gentechnische Arbeiten in Deutschland
(Stand: Dezember 2021)*
| Stufe | Anzahl |
|---|---|
| S2 | 9 185 |
| S3 | 417 |
| S4 | 22 |
- *
- Eine genaue Angabe ist für die durchgeführten gentechnischen Arbeiten der Sicherheitsstufe 1 nicht möglich, da die Betreiber gemäß § 9 GenTG zwar zur Aufzeichnung weiterer Arbeiten der Sicherheitsstufe 1 verpflichtet sind, jedoch keine Anzeige- oder Meldepflicht gegenüber der zuständigen Landesbehörde besteht. Somit werden weitere S1-Arbeiten in den behördlichen Datenbanken nicht erfasst.
Weitere Informationen zu gentechnischen Arbeiten und gentechnischen Anlagen werden über die Internet-Seite der ZKBS zur Verfügung gestellt: https://www.zkbs-online.de.
Ein Vergleich der Anzahl der gentechnischen Arbeiten oder gentechnischen Anlagen zwischen Deutschland und anderen Mitgliedstaaten der Europäischen Union (EU) ist nicht möglich, da hierzu keine Informationen vorliegen. Allgemeine Informationen zur Umsetzung der zugrunde liegenden Richtlinie 2009/41/EG werden der Europäischen Kommission in regelmäßigen Abständen von den Mitgliedsstaaten zur Verfügung gestellt. Diese werden durch die Europäische Kommission zusammengefasst und auf ihrer Internetseite veröffentlicht1.
Freisetzungen von GVO
Werden bei einem Experiment GVO zeitlich und räumlich begrenzt in die Umwelt ausgebracht, handelt es sich um eine „Freisetzung“. Für jede beabsichtigte Freisetzung muss gemäß GenTG beim BVL eine Genehmigung eingeholt werden, die dann erteilt werden kann, wenn von der geplanten Freisetzung keine schädlichen Auswirkungen für Menschen, die Umwelt in ihrem Wirkungsgefüge, Tiere, Pflanzen sowie Sachgüter ausgehen. Liegt für die GVO, die freigesetzt werden sollen, bereits eine Genehmigung für das Inverkehrbringen vor, ist keine gesonderte Genehmigung erforderlich.
In Deutschland ist das BVL seit dem 1. April 2004 als Bundesoberbehörde für die Genehmigung von Freisetzungen von GVO zuständig, zuvor war es das Robert Koch-Institut (RKI). Das BVL trifft die Entscheidungen im Benehmen mit dem Bundesamt für Naturschutz (BfN), dem Bundesinstitut für Risikobewertung und dem RKI. Die ZKBS, das Julius Kühn-Institut (JKI) und die zuständige Behörde des betroffenen Bundeslandes geben Stellungnahmen zum Freisetzungsvorhaben ab. Im Falle der Freisetzung von gentechnisch veränderten Wirbeltieren oder von gentechnisch veränderten Mikroorganismen, die an Wirbeltieren angewendet werden, wird auch das Friedrich-Loeffler-Institut (FLI) beteiligt. Die anderen EU-Mitgliedstaaten werden über Freisetzungsanträge informiert und können Stellung dazu nehmen.
Wie in den Jahren 2013 bis 2020 wurden in Deutschland auch im Jahr 2021 weder Freisetzungen von GVO beantragt, noch Genehmigungen für solche Freisetzungen erteilt. Ein Vergleich der eingereichten Freisetzungsanträge aus den verschiedenen Mitgliedstaaten der EU zeigt, dass 2021 nur vereinzelt Anträge in Spanien (2), Schweden (1), Island (1) und Belgien (1) gestellt worden sind. Einzelheiten zu den Anträgen können dem von der Kommission geführten Register entnommen werden2. In Großbritannien gestellte Anträge sind in diesem Register wegen des Austritts aus der EU nicht mehr erfasst.
Inverkehrbringen von GVO
Unter „Inverkehrbringen“ versteht man die Abgabe von GVO und Produkten, die GVO enthalten oder aus solchen hergestellt wurden, an Dritte, meist zu Zwecken der Vermarktung.
Für das Inverkehrbringen von GVO bedarf es eines EU-weiten Genehmigungsverfahrens. In diesem Verfahren wird unterschieden, ob der GVO als Lebens- oder Futtermittel genutzt werden soll [Verordnung (EG) Nr. 1829/2003] oder nicht [Richtlinie 2001/18/EG]. Produkte aus GVO, die nicht in den Geltungsbereich der genannten Verordnung oder Richtlinie fallen, wie z. B. Kleidung aus Baumwolle, bedürfen keiner Genehmigung zum Inverkehrbringen. Nach Durchlaufen des EU-weiten Verfahrens gilt die Genehmigung für alle Mitgliedstaaten der EU.
Das BVL ist die zuständige deutsche Behörde und gibt eine nationale Stellungnahme zu Anträgen auf Inverkehrbringen von GVO im Benehmen mit dem BfN, dem BfR und dem RKI ab. Zuvor wird eine Stellungnahme des JKI und, falls es sich bei den GVO um Wirbeltiere oder Mikroorganismen handelt, die an Wirbeltieren angewendet werden sollen, auch eine Stellungnahme des FLI und des Paul-Ehrlich-Instituts (PEI) eingeholt.
Zudem bittet das BVL die ZKBS um eine Stellungnahme zu solchen Anträgen nach Richtlinie 2001/18/EG, die in Deutschland eingereicht wurden. Bei Anträgen nach Verordnung (EG) Nr. 1829/2003 holt das BVL dann eine Stellungnahme der ZKBS ein, wenn Deutschland von der EFSA mit einer Umweltrisikoprüfung eines Antrages auf Anbau beauftragt wurde. In 2021 gab es keine diesbezüglichen Anfragen an die ZKBS.
Derzeit sind Events (Anzahl in Klammern) folgender Pflanzen zumeist für die Einfuhr als vermehrungsfähiger GVO und dessen Verarbeitung oder als Lebens- und Futtermittel zugelassen:
- –
-
Baumwolle (14, +2 im Vergleich zum Vorjahr)
- –
-
Mais (80, +15 im Vergleich zum Vorjahr)
- –
-
Raps (16, +1 im Vergleich zum Vorjahr)
- –
-
Soja (25, +6 im Vergleich zum Vorjahr)
- –
-
Zierpflanzen (5, +0 im Vergleich zum Vorjahr)
- –
-
Zuckerrübe (1, +0 im Vergleich zum Vorjahr)
Weiterführende Details sind auf den Internetseiten des BVL3 sowie in den Einträgen des Registers der EU zu finden4.
Im Unterschied zu örtlich und zeitlich begrenzten Freisetzungsversuchen ist der landwirtschaftliche Anbau gentechnisch veränderter Pflanzen nicht auf bestimmte Standorte oder Versuchsjahre beschränkt. Ein Anbau von gentechnisch veränderten Pflanzen durch Landwirte kann erst dann stattfinden, wenn das Inverkehrbringen des gentechnisch veränderten Saatguts zum Zweck der Ausbringung in die Umwelt genehmigt worden ist. Eine Genehmigung gilt in der Regel für zehn Jahre und muss danach verlängert werden. Verantwortlich für die wissenschaftliche Bewertung ist die EFSA.
Entscheidung des Europäischen Gerichtshofs (EuGH), dass mit neuen Mutageneseverfahren hergestellte Pflanzen GVO sind
Nach einer Klage französischer (Landwirtschafts-)Verbände beim französischen Staatsrat hat der hierzu angefragte EuGH in seinem Urteil vom 25. Juli 2018 festgestellt, dass sowohl mit konventionellen als auch mit neuen Mutageneseverfahren hergestellte Pflanzen gentechnisch veränderte Organismen sind. Sie fallen somit unter die Regularien der EU-Richtlinie 2001/18/EG. Allerdings sind mittels konventioneller Mutagenese erzeugte GVO vom Anwendungsbereich der Richtlinie ausgenommen. Dies führt dazu, dass genomisch identische Organismen unterschiedlich reguliert werden.
Auch in 2021 setzte sich die ZKBS intensiv mit den Auswirkungen des EuGH Urteils C-528/16 auseinander. Nach wie vor ist die ZKBS der Auffassung, dass das europäische Gentechnikrecht, das wesentlich auf dem Wissensstand von 1990 beruht, dringend an den heutigen Stand des Wissens angepasst werden muss.
Die im April 2021 veröffentlichte, von der Europäischen Kommission beauftragte Studie zum Stand neuer Mutageneseverfahren innerhalb der EU-Gesetzgebung kam ebenfalls zu dem Ergebnis, dass eine Anpassung der derzeitigen GVO-Gesetzgebung an den Stand von Wissenschaft und Technik unbedingt notwendig sei. Der Schlussfolgerung folgend bereitet die Kommission zunächst eine Gesetzgebung für Pflanzen und daraus hergestellte Lebens- und Futtermittelprodukte vor, welche durch gezielte Mutagenese und Cisgenese hergestellt werden. In einer roadmap skizzierte sie Inhalte und geplantes Vorgehen und gab der Öffentlichkeit Gelegenheit dies zu kommentieren5. In ihrem Beitrag begrüßte die ZKBS die Initiative der Kommission. Sie stellte dabei heraus, dass vermieden werden muss, dass identische Pflanzen unterschiedlich reguliert werden. Das Vorhaben der Kommission, auch sozioökonomische Aspekte (z. B. Nachhaltigkeit) in den Mechanismus der Bewertung/Regulierung einzubringen, hält die ZKBS nur dann für sinnvoll, wenn diese von der Risikobewertung separiert werden.
Klinische Prüfungen mit GVO-haltigen Prüfprodukten und Anwendung von GVO-haltigen Arzneimitteln am Menschen
Gemäß § 2 Absatz 3 GenTG ist die Anwendung GVO-haltiger Prüfprodukte am Menschen von gentechnikrechtlichen Regularien in Deutschland ausgenommen. Die Genehmigung klinischer Prüfungen mit Prüfpräparaten, die aus einem GVO oder einer Kombination von GVO bestehen oder solche enthalten, ist in der Verordnung zur Anwendung der guten klinischen Praxis bei der Durchführung von klinischen Prüfungen mit Arzneimitteln zur Anwendung am Menschen geregelt (GCP-Verordnung). Für die Erteilung der Genehmigung ist in Deutschland das PEI als obere Bundesbehörde zuständig. Das BVL wird als Benehmensbehörde bei der Bewertung des Risikos für die Umwelt und bei der Feststellung zur Abgrenzung bestimmter Tätigkeiten zum GenTG beteiligt und berichtet der ZKBS hierzu. In einigen Fällen bewertet die ZKBS das Gefährdungspotenzial der verwendeten GVO in einer Stellungnahme.
Im Jahr 2021 wurden 16 Genehmigungen durch das PEI erteilt, bei denen das BVL beteiligt war. Bei den Prüfprodukten handelte es sich um potenzielle Arzneimittel für neuartige Therapien (ATMP), wie der Behandlung von Krebserkrankungen mit umprogrammierten körpereigenen Zellen zur Immunstimulierung oder gentherapeutische Ansätze für schwerwiegende Erkrankungen aufgrund monogenetischer Erbdefekte, oder um neuartige Impfstoffe gegen Infektionskrankheiten. Eine Übersicht über genehmigte klinische Prüfungen in der EU bietet das Register der Europäischen Union6.
Die Zulassung der Anwendung humaner Arzneimittel, die aus einem GVO oder einer Kombination von GVO bestehen oder solche enthalten, erfolgt über ein zentralisiertes Verfahren durch die Europäische Kommission gemäß der Verordnung 726/2004/EG. Die Antragstellung erfolgt bei der Europäischen Arzneimittelbehörde (EMA), die im Rahmen ihrer Aufgabe Leitfäden für die Bewertung erstellt und die wissenschaftliche Koordinierung der Verfahren übernimmt. Bei der Umweltverträglichkeitsanalyse werden die gemäß der Richtlinie 2001/18/EG zuständigen Behörden der Mitgliedsstaaten beteiligt, welche in Deutschland das BVL ist. Wie auch bei den klinischen Prüfungen ist ein Anstieg an Anträgen auf Marktzulassungen für ATMPs zu verzeichnen. Bei den beantragten Produkten handelt es sich vermehrt um umprogrammierte körpereigene T-Zellen für die Therapie von Krebserkrankungen und um Impfstoffe. Eine Übersicht über bereits zugelassene ATMPs ist auf der Internetseite des PEI dargestellt7. Auch hierzu wird der ZKBS regelmäßig berichtet.
2 Zusammensetzung der ZKBS
In der ZKBS kommen Expertinnen und Experten verschiedener Fachgebiete zusammen. Auf diese Weise wird für die im GenTG vorgegebenen Aufgaben der ZKBS, nämlich die Bewertung von Mikroorganismen als Spender- und Empfängerorganismen für gentechnische Arbeiten, die Sicherheitseinstufung gentechnischer Arbeiten, die Bewertung sicherheitstechnischer Maßnahmen gentechnischer Anlagen sowie die Bewertung von Freisetzungen und Inverkehrbringen von GVO, ein breit gefächerter Sachverstand institutionalisiert und zur Verfügung gestellt. In Tabelle 3 ist die Besetzung der ZKBS dargestellt.
Prof. Dr. Sigrun Smola, seit 2012 Mitglied für den Bereich Virologie, ist seit Juni 2016 Vorsitzende der ZKBS. Stellvertretende Vorsitzende sind Prof. Dr. Uwe Groß und Prof. Dr. Dr. Thomas Vahlenkamp (Stand: Dezember 2021).
Die Berufungszeiträume von Frau Prof. Dr. Andrea Hartwig, seit 2018 Mitglied für den Bereich Toxikologie, Herrn Dr. Siegfried Throm, seit 2002 Mitglied für den Bereich Wirtschaft, Herrn Dr. Jürgen Vorlop, seit 2015 stellvertretenes Mitglied für den Bereich Sicherheitstechnik, und Herrn Prof. Dr. W. Durka, seit 2012 Mitglied für den Bereich Ökologie, endeten in 2020.
Es fanden folgende Neuberufungen statt:
Herr Prof. Dr. Edmund Maser wurde ausgehend von seiner stellvertretenden Position zum Mitglied für den Bereich Toxikologie ernannt, Herr Prof. Dr. Michael Pester ausgehend von seiner stellvertretenden Position zum Mitglied für den Bereich Ökologie. Frau Dr. Sabine Sydow wurde als Mitglied für den Bereich Wirtschaft berufen. Herr Dr. Holger Lübben wurde als stellvertretendes Mitglied für den Bereich Sicherheitstechnik berufen.
Die in Tabelle 3 dargestellte Zusammensetzung der ZKBS entspricht dem GenTG in der aktuell gültigen Fassung.
- Tabelle 3
-
Fachgebiete und Mitglieder der ZKBS (Stand: Dezember 2021)
| Fachgebiet | Mitglied | stellvertretendes Mitglied |
|---|---|---|
| Sachverständige nach § 4 Absatz 1 Nummer 1 GenTG | ||
| Mikrobiologie | Prof. Dr. Petra Dersch Universität Münster |
Prof. Dr. Susanne Hartmann Freie Universität Berlin |
| Zellbiologie | Prof. Dr. Michael Meisterernst Universität Münster |
N.N. |
| Virologie | Prof. Dr. Dr. Thomas W. Vahlenkamp Universität Leipzig |
Prof. Dr. Edgar Maiß Universität Hannover |
| Virologie | Prof. Dr. Sigrun Smola Universität des Saarlandes |
Prof. Dr. Stefan Pöhlmann Deutsches Primatenzentrum GmbH, Göttingen Prof. Dr. Anja Ehrhardt Universität Witten/Herdecke |
| Genetik | Prof. Dr. Jürgen Wienands Universität Göttingen |
Prof. Dr. Jens Boch Universität Hannover |
| Genetik | Prof. Dr. Uwe Sonnewald Universität Erlangen-Nürnberg |
Prof. Dr. Uwe Völker Universität Greifswald |
| Hygiene | Prof. Dr. Uwe Groß Universität Göttingen |
Prof. Dr. Werner Solbach Universität zu Lübeck |
| Ökologie | Prof. Dr. Michael Pester Deutsche Sammlung von Mikroorganismen und Zellkulturen, Braunschweig |
N.N. |
| Ökologie | Prof. Dr. Rainer Waldhardt Universität Gießen |
Prof. Dr. Martin Hasselmann Universität Hohenheim |
| Pflanzenzucht | Prof. Dr. Karl Schmid Universität Hohenheim |
Prof. Dr. Maria v. Korff-Schmising Universität Düsseldorf |
| Sicherheitstechnik | Dr. Sven Deutschmann Roche-Diagnostics GmbH, Penzberg |
Dr. Holger Lübben GlaxoSmithKline Marburg |
| Toxikologie | Prof. Dr. Edmund Maser Universität zu Kiel |
N.N. |
| Sachkundige nach § 4 Absatz 1 Nummer 2 GenTG | ||
| Arbeitsschutz | Frank Gerschke Landesamt für Arbeitsschutz Potsdam |
Dr. Daniela Harkensee Berufsgenossenschaft Rohstoffe und chemische Industrie, Hamburg |
| Gewerkschaften | Prof. Dr. Dr. h. c. Wilfried Wackernagel Universität Oldenburg |
Dr. Brigitte Dreiseikelmann Universität Bielefeld |
| Landwirtschaft | Prof. Dr. Joseph-Alexander Verreet Universität zu Kiel |
Prof. Dr. Ulrich Schurr Universität Düsseldorf |
| Naturschutz | N.N. | N.N. |
| Forschungsfördernde Organisationen | Dr. Ingrid Ohlert Deutsche Forschungsgemeinschaft, Bonn |
Dr. Jan-Wolfhard Kellmann Universität Marburg |
| Umweltschutz | Dr. Gerd Neemann BLaU-Umweltstudien, Göttingen |
N.N. |
| Verbraucherschutz | Sigrid Lewe-Esch Deutscher Evangelischer Frauenbund e. V., Duisburg |
Annette Neuhaus Kreisoberchemierätin – Kreis Lippe, Detmold |
| Wirtschaft | Dr. Sabine Sydow vfa Die forschenden Pharmaunternehmen, Berlin |
Dr. Anja Matzk KWS SAAT SE, Einbeck |
3 Beratungstätigkeit der ZKBS im Jahre 2021
3.1 Arbeitsweise
Die Arbeitsweise der ZKBS ist in ihrer Geschäftsordnung geregelt, die im Jahr 2018 an aktuelle Standards für Rechtsvorschriften angepasst worden ist.
Auch das Jahr 2021 war geprägt durch die Pandemie, die durch Infektionen mit dem Virus Severe acute respiratory syndrome-related coronavirus Type 2 (SARS-CoV-2) ausgelöst worden ist. Die behördlich angeordneten Eindämmungsmaßnahmen verhinderten die Durchführung von Präsenzsitzungen, sodass im Jahr 2021 sechs ordentliche Sitzungen in Form von Videokonferenzen durchgeführt wurden.
Die Pandemie führte bundesweit zu vermehrten Forschungsarbeiten zur Erforschung des Virus sowie zur Entwicklung von therapeutischen und präventiven Ansätzen. Aufgrund der Genehmigungspflicht gentechnischer Arbeiten mit dem Virus wurde die ZKBS bei der Sicherheitsbewertung dieser Vorhaben von den zuständigen Landesbehörden beteiligt. Dies spiegelte sich in einer auch im Jahr 2021 erhöhten Anzahl insgesamt eingehender Anträge auf Durchführung gentechnischer Arbeiten wider (siehe 3.5). Der Präsident des BVL schätzte das besondere Engagement des Expertengremiums und bekundete dies bei seinen regelmäßigen Teilnahmen an Sitzungen der ZKBS durch anerkennende und dankende Grußworte.
Auf den Sitzungen wurden die meisten Stellungnahmen der ZKBS verabschiedet. Daneben wurden aber auch Entscheidungen im schriftlichen Verfahren getroffen, wenn einfachere Fragestellungen vorlagen, die keine ausführliche Diskussion zwischen allen Mitgliedern erforderten.
3.2 Arbeitskreise
Im Jahr 2021 wurde insbesondere die Arbeit des Arbeitskreises „Synthetische Biologie“ weitergeführt. Kontinuierlich werden Publikationen hinsichtlich neuester Entwicklungen gesichtet und ein Erfordernis für eine Anpassung gentechnikrechtlicher Regularien überprüft. Die Ergebnisse des kontinuierlichen Monitorings werden regelmäßig auf der Internetseite der ZKBS zur Verfügung gestellt8.
Fortgeführt wurden zwei Arbeitskreise, die im Jahr 2020 gegründet wurden, um allgemeine Stellungnahmen mit Kriterien für die Herstellung der Vergleichbarkeit zur Bewertung gentechnischer Arbeiten aus dem Bereich der Virologie zu überarbeiten oder neu zu erstellen. Im Februar 2021 wurde die Allgemeine Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Gentechnische Arbeiten mit von RNA-Viren abgeleiteten Replikons, Minigenomen und virusähnlichen Partikeln zum Einbringen in humane oder tierische Zellen, Az. 45310.0118 verabschiedet, im April 2021 die Aktualisierung der allgemeinen Stellungnahmen zum Gentransfer mithilfe von Adenovirus Typ 5 (Az. 6790-10-28) und zur Risikobewertung Adeno-assoziierter Viren aus Primaten und davon abgeleiteter Vektoren (Az. 6790-10-73).
Ein neu eingerichteter Arbeitskreis unter Hinzuziehung der externen Expertise von Herrn Prof. Dr. J. Jehle, Leiter des Instituts für Biologischen Pflanzenschutz am JKI, entwickelte Kriterien für die Bewertung des Gefährdungspotenzials, das von Insektenviren ausgeht. Im September 2021 wurde von der ZKBS eine allgemeine Stellungnahme hierzu verabschiedet.
Die Erarbeitung des Kommentars der ZKBS zur roadmap der Kommission für die Etablierung einer gesetzlichen Grundlage zur Bewertung von Pflanzen, die mithilfe neuer molekularbiologischer Techniken hergestellt werden, erfolgte ebenfalls in einem Arbeitskreis.
3.3 Beratung der Bundesregierung, der zuständigen Landesbehörden und des BVL
Folgende Fragen der zuständigen Landesbehörden wurden von der ZKBS diskutiert und bewertet:
- –
-
Bewertung gentechnischer Arbeiten mit einem mutierten Coxsackievirus B3
- –
-
Erforderlichkeit von Sichtfenstern in der Tür einer S3-Anlage
- –
-
Bewertung von Verfahren zur chemischen Inaktivierung von Zellkulturen
- –
-
Bewertung des Erfordernisses von Sicherheitsmaßnahmen bei elektrophysiologischen Untersuchungen an Gewebeschnitten
- –
-
Empfehlung zu erforderlichen Sicherheitsmaßen bei der Expression von Shigatoxinen
- –
-
Anfrage zum Widerspruch einer versagten Änderung der Druckstaffelung bzw. von Türen in einer gentechnischen Anlage der Sicherheitsstufe 4
- –
-
Bewertung zur Einhaltung von Sicherheitsmaßnahmen beim Umgang mit rekombinanten Trypanosoma cruzi
- –
-
Amtshilfe zur Überprüfung der raumlufttechnischen Anlage einer gentechnischen Anlage der Sicherheitsstufe 3 – Dichtsitz- und Leckageprüfung von HEPA-Filtern
3.4 Risikobewertung von Spender- und Empfängerorganismen
Im Jahr 2021 wurden insgesamt 104 Mikroorganismen, die bei gentechnischen Arbeiten als Spender- oder Empfängerorganismen verwendet werden, gemäß § 5 in Verbindung mit Anlage I GenTSV einer Risikogruppe zugeordnet oder deren Einstufung überprüft. Darunter waren 44 Viren, 51 Bakterien oder Archaea, 2 Parasiten oder eukaryote Einzeller und 7 Pilze oder Oomyceten. Im Vergleich zum Berichtsjahr 2020 (59 Einstufungen) ist somit eine deutliche Zunahme der Zahl der Einstufungen zu verzeichnen. Bei folgenden Mikroorganismen wurde eine Risikobewertung durchgeführt:
- Tabelle 4
-
Neu eingestufte Mikroorganismen
| Organismus | Risikogruppe |
|---|---|
| Bakterien und Archaea | |
| Acidovorax sp. Leaf84 | 1 |
| Aeromicrobium sp. Leaf245 | 1 |
| Agreia sp. Leaf335 | 1 |
| Allofrancisella frigidaquae | 2 |
| Arthrobacter sp. Leaf145 | 1 |
| Avibacterium avium | 1 |
| Avibacterium endocarditidis | 2 |
| Avibacterium gallinarum | 2 |
| Avibacterium paragallinarum | 2 |
| Avibacterium volantium | 1 |
| Bradyrhizobium sp. Leaf396 | 1 |
| Chryseobacterium nematophagum | 1 |
| Escherichia coli ED1a | 1 |
| Escherichia coli IAI1 | 1 |
| Eubacterium siraeum | 1 |
| Gallibacterium anatis | 2 |
| Gallibacterium melopsittaci | 2 |
| Gallibacterium salpingitidis | 2 |
| Gallibacterium trehalosifermentans | 2 |
| Gemmata obscuriglobus | 1 |
| Glaesserella australis | 2 |
| Glaesserella parasuis | 2 |
| Lawsonia intracellularis | 2 |
| Methanobrevibacter oralis | 2 |
| Microbacterium sp. Leaf320 | 1 |
| Microbacterium sp. Leaf347 | 1 |
| Microbulbifer sp. HZ11 | 1 |
| Mycoplasma hyosynoviae | 2 |
| Pantoea vagans | 1 |
| Pedobacter sp. Leaf194 | 1 |
| Peptoniphilus duerdenii | 2 |
| Planctomycetes bacterium B28_G16 | 1 |
| Planctopirus limnophila | 1 |
| Plantibacter sp. Leaf1 | 1 |
| Pseudomonas citronellolis | 1 |
| Pseudomonas koreensis | 1 |
| Pseudomonas sp. AIB1 | 2 |
| Pseudomonas sp. FF1 | 1 |
| Pseudomonas sp. FF2 | 1 |
| Pseudomonas sp. FF3 | 1 |
| Pseudomonas sp. FF4 | 1 |
| Rathayibacter sp. Leaf296 | 1 |
| Rhodococcus sp. Leaf225 | 1 |
| Sphingomonas melonis | 1 |
| Sphingomonas phyllosphaerae | 1 |
| Sphingomonas sp. Leaf17 | 1 |
| Sphingomonas sp. Leaf34 | 1 |
| Sphingomonas sp. Leaf357 | 1 |
| Spirochaeta thermophila | 1 |
| Williamsia sp. Leaf354 | 1 |
| Xylophilus sp. Leaf220 | 1 |
| Parasiten und eukaryote Einzeller außer Pilze/Oomyceten | |
| Sphaeroforma arctica | 1 |
| Trypanosoma cruzi | 3** |
| Pilze und Oomyceten | |
| Aspergillus aculeatus | 1 |
| Aspergillus brasiliensis | 2 |
| Catenaria anguillulae | 1 |
| Chaetomium thermophilum | 1 |
| Entomophthora muscae | 1 |
| Stachybotrys chartarum | 1 |
| Ustilaginoidea virens | 2 |
| Viren | |
| Avian metaavulavirus 10 | 2 |
| Avian metaavulavirus 11 | 2 |
| Avian metaavulavirus 14 | 2 |
| Avian metaavulavirus 15 | 2 |
| Avian metaavulavirus 20 | 2 |
| Avian orthoavulavirus 12 | 2 |
| Avian orthoavulavirus 13 | 2 |
| Avian orthoavulavirus 16 | 2 |
| Avian orthoavulavirus 17 | 2 |
| Avian orthoavulavirus 18 | 2 |
| Avian orthoavulavirus 19 | 2 |
| Avian orthoavulavirus 21 | 2 |
| Bovines Coronavirus | 2 |
| Deltavirus cameroonense | 2 |
| Deltavirus carense | 2 |
| Deltavirus italiense | 2 |
| Deltavirus japanense | 2 |
| Deltavirus peruense | 2 |
| Deltavirus senegalense | 2 |
| Deltavirus taiwanense | 2 |
| Deltavirus togense | 2 |
| Hepacivirus K | 2 |
| Hepacivirus L | 2 |
| Hepacivirus M | 2 |
| Hepatitis B virus, uncharakterisierte Patientenisolate | 3** |
| Herpesviren aus Fledermäusen | 2 |
| Human alphaherpesvirus 1 Stamm JS1/34.5-/47-/mGM-CSF | 1 |
| Human alphaherpesvirus 3, Impfstamm vOka | 1 |
| Human mastadenovirus C Impfstamm rAd5-S-CoV2 | 1 |
| Human mastadenovirus D Stämme Ad26.Mos2S.Env, Ad26.Mos1.Env, Ad26.Mos1.Gag-Pol und Ad26.Mos2.Gag-Pol | 1 |
| Human mastadenovirus D Stamm Ad26.RSV.preF | 1 |
| Human mastadenovirus D Stamm rAD26-S-CoV2 | 1 |
| Loch Morlich virus | 1 |
| Mammalian orthoreovirus | 2 |
| Mayfield virus 1 | 1 |
| Mayfield virus 2 | 1 |
| Pigeon circovirus | 2 |
| Porcine circovirus 3 | 2 |
| Pteropus lylei-associated alphaherpesvirus | 2 |
| River Luinaeg virus | 1 |
| Skink hepatitis B virus | 2 |
| Spiny lizard hepatitis B virus 1 | 2 |
| Vespertilionid gammaherpesvirus 1 | 2 |
| Viren der Familie Polyomaviridae | 2 |
Die Zuordnungen zu Risikogruppen sind in der Organismendatenbank der ZKBS zu finden9. Allgemeine Stellungnahmen zur Risikobewertung von Organismen werden auf der Internetseite der ZKBS veröffentlicht10.
3.5 Sicherheitseinstufung gentechnischer Arbeiten und Bewertung sicherheitstechnischer Maßnahmen von gentechnischen Anlagen
Im Jahr 2021 (Stand Dezember) hat die ZKBS 52 Stellungnahmen zur Sicherheitseinstufung gentechnischer Arbeiten und/oder zu erforderlichen Sicherheitsmaßnahmen abgegeben. Die bewerteten gentechnischen Arbeiten und Anlagen betrafen die in Tabelle 5 zusammengestellten Themen. Bei den meisten gentechnischen Arbeiten, die bewertet wurden, erfolgte für die Sicherheitsmaßnahmen lediglich ein Hinweis auf die GenTSV. Bei einigen hingegen erfolgte eine detaillierte Bewertung der in der gentechnischen Anlage vorliegenden bzw. vorgesehenen technischen und organisatorischen Sicherheitsmaßnahmen.
- Tabelle 5
-
Sicherheitsbewertete gentechnische Arbeiten und Anlagen im Jahr 2021. Die Titel der gentechnischen Arbeiten wurden aus den eingereichten Antragsunterlagen übernommen.
| Sicherheitsstufe 1 | |
| – | Mechanismen der Pathogenität von Legionella pneumophila, Aktualisierung der Stellungnahme mit Az. 6790-01-0557 |
| – | Vermehrung von gentechnisch veränderten Stämmen des afrikanischen Schweinepest-Virus (ASFV) auf permanenten Zelllinien, Az. 45110.2127 |
| – | Herstellung und Untersuchungen in vitro von Plasmodium berghei-Zytoskelettprotein-Mutanten/Varianten, Az. 45110.2137 |
| – | Transformation einzelner chlamydialer Gene in S. cerevisae und S. pombe, humanen Zellkulturzellen und E. coli, Az. 45110.2147 |
| – | Struktur, Funktion und Inhibition von Tryparedoxinen aus verschiedenen Trypanosomatiden, Az. 45110.2157 |
| – | Expression von humanem Interleukin-4 und GM-CSF in Pichia pastoris (Komagataella pastoris) GS115, Az. 45110.2178 |
| Sicherheitsstufe 2 | |
| – | Herstellung von Hepatitis D Virus (HDV) Partikeln und Infektion von Zielzellen mit HDV Partikeln – Teil 2, Az. 45110.2125 |
| – | Impfversuche mittels VZV als Vektor, Az. 45110.2128 |
| – | Herstellung rekombinanter aviärer Paramyxoviren und deren Nutzung als Vektor zur Expression fremder Gene, Az. 45110.2129 |
| – | Überexpression von Staphylococcus aureus Proteinen in E. coli K12 für Immunproteomanalysen, Az. 45110.2130 |
| – | Replikation von Ross-River-Virus (RRV) und Varianten des RRV in vitro, Az. 45110.2132 |
| – | In vitro und in vivo Charakterisierung von rekombinanten, mit heterologen viralen Hüllproteinen pseudotypisierten Vesikulären Stomatitis Viren, Az. 45110.2134 |
| – | Herstellung monoklonaler Antikörper gegen S. aureus Proteine 2) Erweiterung: Mechanismen der Stressantwort und Pathogenität bei Staphylokokken 3) Erweiterung: Identifizierung immunogener Proteine in Sepsiserregern, Az. 45110.2135 |
| – | Characterization of the innate immune response generated by intestinal polarized cells upon viral infection – Erweiterung I, Az. 45110.2138 |
| – | Herstellung von und Infektion mit Pseudotypen der Risikogruppe 2 (Erweiterungen 4.1 und 4.2), Az. 45110.2150/1 |
| – | Identifizierung und Charakterisierung von Resistenzgenen grampositiver und gramnegativer bakterieller Infektionserreger (Erweiterung), Az. 45110.2158 |
| – | Humane Adenoviren und Maus-Cytomegalovirus als Vektoren zur Impfung gegen Coronaviren, Az. 45110.2160 |
| – | Ektopische Expression von Neurotoxinen zur zielgerichteten Elimination von Nervenzellen zur Untersuchung der Konnektivität von Morbus Parkinson relevanten Neuronenpopulationen, Az. 45110.2161 |
| – | Untersuchung von Helferviren „Hüllproteinen“ für die Wirtsspezifität des Hepatitis D Virus (HDV) und HDV ähnlichen Verwandten in Tieren, Az. 45110.2163 |
| – | Etablierung eines genetischen Systems für Methanobrevibacter oralis, Az. 45110.2165 |
| – | Onkolytische Virotherapie gastrointestinaler Tumore, Az. 45110.2166 |
| – | Generierung fluoreszenter gastrointestinaler Clostridienstämme, zur Untersuchung mikrobieller Interaktionen und Medikamentenwirksamkeit, Az. 45110.2167 |
| – | Prozessentwicklungs-, Analytische- und GMP-Produktions-Arbeiten mit einem replikations-kompetenten, onkolytischen, rekombinanten HSV-1 (SA11_41), Az. 45110.2169 |
| – | Steigerung der anti-tumoralen Effizienz von Masernvirus-Impfstämmen durch Kodierung therapeutischer RNAs und/oder Cas13-Nukleasen, Az. 45110.2170 |
| – | Characterization of the innate immune response generated by intestinal polarized cells upon viral infection. Importance and differences of the type I vs. the type III interferons, Az. 45110.2171 |
| – | Untersuchung und Bedeutung des L-HDAg in HDV und Delta-ähnlichen Viren für die Umhüllung mit Helferproteinen, Az. 45110.2172 |
| – | Hepatitis E Virus Replikation und Pathogenese, Az. 45110.2173 |
| – | Heterologe Expression von α-Hämolysin aus Staphylococcus aureus in E. coli und Studien mit dem rekombinanten Hla zur Aktivierung von Thrombozyten und anderen Immunzellen sowie Studien zur Apoptose 2. Heterologe Expression von Pneumolysin bzw. seiner inaktivierten Toxoidform in E. coli K12 Derivaten zur Immunisierung und Verwendung mit humanen Thrombozyten, anderen Immunzellen (neutrophilen Granulozyten, dendritischen Zellen) und Epithel- bzw. Endothelzellen, Az. 45110.2174 |
| Sicherheitsstufe 3 | |
| – | Role of an additional NF-kB site in HIV-1 transmission, Az. 45110.1899_3. Erweiterung |
| – | Lentivirale Reportervektoren für Resistenz- und Neutralisationstests (1. Ergänzung), Az. 45110.2052 |
| – | Molekulargenetische und funktionelle Untersuchungen zu virulenzassoziierten Genen enterohämorrhagischer Escherichia coli (EHEC) und weiterer pathogener Escherichia coli (1. Erweiterung), Az. 45110.2057 |
| – | Untersuchung der Wirkung von zellulären Genen, Medikamenten und bioaktiven Molekülen auf Coronaviren – Teile 2 bis 3, Az. 45110.2083 |
| – | Untersuchung rekombinanter Immundefizienzviren zur Pathogenese und Wirt-Virus-Interaktionen in humanen und anderen Säugetierzellen – Erweiterungsantrag 3, Az. 45110.2143 |
| – | Untersuchungen zum Phospholipidstoffwechsel von M. tuberculosis, Az. 45110.2144 |
| – | HIV und HIV-basierte Pseudotypen für die Reservoirforschung, Az. 45110.2145 |
| – | Transduktion HIV infizierter Zellen, Az. 45110.2146 |
| – | Herstellung und genetische Modifikation rekombinanter defekter interferierender SARS-CoV-2 Partikel, Infektionsversuche mit SCV2-DIP, Az. 45110.2148 |
| – | Untersuchungen zur Regulation von ribosomalem Frameshift in Viren, Az. 45110.2149 |
| – | Genehmigung zur Errichtung und Betrieb einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 45110.2152 |
| – | Antrag auf Genehmigung einer gentechnischen Anlage der Sicherheitsstufe S3, Az. 45110.2153 |
| – | Verwendung von rekombinanten replikationskompetenten SARS-CoV-2 Reportergen-exprimierenden Stämmen zur qualitativen und quantitativen Nachverfolgung der viralen Infektion, Az. 45110.2154 |
| – | Herstellung rekombinanter Coronaviren mithilfe des Hefe Systems und Untersuchung von Viren in Zellkultur, Az. 45110.2155 |
| – | Entdeckung und Untersuchung von antiviralen Proteinen und Wirkstoffen gegen rekombinante, nicht-replikationsfähige SARS-2 Coronaviruspartikel – Bacmid-System, Az. 45110.2156 |
| – | Rekombinante Expression, Reinigung und biophysikalische Charakterisierung von Prionproteinen (nicht-infektiöse, zelluläre Form) aus Säugetieren, Az. 45110.2159 |
| – | Untersuchung der Replikation und Pathogenität von hochpathogenen aviären Influenzaviren und ihrer Genprodukte sowie der Beitrag wirtsspezifischer Faktoren in Zellkultur, Az. 45110.2162 |
| – | Molekularbiologie von Hepatitis B- und D-Viren: Aufklärung molekularer Mechanismen hepadnaviraler Infektionen, Az. 45110.2164 |
| – | Einfluss der offenen Leserahmen auf die Replikation des SARS Coronavirus 2, Az. 45110.2168 |
| – | Polyaminstoffwechsel in Mycobacterium tuberculosis, Az. 45110.2175 |
| – | Biologie und Pathogenese der Humanen Immundefizienzviren Typ 1 und Typ 2 (HIV-1, HIV-2), Az. 45110.2176 |
| – | Rekonstruktion von SARS-CoV-2-Genomen aus Plasmiden, deren Modifikation und Erstellung rekombinanter, infektiöser SARS-CoV-2, Az. 45110.2179 |
| – | Untersuchung der Wirkung von zellulären Genen, Medikamenten und bioaktiven Molekülen und auf die zelluläre Antwort von SARS-CoV, wildtyp SARS-CoV-2, rekombinantes SARS-CoV-2 (rSARS-CoV-2), sowie rekombinantem SARS-Coronaviren-Infektion und der viralen Replikation in Zellkultur und in Mäusen – Wesentliche Änderung einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 45110.2180 |
| Sicherheitsstufe 4 | |
| – | keine |
Zusammenfassend ist in Abbildung 2 die Anzahl der im Jahr 2021 abgegebenen Stellungnahmen der ZKBS im Vergleich zu der Anzahl der in den vergangenen sechs Jahren abgegebenen Stellungnahmen grafisch dargestellt. Insgesamt gab es in 2020 einen deutlichen Anstieg von verabschiedeten Stellungnahmen zu gentechnischen Arbeiten der Sicherheitsstufe 3. Dies war auf die pandemiebedingte und seitens des Bundes geforderte Ausrichtung von Forschungsansätzen auf Coronaviren zurückzuführen. Auch wenn die Gesamtzahl an Anträgen an die ZKBS in 2021 wieder abnahm, waren es mit 59 Antragseingängen deutlich mehr als in den Jahren vor der Pandemie mit durchschnittlich 42 Anträgen. Der Fokus der eingereichten Anträge auf Durchführung gentechnischer Arbeiten der Sicherheitsstufe 3 lag auch im Jahr 2021 auf Forschungsarbeiten zu Coronaviren (35 %).
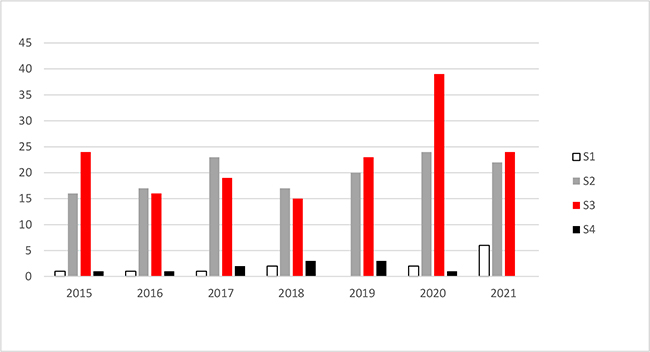
Abbildung 2: Die Abbildung beschreibt die jeweilige Anzahl der von der ZKBS in den vergangenen sieben Jahren erstellten Stellungnahmen zu gentechnischen Arbeiten in gentechnischen Anlagen, differenziert nach den Sicherheitsstufen 1 bis 4 (S1 – S4).
3.6 Allgemeine Stellungnahmen und Berichte
Die ZKBS hat im Jahr 2021 folgende allgemeine Stellungnahmen erstellt oder überabeitet. Ein besonderer Bedarf für die Erstellung von allgemeinen Stellungnahmen ergab sich aus dem in der Novelle der GenTSV formulierten gesetzlichen Prüfungsauftrag an die ZKBS, bis 31. Dezember 2021 noch als anerkannt geltende Biologische Sicherheitsmaßnahmen zu überprüfen und ggf. neu anzuerkennen.
- –
-
Allgemeine Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Gentechnische Arbeiten mit von RNA-Viren abgeleiteten Replikons, Minigenomen und virusähnlichen Partikeln zum Einbringen in humane oder tierische Zellen, Az. 45310.0118
- –
-
Allgemeine Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Generierung von induzierten pluripotenten Stammzellen (iPSC) mittels von Sendaivirus abgeleiteter replikationsdefekter viraler Vektoren, Az. 45310.0119
- –
-
Stellungnahme der ZKBS zu Kriterien zur Risikobewertung von Viren mit einem ausschließlichen Wirtsbereich für Insekten als Spender- oder Empfängerorganismus gemäß § 5 Absatz 1 GenTSV, Az. 45310.0120
- –
-
Stellungnahme der ZKBS zur Eignung von Escherichia coli K12-abgeleiteten Stämmen als Teil biologischer Sicherheitsmaßnahmen gemäß § 8 Absatz 1 GenTSV, Az. 45270_a
- –
-
Stellungnahme der ZKBS zur Eignung von Vektoren als Teil biologischer Sicherheitsmaßnahmen gemäß § 8 Absatz 2 GenTSV, Az. 45270_b
- –
-
Stellungnahme der ZKBS zur Eignung von Pseudomonas putida KT2440 als Teil biologischer Sicherheitsmaßnahmen gemäß § 8 Absatz 1 GenTSV, Az. 45270_c
- –
-
Stellungnahme der ZKBS zur Eignung von haploiden Laborstämmen von Saccharomyces cerevisiae als Teil biologischer Sicherheitsmaßnahmen gemäß § 8 Absatz 1 GenTSV, Az. 45270_e
- –
-
Aktualisierung der Stellungnahme der ZKBS zu Hände- und Flächendesinfektionsmaßnahmen bei gentechnischen Arbeiten mit Viren bis Sicherheitsstufe 4, Az. 6790-10-49
- –
-
Aktualisierung der Allgemeinen Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Gentransfer mit Hilfe von Adenovirus Typ 5, Az. 6790-10-28
- –
-
Aktualisierung der Allgemeinen Stellungnahme der ZKBS zur Risikobewertung Adeno-assoziierter Viren aus Primaten und davon abgeleiteter Vektoren, Az. 6790-10-73
Alle allgemeinen Stellungnahmen finden sich auf der Internetseite der ZKBS11.
3.7 Stellungnahmen zu Freisetzungen
Stellungnahmen zu Freisetzungsanträgen von GVO wurden im Berichtszeitraum von der ZKBS nicht abgegeben.
3.8 Stellungnahmen zu Inverkehrbringen
Stellungnahmen zu Anträgen auf Inverkehrbringen von GVO wurden im Berichtszeitraum von der ZKBS nicht abgegeben.
3.9 Berichte über Themen von allgemeiner Bedeutung
Mithilfe der eigenen Internetseite (https://www.zkbs-online.de) möchte die ZKBS auch die Möglichkeit nutzen, der Öffentlichkeit in geeigneter Weise über Themen von allgemeiner Bedeutung zu berichten. Im Jahr 2021 erschien die Internetseite in einem neuen Design und mit einer neuen Struktur. Unter der Rubrik Fokusthemen wurde der Beitrag zu Gene-Drive-Systemen dahingehend aktualisiert, als dass mit der Novellierung der GenTSV ein Genehmigungsverfahren für die Durchführung solcher Forschungsvorhaben notwendig ist.
- 1
- https://ec.europa.eu/food/plant/gmo/reports_studies_en
- 2
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_B_Plants.php
- 3
- https://www.bvl.bund.de/DE/Arbeitsbereiche/06_Gentechnik/02_Verbraucher/03_Genehmigungen/01_Inverkehrbringen/gentechnik_GenehmigungenInverkehrbringen_node.html
- 4
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_C.php
bzw. https://webgate.ec.europa.eu/dyna/gm_register/index_en.cfm - 5
- https://ec.europa.eu/info/law/better-regulation/have-your-say/initiatives/13119-Legislation-for-plants-produced-by-certain-new-genomic-techniques_en
- 6
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_B_Others.php
- 7
- https://www.pei.de/DE/arzneimittel/atmp/gentherapeutika/gentherapeutika-node.html
- 8
- https://www.zkbs-online.de/ZKBS/DE/SynthetischeBiologie/SynthetischeBiologie_node.html
- 9
- https://zag.bvl.bund.de/organismen/index.jsf
- 10
- https://www.zkbs-online.de/ZKBS/DE/Stellungnahmen/stellungnahmen_node.html
- 11
- https://www.zkbs-online.de/ZKBS/DE/Stellungnahmen/stellungnahmen_node.html











Kommentar hinterlassen