Bundesamt
für Verbraucherschutz und Lebensmittelsicherheit
Bekanntmachung
der Arbeit der Zentralen Kommission
für die Biologische Sicherheit im Jahr 2022
BVL 125/2023/04
33. Bericht nach Inkrafttreten des Gentechnikgesetzes
Nachfolgend wird der vorgenannte Bericht über die Arbeit der Zentralen Kommission für die Biologische Sicherheit im Jahr 2022 bekannt gegeben.
(BVL-Az.: 45040)
Bundesamt
für Verbraucherschutz und Lebensmittelsicherheit
Im Auftrag
Dr. Anke Stein
Gliederung
1 Einleitung
1.1 Grundlagen der ZKBS
1.2 Entwicklung der Gentechnik in der Bundesrepublik Deutschland und in anderen Mitgliedstaaten der Europäischen Union
2 Zusammensetzung der ZKBS
3 Beratungstätigkeit der ZKBS im Jahre 2022
3.1 Arbeitsweise
3.2 Arbeitskreise
3.3 Beratung der Bundesregierung, der zuständigen Landesbehörden und des BVL
3.4 Risikobewertung von Spender- und Empfängerorganismen
3.5 Sicherheitseinstufung gentechnischer Arbeiten und Bewertung sicherheitstechnischer Maßnahmen von gentechnischen Anlagen
3.6 Allgemeine Stellungnahmen und Berichte
3.7 Rücknahme von Stellungnahmen
3.8 Stellungnahmen zu Freisetzungen
3.9 Stellungnahmen zu Inverkehrbringen
3.10 Berichte über Themen von allgemeiner Bedeutung
Abkürzungen
| ATMP | Advanced Therapy Medicinal Products (Arzneimittel für neuartige Therapien) |
| BfN | Bundesamt für Naturschutz |
| BfR | Bundesinstitut für Risikobewertung |
| BMEL | Bundesministerium für Ernährung und Landwirtschaft |
| BVL | Bundesamt für Verbraucherschutz und Lebensmittelsicherheit |
| EFSA | European Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) |
| EG | Europäische Gemeinschaft |
| EMA | European Medicines Agency (Europäische Arzneimittel-Agentur) |
| EU | Europäische Union |
| EuGH | Europäischer Gerichtshof |
| FLI | Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit |
| GenTG | Gentechnikgesetz |
| GenTSV | Gentechnik-Sicherheitsverordnung |
| GVO | gentechnisch veränderter Organismus |
| JKI | Julius Kühn-Institut, Bundesforschungsinstitut für Kulturpflanzen |
| PEI | Paul-Ehrlich-Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel |
| RKI | Robert Koch-Institut, Bundesinstitut für die öffentliche Gesundheit |
| TRBA | Technische Regel für Biologische Arbeitsstoffe |
| ZKBS | Zentrale Kommission für die Biologische Sicherheit |
Fachliche Abkürzungen werden im Text erklärt.
1 Einleitung
1.1 Grundlagen der ZKBS
Die Zentrale Kommission für die Biologische Sicherheit (ZKBS) ist eine Sachverständigenkommission, die sich aus 20 Mitgliedern und 20 stellvertretenden Mitgliedern zusammensetzt. Die Mitglieder sind Expertinnen bzw. Experten verschiedener Fachrichtungen und werden von Expertinnen bzw. Experten der gleichen Fachrichtung vertreten. Die vertretenen Fachgebiete sind im Gentechnikgesetz (GenTG) vorgegeben. Die ZKBS prüft und bewertet sicherheitsrelevante Fragen zur Gentechnik nach den Vorschriften des GenTG und berät die Bundesregierung und die Bundesländer. Sie gibt gegenüber den zuständigen Behörden Stellungnahmen ab, insbesondere zur Risikobewertung von Mikroorganismen, zur Sicherheitseinstufung gentechnischer Arbeiten, zu erforderlichen Sicherheitsmaßnahmen in gentechnischen Anlagen und zu möglichen Risiken einer Freisetzung oder des Inverkehrbringens von gentechnisch veränderten Organismen (GVO). Sie berücksichtigt bei ihren Empfehlungen die internationale Entwicklung auf dem Gebiet der gentechnischen Sicherheit. Die Mitglieder der ZKBS und ihre Stellvertretenden versehen ihre Tätigkeit entsprechend dem GenTG ehrenamtlich.
Die ZKBS hat ihre Geschäftsstelle am Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL), das zum Geschäftsbereich des Bundesministeriums für Ernährung und Landwirtschaft (BMEL) gehört. Die Mitglieder der ZKBS und ihre Stellvertreterinnen und Stellvertreter werden vom BMEL im Einvernehmen mit den Bundesministerien für Bildung und Forschung, für Umwelt, Naturschutz und nukleare Sicherheit, für Gesundheit, für Arbeit und Soziales sowie für Wirtschaft und Klimaschutz für die Dauer von drei Jahren berufen. Eine Wiederberufung ist zulässig.
Die ZKBS hat eine Vorsitzende bzw. einen Vorsitzenden, der/dem zwei Stellvertretende Vorsitzende zur Seite stehen. Die Kommission fasst ihre Beschlüsse entweder auf einer der regelmäßigen Sitzungen oder in einem schriftlichen Verfahren. Die Mitglieder der ZKBS und ihre Stellvertreterinnen und Stellvertreter sind zur Verschwiegenheit verpflichtet. Die Sitzungen sind nicht öffentlich, jedoch veröffentlicht die ZKBS allgemeine Stellungnahmen und berichtet jährlich der Öffentlichkeit über ihre Arbeit.
1.2 Entwicklung der Gentechnik in der Bundesrepublik Deutschland und in anderen Mitgliedstaaten der Europäischen Union
Gentechnische Arbeiten und gentechnische Anlagen
Unter dem Begriff „gentechnische Arbeiten“ werden insbesondere die Erzeugung von GVO und der Umgang mit GVO zusammengefasst. Gentechnische Arbeiten müssen abhängig von ihrer Sicherheitsstufe bei der zuständigen Landesbehörde angezeigt, angemeldet oder genehmigt und in einer gentechnischen Anlage durchgeführt werden, die ebenfalls abhängig von der Sicherheitsstufe angezeigt, angemeldet oder genehmigt werden muss. Gentechnische Anlagen können Laboratorien, Produktionsanlagen, Gewächshäuser und/oder Tierräume sein.
Grundsätzlich holt die zuständige Behörde vor der Entscheidung über eine Genehmigung eine Stellungnahme der ZKBS zur sicherheitstechnischen Einstufung der vorgesehenen gentechnischen Arbeiten und zu den erforderlichen sicherheitstechnischen Maßnahmen ein. Dabei handelt es sich in der Regel um gentechnische Arbeiten der Sicherheitsstufen 3 oder 4 und um gentechnische Anlagen mit Sicherheitsmaßnahmen der Stufen 3 oder 4. Aufgrund der gesetzlichen Vorgaben bittet die zuständige Behörde die ZKBS auch um Stellungnahmen zu solchen gentechnischen Arbeiten der Sicherheitsstufe 2, die nicht mit anderen Arbeiten vergleichbar sind oder zu denen die ZKBS in der Vergangenheit bereits eine Stellungnahme abgegeben hat. Zudem bittet sie um Beratung zu solchen gentechnischen Arbeiten, deren Zuordnung zur Sicherheitsstufe 1 unsicher ist.
Seit Inkrafttreten des GenTG im Jahre 1990 wurden der ZKBS 2 227 Erstanträge auf Sicherheitseinstufung gentechnischer Arbeiten und/oder auf Bewertung der erforderlichen sicherheitstechnischen Maßnahmen vorgelegt. Im Berichtsjahr wurden 50 Erst- oder Erweiterungsanträge eingereicht, die ZKBS gab 49 Stellungnahmen ab.
In Deutschland sind insgesamt 6 720 gentechnische Anlagen angezeigt, angemeldet oder genehmigt (Stand: Dezember 2022). Tabelle 1 listet die gentechnischen Anlagen nach der Stufe der Sicherheitsmaßnahmen auf. Tabelle 2 fasst die je nach Sicherheitsstufe in Deutschland angezeigten, angemeldeten oder genehmigten gentechnischen Arbeiten zusammen.
Tabelle 1: Angezeigte, angemeldete oder genehmigte gentechnische Anlagen in Deutschland (Stand: Dezember 2022)
| Stufe | Anzahl |
|---|---|
| S1 | 4 806 |
| S2 | 1 868 |
| S3 | 97 |
| S4 | 5 |
Im Vergleich zu den vergangenen fünf Jahren ist die Gesamtzahl von 6 000 bis 7 000 gentechnischen Anlagen der Stufen 1 bis 4 weitgehend stabil geblieben. Den größten Anteil nehmen die Anlagen der Sicherheitsstufen 1 und 2 ein (siehe Abbildung 1). Während sich die Anzahl der gentechnischen Arbeiten im Bereich der Sicherheitsstufen 3 und 4 innerhalb der vergangenen fünf Jahre nur geringfügig änderte, ist bei den gemeldeten gentechnischen Arbeiten der Sicherheitsstufe 2 ein leichter Anstieg zu verzeichnen. Konkrete Angaben über die tatsächliche Anzahl gentechnischer Arbeiten der Sicherheitsstufe 1 können nicht gemacht werden, da es keine Vorgaben für eine behördliche Erfassung gibt.
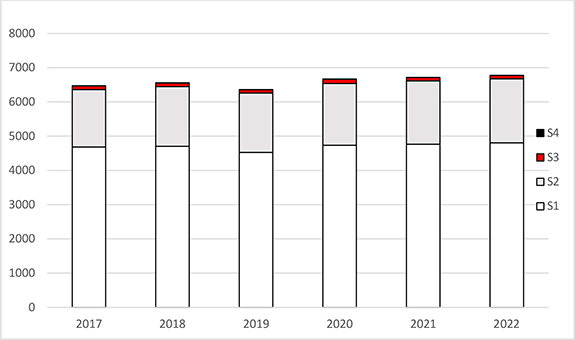
Abbildung 1: Dargestellt sind die Zahlen der angezeigten, angemeldeten oder genehmigten gentechnischen Anlagen Deutschlands, differenziert nach Sicherheitsstufe (S1 – S4) in den Jahren 2017 bis 2022.
Tabelle 2: Derzeit angezeigte, angemeldete oder genehmigte gentechnische Arbeiten in Deutschland (Stand: Dezember 2022)*
| Stufe | Anzahl |
|---|---|
| S2 | 9 627 |
| S3 | 431 |
| S4 | 17 |
- *
- Eine genaue Angabe ist für die durchgeführten gentechnischen Arbeiten der Sicherheitsstufe 1 nicht möglich, da die Betreiber gemäß § 9 GenTG zwar zur Aufzeichnung weiterer Arbeiten der Sicherheitsstufe 1 verpflichtet sind, jedoch keine Anzeige- oder Meldepflicht gegenüber der zuständigen Landesbehörde besteht. Somit werden weitere S1-Arbeiten in den behördlichen Datenbanken nicht erfasst.
Weitere Informationen zu gentechnischen Arbeiten und gentechnischen Anlagen werden über die Internet-Seite der ZKBS zur Verfügung gestellt: https://www.zkbs-online.de.
Ein Vergleich der Anzahl der gentechnischen Arbeiten oder gentechnischen Anlagen zwischen Deutschland und anderen Mitgliedstaaten der Europäischen Union (EU) ist nicht möglich, da hierzu keine Informationen vorliegen. Allgemeine Informationen zur Umsetzung der zugrunde liegenden Richtlinie 2009/41/EG werden der Europäischen Kommission in regelmäßigen Abständen von den Mitgliedsstaaten in Form ausgefüllter Fragebögen zur Verfügung gestellt. Die Rückmeldungen aus den Mitgliedsstaaten werden durch die Europäische Kommission zusammengefasst und auf ihrer Homepage veröffentlicht1. Im Jahr 2022 wurden u. a. Fragen zur behördlichen Verfahrensdurchführung einschließlich Öffentlichkeitsbeteiligung und Durchsetzungsaktivitäten in den Jahren 2018 bis 2021 adressiert, aber auch zu aufgetretenen Unfällen mit möglichen Auswirkungen auf die Umwelt und bestehenden Erfahrungen mit der Bewertung von Gene Drive-Systemen. Es wurde auch um Rückmeldung gebeten, falls es zu Schwierigkeiten bei der Gesetzesauslegung gekommen sein sollte. Der zusammenfassende Bericht wurde unter folgendem Link veröffentlicht: https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:52023DC0075.
Freisetzungen von GVO
Werden bei einem Experiment GVO zeitlich und räumlich begrenzt in die Umwelt ausgebracht, handelt es sich um eine „Freisetzung“. Für jede beabsichtigte Freisetzung muss gemäß GenTG beim BVL eine Genehmigung eingeholt werden, die dann erteilt werden kann, wenn von der geplanten Freisetzung keine schädlichen Auswirkungen für Menschen, die Umwelt in ihrem Wirkungsgefüge, Tiere, Pflanzen sowie Sachgüter ausgehen. Liegt für die GVO, die freigesetzt werden sollen, bereits eine Genehmigung für das Inverkehrbringen vor, ist keine gesonderte Genehmigung erforderlich.
In Deutschland ist das BVL seit dem 1. April 2004 als Bundesoberbehörde für die Genehmigung von Freisetzungen von GVO zuständig. Das BVL trifft die Entscheidungen im Benehmen mit dem Bundesamt für Naturschutz (BfN), dem Bundesinstitut für Risikobewertung und dem Robert Koch-Institut (RKI). Die ZKBS, das Julius Kühn-Institut (JKI) und die zuständige Behörde des betroffenen Bundeslandes geben jeweils Stellungnahmen zum Freisetzungsvorhaben ab. Im Falle der Freisetzung von gentechnisch veränderten Wirbeltieren oder von gentechnisch veränderten Mikroorganismen, die an Wirbeltieren angewendet werden, wird auch das Friedrich-Loeffler-Institut (FLI) beteiligt. Die anderen EU-Mitgliedstaaten werden über Freisetzungsanträge informiert und können Stellung dazu nehmen.
Wie in den Jahren 2013 bis 2021 wurden in Deutschland auch im Jahr 2022 weder Freisetzungen von GVO beantragt noch Genehmigungen für solche Freisetzungen erteilt. Ein Vergleich der eingereichten Freisetzungsanträge aus den verschiedenen Mitgliedstaaten der EU zeigt, dass 2022 nur vereinzelt Anträge in Spanien (1 – Tabak), Belgien (1 – Mais) und Tschechien (1 – Weizen) gestellt worden sind. Einzelheiten zu den Anträgen können dem von der Europäischen Kommission geführten Register entnommen werden2. Innerhalb Europas werden zudem in der Schweiz in einer protected site Freisetzungsversuche mit Weizen durchgeführt3, in Großbritannien Freisetzungen von Weizen, Gerste, Kartoffel und Lein.4
Inverkehrbringen von GVO
Unter „Inverkehrbringen“ versteht man die Abgabe von GVO und Produkten, die GVO enthalten oder aus solchen hergestellt wurden, an Dritte, meist zu Zwecken der Vermarktung.
Für das Inverkehrbringen von GVO bedarf es eines EU-weiten Genehmigungsverfahrens. In diesem Verfahren wird unterschieden, ob der GVO als Lebens- oder Futtermittel genutzt werden soll [Verordnung (EG) Nr. 1829/2003] oder nicht [Richtlinie 2001/18/EG]. Produkte aus GVO, die nicht in den Geltungsbereich der genannten Verordnung oder Richtlinie fallen, wie z. B. Kleidung aus Baumwolle, bedürfen keiner Genehmigung zum Inverkehrbringen. Nach Durchlaufen des EU-weiten Verfahrens gilt die Genehmigung für alle Mitgliedstaaten der EU.
Das BVL ist die zuständige deutsche Behörde und gibt eine nationale Stellungnahme zu Anträgen auf Inverkehrbringen von GVO im Benehmen mit dem BfN, dem BfR und dem RKI ab. Zuvor wird eine Stellungnahme des JKI und, falls es sich bei den GVO um Wirbeltiere oder Mikroorganismen handelt, die an Wirbeltieren angewendet werden sollen, auch eine Stellungnahme des FLI und des Paul-Ehrlich-Instituts (PEI) eingeholt.
Zudem bittet das BVL die ZKBS um eine Stellungnahme zu solchen Anträgen nach Richtlinie 2001/18/EG, die in Deutschland eingereicht wurden. Bei Anträgen nach Verordnung (EG) Nr. 1829/2003 holt das BVL dann eine Stellungnahme der ZKBS ein, wenn Deutschland von der European Food Safety Authority (EFSA) mit einer Umweltrisikoprüfung eines Antrages auf Anbau beauftragt wurde. In 2022 gab es keine diesbezüglichen Anfragen an die ZKBS.
Derzeit sind events (Anzahl in Klammern) folgender Pflanzen zumeist für die Einfuhr als vermehrungsfähiger GVO und dessen Verarbeitung oder als Lebens- und Futtermittel zugelassen:
- –
-
Baumwolle (15, +1 im Vergleich zum Vorjahr)
- –
-
Mais (82, +2 im Vergleich zum Vorjahr)
- –
-
Raps (18, +2 im Vergleich zum Vorjahr)
- –
-
Soja (28, +3 im Vergleich zum Vorjahr)
- –
-
Zierpflanzen (6, +1 im Vergleich zum Vorjahr)
- –
-
Zuckerrübe (1, unverändert im Vergleich zum Vorjahr)
Weiterführende Details sind auf den Internetseiten des BVL5 sowie in den Einträgen des Registers der EU zu finden6. Im Unterschied zu örtlich und zeitlich begrenzten Freisetzungsversuchen ist der landwirtschaftliche Anbau gentechnisch veränderter Pflanzen nicht auf bestimmte Standorte oder Versuchsjahre beschränkt. Ein Anbau von gentechnisch veränderten Pflanzen durch Landwirte kann erst dann stattfinden, wenn das Inverkehrbringen des gentechnisch veränderten Saatguts zum Zweck der Ausbringung in die Umwelt genehmigt worden ist. Eine Genehmigung gilt in der Regel für zehn Jahre und muss danach verlängert werden. Verantwortlich für die wissenschaftliche Bewertung ist die EFSA.
Entscheidung des Europäischen Gerichtshofs (EuGH), dass mit neuen Mutageneseverfahren hergestellte Pflanzen GVO sind
Nach einer Klage französischer (Landwirtschafts-)Verbände beim französischen Staatsrat hat der hierzu angefragte EuGH in seinem Urteil vom 25. Juli 2018 festgestellt, dass sowohl mit konventionellen als auch mit neuen Mutageneseverfahren hergestellte Pflanzen gentechnisch veränderte Organismen sind. Sie fallen somit unter die Regularien der EU-Richtlinie 2001/18/EG. Allerdings sind mittels konventioneller Mutagenese erzeugte GVO vom Anwendungsbereich der Richtlinie ausgenommen.
Die im April 2021 veröffentlichte, von der Europäischen Kommission beauftragte Studie zum Stand neuer Mutageneseverfahren innerhalb der EU-Gesetzgebung kam zu dem Ergebnis, dass eine Anpassung der derzeitigen GVO-Gesetzgebung an den Stand von Wissenschaft und Technik unbedingt notwendig sei. Die in 2021
von der Kommission vorgestellte Initiative für eine angepasste Gesetzgebung von Pflanzen und daraus hergestellte Lebens- und Futtermittelprodukte, welche durch gezielte Mutagenese und Cisgenese hergestellt werden, wurde weiterverfolgt. Es wurde in der Kommission nach einer intensiven Diskussion unter Beteiligung von Stakeholdern und zuständiger Behörden an einem Gesetzesentwurf gearbeitet, der in 2023 Parlament und Rat vorgelegt werden soll. Um die in der Studie festgestellten Wissenslücken im Bereich genomeditierter Mikroorganismen und genomeditierter Tiere zu schließen, wurden zwei Mandate an die EFSA übertragen.
Klinische Prüfungen mit GVO-haltigen Prüfprodukten und Anwendung von GVO-haltigen Arzneimitteln am Menschen
Gemäß § 2 Absatz 3 GenTG ist die Anwendung GVO-haltiger Prüfprodukte am Menschen von gentechnikrechtlichen Regularien in Deutschland ausgenommen. Die Genehmigung klinischer Prüfungen mit Prüfpräparaten, die aus einem GVO oder einer Kombination von GVO bestehen oder solche enthalten, ist im Arzneimittelgesetz geregelt. Für die Erteilung der Genehmigung ist in Deutschland das PEI als obere Bundesbehörde zuständig. Das BVL wird als Benehmensbehörde bei der Bewertung des Risikos für die Umwelt und bei der Feststellung zur Abgrenzung bestimmter Tätigkeiten zum GenTG beteiligt und berichtet der ZKBS hierzu. In einigen Fällen bewertet die ZKBS das Gefährdungspotenzial der verwendeten GVO in einer Stellungnahme.
Im Jahr 2022 wurden 28 Genehmigungen durch das PEI erteilt, bei denen das BVL beteiligt war. Bei den Prüfprodukten handelte es sich um potenzielle Arzneimittel für neuartige Therapien (ATMP), wie der Behandlung von Krebserkrankungen mit umprogrammierten körpereigenen Zellen zur Immunstimulierung oder gentherapeutische Ansätze für schwerwiegende Erkrankungen aufgrund monogenetischer Erbdefekte, oder um neuartige Impfstoffe gegen Infektionskrankheiten. Eine Übersicht über genehmigte klinische Prüfungen in der EU bietet das Register der Europäischen Union7.
Die Zulassung der Anwendung humaner Arzneimittel, die aus einem GVO oder einer Kombination von GVO bestehen oder solche enthalten, erfolgt über ein zentralisiertes Verfahren durch die Europäische Kommission gemäß der Verordnung 726/2004/EG. Die Antragstellung erfolgt bei der Europäischen Arzneimittelbehörde (EMA), die im Rahmen ihrer Aufgabe Leitfäden für die Bewertung erstellt und die wissenschaftliche Koordinierung der Verfahren übernimmt. Bei der Umweltverträglichkeitsanalyse werden die gemäß der Richtlinie 2001/18/EG zuständigen Behörden der Mitgliedsstaaten beteiligt, welche in Deutschland das BVL ist. Wie auch bei den klinischen Prüfungen ist ein Anstieg an Anträgen auf Marktzulassungen für ATMPs zu verzeichnen. Bei den beantragten Produkten handelt es sich vermehrt um umprogrammierte, körpereigene T-Zellen für die Therapie von Krebserkrankungen und um Impfstoffe. Eine Übersicht über bereits zugelassene ATMPs ist auf der Homepage des PEI dargestellt8. Auch hierzu wird der ZKBS regelmäßig berichtet.
2 Zusammensetzung der ZKBS
In der ZKBS kommen Expertinnen und Experten verschiedener Fachgebiete zusammen. Auf diese Weise wird für die im GenTG vorgegebenen Aufgaben der ZKBS, nämlich die Bewertung von Mikroorganismen als Spender- und Empfängerorganismen für gentechnische Arbeiten, die Sicherheitseinstufung gentechnischer Arbeiten, die Bewertung sicherheitstechnischer Maßnahmen gentechnischer Anlagen sowie die Bewertung von Freisetzungen und Inverkehrbringen von GVO, ein breit gefächerter Sachverstand institutionalisiert und zur Verfügung gestellt. In Tabelle 3 ist die Besetzung der ZKBS dargestellt.
Im April 2022 wurde Prof. Dr. Dr. Thomas Vahlenkamp, seit 2012 Mitglied im Bereich Virologie, zum Vorsitzenden der ZKBS gewählt. Stellvertretende Vorsitzende sind Frau Prof. Dr. Sigrun Smola und Prof. Dr. Uwe Groß.
Die Berufungszeiträume von Frau Dr. Sabine Sydow, seit 2021 Mitglied für den Bereich Wirtschaft, und Herrn Dr. Gerd Neemann, seit 1995 Mitglied für den Bereich Umweltschutz, endeten in 2022.
Die in 2022 angestandenen Wiederberufungen wurden von der Bundesregierung nur verzögert (Prof. Dr. Dr. T. Vahlenkamp, Prof. Dr. A. Ehrhardt, Prof. Dr. U. Groß) oder nicht (Prof. Dr. E. Maiß) vorgenommen. In einem gemeinsamen Schreiben des Vorsitzenden der ZKBS und dem Präsidenten des BVL wurde dem Bundesminister für Ernährung und Landwirtschaft die Sorge mitgeteilt, dass die dem Gremium übertragenen Fachaufgaben in einer adäquaten Frist nicht zu erfüllen seien, sollte die für eine Bewertung der Anträge erforderliche Expertise nicht zur Verfügung stehen. Beide wiesen darauf hin, dass dies mit negativen Konsequenzen für den Forschungs- und Wissenschaftsstandort Deutschland im Bereich der Biotechnologie verbunden sein kann. Die prekäre Situation wurde von den Mitgliedern der ZKBS regelmäßig in den Sitzungen der ZKBS an die Vertretungen des BMEL aufgezeigt, wurde jedoch in 2022 nicht aufgelöst.
Es fanden keine Neuberufungen statt.
Die in Tabelle 3 dargestellte Zusammensetzung der ZKBS entspricht dem GenTG in der aktuell gültigen Fassung.
Tabelle 3: Fachgebiete und Mitglieder der ZKBS (Stand: Dezember 2022)
| Fachgebiet | Mitglied | stellvertretendes Mitglied |
|---|---|---|
| Sachverständige nach § 4 Absatz 1 Nummer 1 GenTG | ||
| Mikrobiologie | Prof. Dr. Petra Dersch Universität Münster** |
Prof. Dr. Susanne Hartmann Freie Universität Berlin |
| Zellbiologie | Prof. Dr. Michael Meisterernst Universität Münster** |
N.N. |
| Virologie | Prof. Dr. Dr. Thomas W. Vahlenkamp Universität Leipzig |
Prof. Dr. Edgar Maiß Universität Hannover* |
| Virologie | Prof. Dr. Sigrun Smola Universität des Saarlandes** |
Prof. Dr. Stefan Pöhlmann Deutsches Primatenzentrum GmbH, Göttingen** |
| Prof. Dr. Anja Ehrhardt Universität Witten/Herdecke |
||
| Genetik | Prof. Dr. Jürgen Wienands Universität Göttingen |
Prof. Dr. Jens Boch Universität Hannover** |
| Genetik | Prof. Dr. Uwe Sonnewald Universität Erlangen-Nürnberg** |
Prof. Dr. Uwe Völker Universität Greifswald |
| Hygiene | Prof. Dr. Uwe Groß Universität Göttingen |
Prof. Dr. Werner Solbach** Universität zu Lübeck |
| Ökologie | Prof. Dr. Michael Pester Deutsche Sammlung von Mikroorganismen und Zellkulturen, Braunschweig |
N.N. |
| Ökologie | Prof. Dr. Rainer Waldhardt Universität Gießen |
Prof. Dr. Martin Hasselmann Universität Hohenheim |
| Pflanzenzucht | Prof. Dr. Karl Schmid Universität Hohenheim |
Prof. Dr. Maria v. Korff-Schmising Universität Düsseldorf** |
| Sicherheitstechnik | Dr. Sven Deutschmann Roche-Diagnostics GmbH, Penzberg |
Dr. Holger Lübben GlaxoSmithKline Marburg |
| Toxikologie | Prof. Dr. Edmund Maser Universität zu Kiel |
N.N. |
| Sachkundige nach § 4 Absatz 1 Nummer 2 GenTG | ||
| Arbeitsschutz | Frank Gerschke Landesamt für Arbeitsschutz Potsdam** |
Dr. Daniela Harkensee Berufsgenossenschaft Rohstoffe und chemische Industrie, Hamburg** |
| Gewerkschaften | Prof. Dr. Dr. h. c. Wilfried Wackernagel Universität Oldenburg |
Dr. Brigitte Dreiseikelmann Universität Bielefeld |
| Landwirtschaft | Prof. Dr. Joseph-Alexander Verreet Universität zu Kiel |
Prof. Dr. Ulrich Schurr Universität Düsseldorf |
| Naturschutz | N.N. | N.N. |
| Forschungsfördernde Organisationen | Dr. Ingrid Ohlert Deutsche Forschungsgemeinschaft, Bonn** |
Dr. Jan-Wolfhard Kellmann Universität Marburg |
| Umweltschutz | N.N. | N.N. |
| Verbraucherschutz | Sigrid Lewe-Esch Deutscher Evangelischer Frauenbund e. V., Duisburg |
Annette Neuhaus Kreisoberchemierätin – Kreis Lippe, Detmold |
| Wirtschaft | N.N. | Dr. Anja Matzk KWS SAAT SE & Co KGaA |
- *
- Wiederberufungverfahren bis Dezember 2022 nicht abgeschlossen
- **
- bis 2023 berufen
3 Beratungstätigkeit der ZKBS im Jahre 2022
3.1 Arbeitsweise
Die Arbeitsweise der ZKBS ist in ihrer Geschäftsordnung geregelt.
Auch das Jahr 2022 war geprägt von der Pandemie, die durch Infektionen mit dem Virus Severe acute respiratory syndrome-related coronavirus Type 2 (SARS-CoV-2) ausgelöst worden ist. Im Jahr 2022 wurden fünf ordentliche Sitzungen in Form von Videokonferenzen durchgeführt. Zwei Sitzungen erfolgten in Präsenz in Berlin, wobei eine digitale Zuschaltung möglich war.
Bundesweit waren auch in diesem Jahr vermehrt Forschungsarbeiten zur Erforschung des SARS-CoV-2 sowie zur Entwicklung von therapeutischen und präventiven Ansätzen zu verzeichnen.
Auf den Sitzungen wurden die meisten Stellungnahmen der ZKBS verabschiedet. Daneben wurden aber auch Entscheidungen im schriftlichen Verfahren getroffen, wenn einfachere Fragestellungen vorlagen, die keine ausführliche Diskussion zwischen allen Mitgliedern erforderten.
3.2 Arbeitskreise
Im Jahr 2022 wurde die Arbeit des Arbeitskreises „Synthetische Biologie“ unter Leitung von Herrn Dr. J. Kellmann weitergeführt. Kontinuierlich wurden Publikationen hinsichtlich neuester Entwicklungen gesichtet und ein Erfordernis für eine Anpassung gentechnikrechtlicher Regularien überprüft. Die Ergebnisse des kontinuierlichen Monitorings werden regelmäßig auf der Homepage der ZKBS zur Verfügung gestellt9. Zudem wurde im Juli 2022 der dritte zusammenfassende Bericht mit der Bewertung, dass derzeit keine Gefährdung der biologischen Sicherheit durch die neuesten Entwicklungen im Bereich der Synthetischen Biologie besteht, verabschiedet und publiziert10.
Auch der Arbeitskreis „Neue genomische Techniken“ tagte regelmäßig, um sich mit den Fragen der Kommission auseinanderzusetzen, die sie im Rahmen von öffentlichen Konsultationen zu einer möglichen Neuregulierung genomeditierter Pflanzen stellte. Der Vorsitzende des Arbeitskreises, Herr Prof. Dr. J. Boch, berichtete hierzu dem Gremium auf seinen Sitzungen.
Auf Beschluss der ZKBS wurde die Erstellung einer allgemeinen Stellungnahme mit Kriterien zur Bewertung von gentechnischen Arbeiten mit Prionen vorbereitet. Unter Leitung von Prof. Dr. M. Meisterernst traf sich der Arbeitskreis regelmäßig. Zu einem der Treffen wurde Frau Prof. Dr. I. Vorberg (Deutsches Zentrum für Neurogenerative Erkrankungen, Bonn) als externe Expertin eingeladen, um ihr Fachwissen einzubringen. Dank ihrer Fachexpertise wurde in einer der Sitzungen der ZKBS ein Entwurf vorgelegt, der nach einer ausführlichen Diskussion als Stellungnahme beschlossen und veröffentlicht worden ist.
3.3 Beratung der Bundesregierung, der zuständigen Landesbehörden und des BVL
Folgende Fragen der zuständigen Landesbehörden wurden von der ZKBS diskutiert und bewertet:
- –
-
Wesentliche Änderung der raumlufttechnischen Anlage einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 6790-01-1703
- –
-
Prüfung des Abluftfilters der raumlufttechnischen Anlage einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 6790-01-1429
- –
-
Amtshilfe zur Genehmigung gentechnischer Anlagen der Sicherheitsstufe 3, Beurteilung des Stands von Wissenschaft und Technik, Az. 45110.2180
- –
-
Mitteilung gemäß § 28 Abs. 1 Nr. 2 GenTG bzgl. eines Vorkommnisses in der gentechnischen Anlage 140/07 der Sicherheitsstufe 4 sowie Bitte um Stellungnahme gemäß § 10 Absatz 7 GenTG, Az. 6790-01-1568
- –
-
Amtshilfe zur Bewertung gentechnischer Arbeiten mit dem Impfstoffkandidaten Ad26.COV2.S.529 (Omikron vaccine), Az. 45242.0180
- –
-
Untersuchung von gentechnisch veränderten SARS-CoV-2-Partikeln in einem Aerosol-Prüfstand, Az. 45110.2104
- –
-
Verfahren zur chemischen Inaktivierung von Pseudomonas putida KT 2440 GVO-Stämmen, Az. 45250
- –
-
Antrag auf Herabstufung von SARS-CoV-2-Varianten, Az. 45110.2106
3.4 Risikobewertung von Spender- und Empfängerorganismen
Im Jahr 2022 wurden insgesamt 73 Mikroorganismen, die bei gentechnischen Arbeiten als Spender- oder Empfängerorganismen verwendet werden, gemäß § 5 in Verbindung mit Anlage I GenTSV einer Risikogruppe zugeordnet oder deren Einstufung überprüft. Darunter waren 23 Viren, 42 Bakterien oder Archaea, 7 eukaryote Mikroorganismen sowie ein Agens einer transmissiblen spongiformen Enzephalitis. Bei folgenden Mikroorganismen wurde eine Risikobewertung durchgeführt:
Tabelle 4: Neu eingestufte Mikroorganismen (Stand: 31. Dezember 2022)
| Organismus | Risikogruppe | Aktenzeichen | Verfahren |
|---|---|---|---|
| Bakterien | |||
| Aeribacillus pallidus | 1 | 45241.0241 | E |
| Anaerobutyricum hallii | 1 | 45241.0231 | E |
| Bacteroides uniformis | 2 | 45241.0230 | S |
| Brucella anthropi | 2 | 45241.0242 | S |
| Brucella ceti | 2 | 45241.0242 | S |
| Brucella inopinata | 2 | 45241.0242 | S |
| Brucella intermedia | 2 | 45241.0242 | S |
| Brucella microti | 2 | 45241.0242 | S |
| Brucella papionis | 2 | 45241.0242 | S |
| Brucella pinnipedialis | 2 | 45241.0242 | S |
| Brucella sp. BO2 | 2 | 45241.0242 | S |
| Brucella spp., isoliert aus Amphibien und Nagetieren | 2 | 45241.0242 | S |
| Brucella vulpis | 2 | 45241.0242 | S |
| Caulobacter vibrioides | 1 | 45241.0240 | E |
| Dinoroseobacter shibae | 1 | 45241.0240 | E |
| Dorea formicigenerans | 1 | 45241.0231 | E |
| Enhydrobacter aerosaccus | 1 | 45241.0235 | E |
| Enterobacter sp. SA187 | 1 | 45241.0248 | E |
| Herbaspirillum seropedicae | 1 | 45241.0240 | E |
| Hyphomonas neptunium | 1 | 45241.0240 | E |
| Klebsiella grimontii | 2 | 45241.0238 | S |
| Klebsiella michiganensis | 2 | 45241.0238 | S |
| Pantoea eucalypti | 1 | 45241.0234 | S |
| Phaeobacter inhibens | 1 | 45241.0240 | E |
| Photorhabdus temperata | 1 | 45241.0246 | E |
| Pseudomonas lundensis | 1 | 45241.0228 | E |
| Pseudomonas oleovorans | 2 | 45241.0230 | S |
| Ralstonia pseudosolanacearum | 2 | 45241.0243 | S |
| Ralstonia syzygii ssp. celebesensis | 2 | 45241.0243 | S |
| Ralstonia syzygii ssp. indonesiensis | 2 | 45241.0243 | S |
| Ralstonia syzygii ssp. syzygii | 1 | 45241.0243 | S |
| Salmonella enterica ssp. enterica Serovar Typhi ZH9 | 1 | 45241.0245 | S |
| Stella humosa | 1 | 45241.0240 | E |
| Stella sp. ATCC 35155 | 1 | 45241.0240 | E |
| Stella vacuolata | 1 | 45241.0240 | E |
| Stieleria maiorica | 1 | 45241.0239 | E |
| Streptococcus salivarius außer den genannten Stämmen | 2 | 45241.0229 | S |
| Streptococcus salivarius Stämme K12, M18, 24SMB und DB-B5 | 1 | 45241.0229 | S |
| Streptomyces chartreusis | 1 | 45242.0247 | E |
| Sulfitobacter dubius | 1 | 45241.0240 | E |
| Vibrio coralliilyticus | 2 | 45241.0233 | S |
| Xenorhabdus doucetiae | 1 | 45241.0246 | E |
| Eukaryoten | |||
| Chrysotila carterae | 1 | 45247.0010 | E |
| Chrysotila dentata | 1 | 45247.0010 | E |
| Chrysotila haptonemofera | 1 | 45247.0010 | E |
| Chrysotila roscoffensis | 1 | 45247.0010 | E |
| Emiliania huxleyi | 1 | 45247.0010 | E |
| Trichoderma atroviride | 1 | 45243.0124 | E |
| Trichoderma virens | 1 | 45243.0124 | E |
| Viren | |||
| Adeno-assoziiertes Virus Serotyp rh.74 | 2 | 45242.0202 | S |
| Aotine betaherpesvirus 1 | 2 | 45242.0205 | E |
| Avian coronavirus | 2 | 45110.1951 | S |
| Avian orthoreovirus | 2 | 45242.0198 | E |
| Bean yellow dwarf virus (BeYDV) | 2 | 45242.0203 | S |
| Chickpea chlorotic dwarf virus | 1 | 45242.0204 | E |
| Dengue virus rDENV1Δ30, rDENV4Δ30, rDENV2/4Δ30(ME), rDENV3Δ30/31 | 1 | 45242.0201 | S |
| East African cassava mosaic virus | 1 | 45242.0204 | E |
| Feline morbillivirus | 2 | 45242.0206 | S |
| La-Jolla-Virus (LJV) | 1 | 45110.2183 | S |
| Maporal orthohantavirus | 3 | 45110.2219 | S |
| Motts Mill-Virus (MMV) | 1 | 45110.2183 | S |
| Mustelidae-endogenes Lentivirus des Frettchens (MELVmpf) | 2 | 45110.2143 | S |
| Nelson Bay orthoreovirus | 2 | 45110.2204 | E |
| Rice rat hepatitis B virus (RRHBV) | 3** | 45110.2199 | S |
| Rice tungro bacilliform virus | 1 | 45242.0200 | E |
| Rubivirus ruteetense | 2 | 45110.2216 | S |
| Rubivirus strelense | 2 | 45110.2216 | S |
| Sangassou orthohantavirus | 3 | 45110.2219 | S |
| Severe acute respiratory syndrome-related coronavirus, Viren OTS-206 und OTS-228 | 2 | 45242.210 | S |
| Tigray orthohantavirus | 3 | 45110.2219 | S |
| Tomato leaf curl Yunnan virus | 2 | 45242.0204 | E |
| Tomato yellow leaf curl China virus | 2 | 45242.0204 | E |
| TSE-Agenzien | |||
| Agens der Chronic Wasting Disease (CWD) | 3** | 6790-10-75 | S |
S: Sitzung
E: Einfaches Verfahren per E-Mail
fett gedruckt: Organismen, deren Einstufung von der in der jeweiligen TRBA abweicht (z. T. nur in Details)
Die Zuordnungen zu Risikogruppen sind in der Organismendatenbank der ZKBS zu finden11. Allgemeine Stellungnahmen zur Risikobewertung von Organismen werden auf der Homepage der ZKBS veröffentlicht12.
3.5 Sicherheitseinstufung gentechnischer Arbeiten und Bewertung sicherheitstechnischer Maßnahmen von gentechnischen Anlagen
Im Jahr 2022 hat die ZKBS 49 Stellungnahmen zur Sicherheitseinstufung gentechnischer Arbeiten und/oder zu erforderlichen Sicherheitsmaßnahmen abgegeben. Die bewerteten gentechnischen Arbeiten und Anlagen betrafen die in Tabelle 5 zusammengestellten Themen. Bei vielen gentechnischen Arbeiten, die bewertet wurden, erfolgte für die Sicherheitsmaßnahmen lediglich ein Hinweis auf die GenTSV. Bei einigen hingegen erfolgte eine detaillierte Bewertung der in der gentechnischen Anlage vorliegenden bzw. vorgesehenen technischen und organisatorischen Sicherheitsmaßnahmen.
Tabelle 5: Sicherheitsbewertete gentechnische Arbeiten und Anlagen im Jahr 2022. Die Titel der gentechnischen Arbeiten wurden aus den eingereichten Antragsunterlagen übernommen.
| Sicherheitsstufe 1 (1) | |
| – | A controlled gene-drive for the maize pathogen Ustilago maydis, Az. 45110.2212 |
| Sicherheitsstufe 2 (21) | |
| – | Rekombinante Picornaviren für die Tumorgentherapie, Az. 45110.2089_1. Erweiterung |
| – | Verwendung von rekombinanten replikationskompetenten Luziferase-/GFP-Reporterviren (Derivate des humanen Adenovirus Typ 5 (hAd5), Herpes-simplex-Virus-1 (HSV-1), Influenza-A-Virus (FLUAV), murinen Hepatitisvirus (MHV), Semliki-Forest-Virus (SFV), Vesikulären Stomatitis-Virus (VSV) und Zikavirus (ZIKV)) für die Untersuchung zellbiologischer Prozesse, insbesondere der angeborenen Immunantwort, Az. 45110.2181 |
| – | Herstellung rekombinanter Bienen- und Insektenviren, Az. 45110.2183 |
| – | Untersuchung zur Rolle Autophagie-Rezeptoren für die Pathogenese des Cytomegalovirus, Az. 45110.2186 |
| – | Infektion von Zelllinien und Primärzellen mit rekombinantem LCMV, bei dem das LCMV Glykoprotein (GP) durch das Lassa Virus (LASV) GP ersetzt wurde, Az. 45110.2188 |
| – | Infektion von Zelllinien und Primärzellen mit rekombinantem LCMV, bei dem die RRLA SKI-1-Schnittstelle im LCMV-Glykoprotein durch die RRRR Furin-Schnittstelle ersetzt wurde, Az. 45110.2189 |
| – | Untersuchung der Zellbindung, des Zelleintritts und der Pathogenität von respiratorischen Hüllviren (FLUAV, VSV) und ihrer Genprodukte sowie der Beitrag wirtsspezifischer Faktoren in verschiedenen Zelllinien und Humanzellisolaten, Az. 45110.2190 |
| – | Identifizierung und Charakterisierung von Antibiotikaresistenz-Systemen und Desinfektionsmittelresistenz-Systemen aus verschiedenen Enterobacteriaceae, Az. 45110.2191 |
| – | Entwicklung von Untersuchungsmethoden für einen Tollwutimpfstoff für Hunde und Katzen, welcher das Rabiesvirus-Glykoprotein G (RabG) im Equinen Herpesvirus-Vektor (EHV-1) enthält: EHV-1-RabG.gbl., Az. 45110.2193 |
| – | Adenovirale Onkolyse mit mutierten humanen Adenoviren, Az. 45110.2196 |
| – | Herstellung von Impfvektoren bzw. -viren auf Basis von HSV1, Az. 45110.2201 |
| – | Arbeiten mit dem Impfstoffkandidaten sCPD9, einem durch gentechnische Veränderung abgeschwächten SARS-CoV-2 Virus, Az. 45110.2202 |
| – | Einsatz eines plasmidbasierten reversen genetischen Systems zur Erforschung grundlegender biologischer Mechanismen von Rotaviren, Az. 45110.2204 |
| – | Evaluierung der onkolytischen Aktivität (VSV-GP) Virus-basierter Impfungen in einem syngenetischen Maus-Melanom-Modell (B16F10), Az. 45110.2205 |
| – | RNA-Schalter zur Regulation der Expression viraler Gene und/oder therapeutischer Transgene von onkolytischen Masernvirus-Impfstämmen, Az. 45110.2207 |
| – | Lagerung, Sekundärverpackung und Versand von GVO-(NDV)-Produkten, Az. 45110.2210 |
| – | Untersuchung der Aktivität eines Typ IV-A CRISPR-Cas Systems in Pseudomonas oleovorans, Az. 45110.2213 |
| – | Herstellung rekombinanter Arteriviren, Az. 45110.2214 |
| – | Identification and characterization of plant genes and proteins involved in the infection by geminiviruses, Az. 45110.2215 |
| – | Charakterisierung von Vetretern des Genus Rubivirus, Az. 45110.2216 |
| – | Virus-based transient transformation of maize, Az. 45110.2217 |
| Sicherheitsstufe 3 (27) | |
| – | Prüfung des Abluftfilters der raumlufttechnischen Anlage einer gentechnischen Anlage der Sicherheitsstufe 3 der Ludwig-Maximilians-Universität München, Az. 6790-01-1429 |
| – | Wesentliche Änderung der Gentechnischen Anlage PEI 13, Az. 6790-01-1658 |
| – | Genehmigung der wesentlichen Änderung einer bestehenden gentechnischen Anlage der Sicherheitsstufe 3, Az. 6790-01-1676_wesentliche Änderung |
| – | Isolierung von HIV-1 und HCV neutralisierenden Antikörpern – 2. Erweiterung, Az. 45110.1935_2. Erweiterung |
| – | Wesentliche Änderung: Technische Anpassung an der Thermischen Abwasserinaktivierungsanlage (TAI) und an der Raumlufttechnischen Anlage (RLT), Az. 45110.2075_wesentliche Änderung |
| – | Etablierung eines Tiermodells für SARS-CoV-2 und Testung von Impfstoffen und Therapeutika, Az. 45110.2079_2. Erweiterung |
| – | Untersuchungen zum Replikationszyklus des Severe acute respiratory syndrome Coronavirus (SARS-CoV)-2 in eukaryotischen Zellen mit Hilfe von rekombinant hergestellten Viren, Az. 45110.2108_1. Erweiterung |
| – | Visualisierung und Charakterisierung von Zellen, die eine Infektion mit mausadaptieren SARS-CoV-2 überleben – 1. Erweiterung, Az. 45110.2142_1. Erweiterung |
| – | Untersuchung rekombinanter Immundefizienzviren zur Pathogenese und Wirt-Virus-Interaktionen in humanen und anderen Säugetierzellen – Erweiterungsantrag 4, Az. 45110.2143_1. Erweiterung |
| – | Errichtung und den Betrieb einer gentechnischen Anlage – Änderung der beantragten Sicherheitsmaßnahmen, Az.45110.2152_1. Änderung |
| – | Biologie und Pathogenese der Humanen Immundefizienzviren Typ 1 und Typ 2 (HIV-1, HIV-2)-Erweiterung, Az. 45110.2176 |
| – | Charakterisierung von SARS-CoV-2 Mutationen, Az. 45110.2187 |
| – | Untersuchungen von Virus-Wirts-Interaktionen bei Koinfektion primärer Zellen und Zelllinien mit Paaren von rekombinanten arthritogenen Alphaviren (Mayaro-Virus und Chikungunyavirus) sowie chimären Viren, Az. 45110.2192 |
| – | Kryptische Leserahmen in SARS-CoV-2 ORF3a, Az. 45110.2194 |
| – | Charakterisierung der Evolution und Immunevasion von Lentiviren und der Pathogenese von AIDS, Az. 45110.2195 |
| – | Tetrazyklin-abhängige Expressionskontrolle von essentiellen Genen zur Wirkstoffvalidierung gegen Mycobacterium tuberculosis, Az. 45110.2197 |
| – | Charakterisierung der Erreger-Wirt-Interaktionen von einem mausadaptierten SARS-CoV-2 lsolat, Az. 45110.2198 |
| – | Produktion und Charakterisierung subviraler Hepadnaviruspartikel, Az. 45110.2199 (als S2 angezeigt) |
| – | Herstellung rekombinanter Betacoronaviren (Subgenus SARS-CoV-2), Az. 45110.2200 |
| – | Untersuchungen zu neuen Wirkstoffen MJ22 und B6 gegen Mycobacterium tuberculosis, Az. 45110.2203 |
| – | Untersuchungen zu molekularen Sekretionsmechanismen von Virulenzfaktoren und immunmodulierenden Effektorproteinen und deren Wirkungsweisen in Salmonella enterica Serovar Typhi, Az. 45110.2206 |
| – | Funktionelle RNA Strukturen des replikations-kompetenten HIV-1 Genoms, Az. 45110.2208 |
| – | Evaluation attenuierter SARS-CoV-2 Viren als potentielle Impfvektoren in huACE-2 transgenen Mäusen, Az. 45110.2209 |
| – | Replikation von Varianten des Mayarovirus (MAYV) in vitro, Az. 45110.2211 |
| – | Gentechnische Arbeiten zu Coronaviren im Zusammenhang mit der SARS-CoV-2-Pandemie, Az. 45110.2218 |
| – | Untersuchungen zur Replikation und Virus-Wirtszellinteraktionen von Hantaviren, Az. 45110.2219 |
| – | Einfluss der offenen Leserahmen auf die Replikation des SARS Coronavirus 2 in humanen Zellen, Az. 45110.2220 |
| Sicherheitsstufe 4 | |
| – | keine |
Zusammenfassend ist in Abbildung 2 die Anzahl der im Jahr 2022 abgegebenen Stellungnahmen der ZKBS im Vergleich zu der Anzahl der in den vergangenen vier Jahren abgegebenen Stellungnahmen grafisch dargestellt. Insgesamt bestätigt sich der im Vergleich zu anderen Jahren in 2020 deutlich vermehrte Bedarf an Stellungnahmen zu gentechnischen Arbeiten der Sicherheitsstufe 3. Dies ist auf die pandemiebedingte und seitens des Bundes geförderte Ausrichtung von Forschungsansätzen auf Coronaviren zurückzuführen. Die Gesamtzahl der in 2022 der ZKBS vorgelegten Anträge entspricht der der Pandemievorjahre. Auch in 2022 lag der Fokus der eingereichten Anträge zur Durchführung gentechnischer Arbeiten der Sicherheitsstufe 3 auf Forschungsarbeiten zu Coronaviren (36 %), zum Teil wurde die Erweiterung oder Neuausrichtung bereits begonnener Arbeiten mit dem Virus beantragt. Mit Inkrafttreten der novellierten Gentechniksicherheitsverordnung im März 2021 wurden aber auch vermehrt Anträge auf wesentliche Änderung einer gentechnischen Anlage der Sicherheitsstufe 3 vorgelegt, um dem gesetzlich geforderten Stand nach Wissenschaft und Technik gerecht zu werden. In diesen Anträgen wurde vornehmlich der Umbau von raumlufttechnischen Anlagen beschrieben, um darin enthaltene H14-HEPA-Filter im eingebauten Zustand auf Dichtsitz und Integrität hin überprüfen zu können (Partikelscanner).
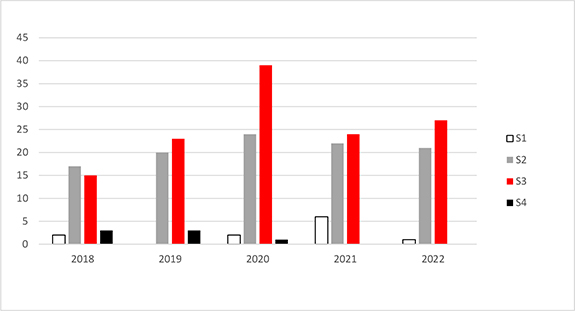
Abbildung 2: Die Abbildung beschreibt die jeweilige Anzahl der von der ZKBS in den vergangenen fünf Jahren erstellten Stellungnahmen zu gentechnischen Arbeiten in gentechnischen Anlagen, differenziert nach den Sicherheitsstufen 1 bis 4 (S1 – S4).
3.6 Allgemeine Stellungnahmen und Berichte
Die ZKBS hat im Jahr 2022 folgende allgemeine Stellungnahmen erstellt oder überabeitet:
- –
-
Aktualisierung der Stellungnahme der ZKBS zur Risikobewertung von prokaryotischen Umweltisolaten bei gentechnischen Arbeiten, Az. 6790-10-43
- –
-
Aktualisierung der Stellungnahme der ZKBS zur Einstufung gentechnischer Arbeiten, bei denen Gene für immunmodulierende Proteine in das Genom replikationskompetenter Mikroorganismen inseriert werden, Az. 6790-03-05
- –
-
Stellungnahme der ZKBS zur Eignung von asporogenen, thyminabhängigen Mutanten von Bacillus subtilis 168 als Teil biologischer Sicherheitsmaßnahmen gemäß § 8 Absatz 1 GenTSV, Az. 45270_d
- –
-
Stellungnahme der ZKBS zur Risikobewertung gentechnischer Arbeiten zur Expression von Prion-Proteinen, Az. 6790-10-75
- –
-
Allgemeine Stellungnahme „Sendaivirus-abgeleitete Vektoren zur Generierung pluripotenter Stammzellen (iPSC)“ – Disclaimer, Az. 45310.0119
- –
-
3. Bericht der ZKBS zur Synthetischen Biologie
Alle allgemeinen Stellungnahmen finden sich auf der Internetseite der ZKBS13.
3.7 Außerkraftsetzung von Stellungnahmen
Regelmäßig überprüft die ZKBS ihre Stellungnahmen auf Aktualität. In 2022 wurden folgende Stellungnahmen außer Kraft gesetzt:
- –
-
Stellungnahme der ZKBS zur Infektion von Tieren mit gentechnisch veränderten Organismen der Risikogruppe 2 (Az. 6790-10-31, 1994)
- –
-
Stellungnahme der ZKBS zur Bewertung der Expression des murinen Pelota-Gens mithilfe des Vektors pTAT-2.2 (Az. 6790-04-0231, 2006)
- –
-
Stellungnahme der ZKBS zu häufig durchgeführten gentechnischen Arbeiten mit den zugrunde liegenden Kriterien der Vergleichbarkeit: Gentechnische Arbeiten mit SV40 als Spenderorganismus (Az. 6790-10-34, 1995)
3.8 Stellungnahmen zu Freisetzungen
Stellungnahmen zu Freisetzungsanträgen von GVO wurden im Berichtszeitraum von der ZKBS nicht abgegeben.
3.9 Stellungnahmen zu Inverkehrbringen
Stellungnahmen zu Anträgen auf Inverkehrbringen von GVO wurden im Berichtszeitraum von der ZKBS nicht abgegeben.
3.10 Berichte über Themen von allgemeiner Bedeutung
Mithilfe der eigenen Homepage (https://www.zkbs-online.de) möchte die ZKBS auch die Möglichkeit nutzen, der Öffentlichkeit in geeigneter Weise über Themen von allgemeiner Bedeutung, wie die Entwicklungen im Bereich der Synthetischen Biologie, zu berichten. Im Jahr 2021 erschien die Homepage in einem neuen Design und mit einer neuen Struktur. In 2022 wurde ein Erklärvideo eingestellt, in dem die Arbeitsweise der ZKBS für die interessierte Öffentlichkeit an einem Beispiel erläutert wird.
- 1
- https://food.ec.europa.eu/plants/genetically-modified-organisms/reports-and-studies_en#implementation_of_legisla
- 2
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_B_Plants.php
- 3
- https://www.bafu.admin.ch/bafu/de/home/themen/biotechnologie/fachinformationen/freisetzungsversuche/freisetzungsversuche-mit-gentechnisch-veraenderten-organismen–g/b20002-gesuch-weizen.html
- 4
- https://www.gov.uk/government/collections/genetically-modified-organisms-applications-and-consents
- 5
- https://www.bvl.bund.de/DE/Arbeitsbereiche/06_Gentechnik/02_Verbraucher/03_Genehmigungen/01_Inverkehrbringen/gentechnik_GenehmigungenInverkehrbringen_node.html
- 6
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_C.php
bzw. https://webgate.ec.europa.eu/dyna/gm_register/index_en.cfm - 7
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_B_Others.php
- 8
- https://www.pei.de/DE/arzneimittel/atmp/gentherapeutika/gentherapeutika-node.html
- 9
- https://www.zkbs-online.de/ZKBS/DE/SynthetischeBiologie/SynthetischeBiologie_node.html
- 10
- https://www.zkbs-online.de/ZKBS/SharedDocs/Downloads/Berichte/3._Bericht_ZKBS_Synthetische_Biologie_Juni_2018-Dez_2021.html?nn=15069024#download=1
- 11
- https://zag.bvl.bund.de/organismen/index.jsf
- 12
- https://www.zkbs-online.de/ZKBS/DE/Stellungnahmen/stellungnahmen_node.html
- 13
- https://www.zkbs-online.de/ZKBS/DE/Stellungnahmen/stellungnahmen_node.html











Kommentar hinterlassen