Bundesamt
für Verbraucherschutz und Lebensmittelsicherheit
Bekanntmachung
der Arbeit der Zentralen Kommission
für die Biologische Sicherheit im Jahr 2023
BVL 129/2024/04
34. Bericht nach Inkrafttreten des Gentechnikgesetzes
Nachfolgend wird der vorgenannte Bericht über die Arbeit der Zentralen Kommission für die Biologische Sicherheit im Jahr 2023 bekannt gegeben.
(BVL-Az.: 45040)
Bundesamt
für Verbraucherschutz und Lebensmittelsicherheit
Im Auftrag
Dr. Anke Stein
Gliederung
| 1 | Einleitung |
| 1.1 | Grundlagen der ZKBS |
| 1.2 | Entwicklung der Gentechnik in der Bundesrepublik Deutschland und in anderen Mitgliedstaaten der Europäischen Union |
| 2 | Zusammensetzung der ZKBS |
| 3 | Beratungstätigkeit der ZKBS im Jahre 2023 |
| 3.1 | Arbeitsweise |
| 3.2 | Festveranstaltung anlässlich der 250. ordentlichen Sitzung der ZKBS |
| 3.3 | Arbeitskreise |
| 3.4 | Beratung der Bundesregierung, der zuständigen Landesbehörden und des BVL |
| 3.5 | Risikobewertung von Spender- und Empfängerorganismen |
| 3.6 | Sicherheitseinstufung gentechnischer Arbeiten und Bewertung sicherheitstechnischer Maßnahmen von gentechnischen Anlagen |
| 3.7 | Allgemeine Stellungnahmen und Berichte |
| 3.8 | Außerkraftsetzung von Stellungnahmen |
| 3.9 | Stellungnahmen zu Freisetzungen |
| 3.10 | Stellungnahmen zu Inverkehrbringen |
| 3.11 | Berichte über Themen von allgemeiner Bedeutung |
Abkürzungen
| ATMP | Advanced Therapy Medicinal Products (Arzneimittel für neuartige Therapien) |
| BfN | Bundesamt für Naturschutz |
| BfR | Bundesinstitut für Risikobewertung |
| BMEL | Bundesministerium für Ernährung und Landwirtschaft |
| BVL | Bundesamt für Verbraucherschutz und Lebensmittelsicherheit |
| EFSA | European Food Safety Authority (Europäische Behörde für Lebensmittelsicherheit) |
| EG | Europäische Gemeinschaft |
| EMA | European Medicines Agency (Europäische Arzneimittel-Agentur) |
| EU | Europäische Union |
| EuGH | Europäischer Gerichtshof |
| FLI | Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit |
| GenTG | Gentechnikgesetz |
| GenTSV | Gentechnik-Sicherheitsverordnung |
| GVO | gentechnisch veränderter Organismus |
| JKI | Julius Kühn-Institut, Bundesforschungsinstitut für Kulturpflanzen |
| PEI | Paul-Ehrlich-Institut, Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel |
| RKI | Robert Koch-Institut, Bundesinstitut für die öffentliche Gesundheit |
| ZKBS | Zentrale Kommission für die Biologische Sicherheit |
Weitere fachliche Abkürzungen werden im Text erklärt.
1 Einleitung
1.1 Grundlagen der ZKBS
Die Zentrale Kommission für die Biologische Sicherheit (ZKBS) ist eine Sachverständigenkommission, die sich aus 20 Mitgliedern und 20 stellvertretenden Mitgliedern zusammensetzt. Die Mitglieder sind Expertinnen beziehungsweise Experten verschiedener Fachrichtungen und werden von Expertinnen beziehungsweise Experten derselben Fachrichtung vertreten. Die vertretenen Fachgebiete sind im Gentechnikgesetz (GenTG) vorgegeben. Die ZKBS prüft und bewertet sicherheitsrelevante Fragen zur Gentechnik nach den Vorschriften des GenTG und berät die Bundesregierung und die Bundesländer. Sie gibt gegenüber den zuständigen Behörden Stellungnahmen ab, insbesondere zur Risikobewertung von Mikroorganismen, zur Sicherheitseinstufung gentechnischer Arbeiten, zu erforderlichen Sicherheitsmaßnahmen in gentechnischen Anlagen und zu möglichen Risiken der Freisetzung oder des Inverkehrbringens von gentechnisch veränderten Organismen (GVO). Sie berücksichtigt bei ihren Empfehlungen die internationalen Entwicklungen auf dem Gebiet der gentechnischen Sicherheit. Die Mitglieder der ZKBS und ihre Stellvertretenden versehen ihre Tätigkeit entsprechend dem GenTG ehrenamtlich.
Die ZKBS hat ihre Geschäftsstelle am Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL), das zum Geschäftsbereich des Bundesministeriums für Ernährung und Landwirtschaft (BMEL) gehört. Die Mitglieder der ZKBS und ihre Stellvertreterinnen und Stellvertreter werden vom BMEL im Einvernehmen mit den Bundesministerien für Bildung und Forschung (BMBF), für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz (BMUV), für Gesundheit (BMG), für Arbeit und Soziales (BMAS) sowie für Wirtschaft und Klimaschutz (BMWK) für die Dauer von drei Jahren berufen. Eine Wiederberufung ist zulässig.
Die ZKBS hat eine Vorsitzende beziehungsweise einen Vorsitzenden, der/dem zwei stellvertretende Vorsitzende zur Seite stehen. Die Kommission fasst ihre Beschlüsse entweder auf einer der regelmäßigen Sitzungen oder in einem schriftlichen Verfahren. Die Mitglieder der ZKBS und ihre Stellvertreterinnen und Stellvertreter sind zur Verschwiegenheit verpflichtet. Die Sitzungen sind nicht öffentlich, jedoch veröffentlicht die ZKBS allgemeine Stellungnahmen und berichtet jährlich der Öffentlichkeit über ihre Arbeit.
1.2 Entwicklung der Gentechnik in der Bundesrepublik Deutschland und in anderen Mitgliedstaaten der Europäischen Union
Gentechnische Arbeiten und gentechnische Anlagen
Unter dem Begriff „gentechnische Arbeiten“ werden insbesondere die Erzeugung von GVO und der Umgang mit GVO zusammengefasst. Gentechnische Arbeiten müssen abhängig von ihrer Sicherheitsstufe bei der zuständigen Landesbehörde angezeigt, angemeldet oder genehmigt und in einer gentechnischen Anlage durchgeführt werden, die ebenfalls abhängig von der Sicherheitsstufe angezeigt, angemeldet oder genehmigt werden muss. Gentechnische Anlagen können Laboratorien, Produktionsanlagen, Gewächshäuser und/oder Tierräume sein.
Grundsätzlich holt die zuständige Behörde vor der Entscheidung über eine Genehmigung eine Stellungnahme der ZKBS zur Sicherheitseinstufung der vorgesehenen gentechnischen Arbeiten und zu den erforderlichen sicherheitstechnischen Maßnahmen ein. Dabei handelt es sich in der Regel um gentechnische Arbeiten der Sicherheitsstufen 3 oder 4 und um gentechnische Anlagen mit Sicherheitsmaßnahmen der Stufen 3 oder 4. Aufgrund der gesetzlichen Vorgaben bittet die zuständige Behörde die ZKBS auch um Stellungnahmen zu solchen gentechnischen Arbeiten der Sicherheitsstufe 2, die nicht mit anderen Arbeiten vergleichbar sind, zu denen die ZKBS in der Vergangenheit bereits eine Stellungnahme abgegeben hat. Zudem bittet sie um Beratung zu solchen gentechnischen Arbeiten, deren Zuordnung zur Sicherheitsstufe 1 unsicher ist.
Seit Inkrafttreten des GenTG im Jahre 1990 wurden der ZKBS 2 257 Erstanträge auf Sicherheitseinstufung gentechnischer Arbeiten und/oder auf Bewertung der erforderlichen sicherheitstechnischen Maßnahmen vorgelegt. Im Berichtsjahr wurden 46 Erst- oder Erweiterungsanträge eingereicht, die ZKBS gab 50 Stellungnahmen ab. Es waren noch einige Anträge zu bearbeiten, die im Jahr 2022 eingegangen waren.
In Deutschland sind insgesamt 6 815 gentechnische Anlagen angezeigt, angemeldet oder genehmigt (Stand: Dezember 2023). Tabelle 1 listet die gentechnischen Anlagen nach der Stufe der Sicherheitsmaßnahmen auf. Tabelle 2 fasst die je nach Sicherheitsstufe in Deutschland angezeigten, angemeldeten oder genehmigten gentechnischen Arbeiten zusammen.
Tabelle 1: Angezeigte, angemeldete oder genehmigte gentechnische Anlagen in Deutschland (Stand: Dezember 2023)
| Stufe | Anzahl |
|---|---|
| S1 | 4 820 |
| S2 | 1 898 |
| S3 | 93 |
| S4 | 5 |
Im Vergleich zu den vergangenen fünf Jahren ist die Gesamtzahl von 6 000 bis 7 000 gentechnischen Anlagen der Stufen 1 bis 4 weitgehend stabil geblieben. Den größten Anteil nehmen die Anlagen der Sicherheitsstufen 1 und 2 ein (siehe Abbildung 1).
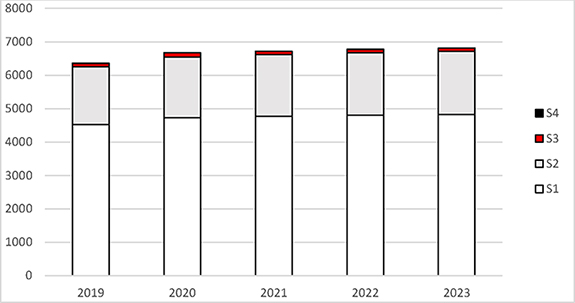
Abbildung 1: Dargestellt ist die kumulative Anzahl der angezeigten, angemeldeten oder genehmigten gentechnischen Anlagen Deutschlands, differenziert nach Sicherheitsstufe (S1 bis S4) in den Jahren 2019 bis 2023.
Auch die Anzahl der gentechnischen Arbeiten im Bereich der Sicherheitsstufen 3 und 4 änderte sich innerhalb der vergangenen fünf Jahre nur geringfügig (siehe Abbildung 2). Es ist in 2023 jedoch ein erkennbarer Anstieg bei den gentechnischen Arbeiten der Sicherheitsstufe 2 zu verzeichnen. Konkrete Angaben über die tatsächliche Anzahl gentechnischer Arbeiten der Sicherheitsstufe 1 können nicht gemacht werden, da es keine Vorgaben für eine behördliche Erfassung gibt.
Tabelle 2: Derzeit angezeigte, angemeldete oder genehmigte gentechnische Arbeiten in Deutschland (Stand: Dezember 2023)*
| Stufe | Anzahl |
|---|---|
| S2 | 10 880 |
| S3 | 469 |
| S4 | 18 |
- *
- Eine Angabe der durchgeführten gentechnischen Arbeiten der Sicherheitsstufe 1 ist nicht möglich, da die Betreiber gemäß § 9 GenTG zwar zur Aufzeichnung weiterer Arbeiten der Sicherheitsstufe 1 verpflichtet sind, jedoch keine Anzeige- oder Meldepflicht gegenüber der zuständigen Landesbehörde besteht. Somit werden weitere S1-Arbeiten in den behördlichen Datenbanken nicht erfasst.
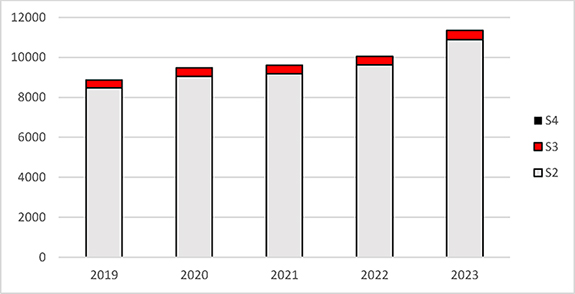
Abbildung 2: Dargestellt ist die kumulative Anzahl der angezeigten, angemeldeten oder genehmigten gentechnischen Arbeiten Deutschlands, differenziert nach Sicherheitsstufe (S2 bis S4) in den Jahren 2019 bis 2023.
Weitere Informationen zu gentechnischen Arbeiten und gentechnischen Anlagen werden über die Internet-Seite der ZKBS zur Verfügung gestellt: https://www.zkbs-online.de.
Ein Vergleich der Anzahl der gentechnischen Arbeiten oder gentechnischen Anlagen zwischen Deutschland und anderen Mitgliedstaaten der Europäischen Union (EU) ist nicht möglich, da hierzu keine Informationen vorliegen. Allgemeine Informationen zur Umsetzung der zugrunde liegenden Richtlinie 2009/41/EG werden der Europäischen Kommission in regelmäßigen Abständen von den Mitgliedsstaaten in Form ausgefüllter Fragebögen zur Verfügung gestellt. Die Rückmeldungen aus den Mitgliedsstaaten werden durch die Europäische Kommission zusammengefasst und auf ihrer Homepage veröffentlicht.1 Im Jahr 2023 erfolgte keine Bitte um Berichterstattung seitens der Europäischen Kommission.
Freisetzungen von GVO
Werden bei einem Experiment GVO zeitlich und räumlich begrenzt in die Umwelt ausgebracht, handelt es sich um eine Freisetzung. Für jede beabsichtigte Freisetzung muss gemäß GenTG beim BVL eine Genehmigung eingeholt werden, die dann erteilt werden kann, wenn von der geplanten Freisetzung keine schädlichen Auswirkungen für Menschen, die Umwelt in ihrem Wirkungsgefüge, Tiere, Pflanzen sowie Sachgüter ausgehen. Liegt für die GVO, die freigesetzt werden sollen, bereits eine Genehmigung für das Inverkehrbringen vor, ist keine gesonderte Genehmigung erforderlich.
In Deutschland ist das BVL seit dem 1. April 2004 als Bundesoberbehörde für die Genehmigung von Freisetzungen von GVO zuständig. Das BVL trifft die Entscheidungen im Benehmen mit dem Bundesamt für Naturschutz (BfN), dem Bundesinstitut für Risikobewertung (BfR) und dem Robert Koch-Institut (RKI). Die ZKBS, das Julius Kühn-Institut (JKI) und die zuständige Behörde des betroffenen Bundeslandes geben jeweils Stellungnahmen zum Freisetzungsvorhaben ab. Im Fall der Freisetzung von gentechnisch veränderten Wirbeltieren oder von gentechnisch veränderten Mikroorganismen, die an Wirbeltieren angewendet werden, wird auch das Friedrich-Loeffler-Institut (FLI) beteiligt. Die anderen EU-Mitgliedstaaten werden über Freisetzungsanträge informiert und können Stellung dazu nehmen.
Wie in den Jahren 2013 bis 2022 wurden in Deutschland auch im Jahr 2023 weder Freisetzungen von GVO beantragt noch Genehmigungen für solche Freisetzungen erteilt. Ein Vergleich der eingereichten Freisetzungsanträge aus den verschiedenen Mitgliedstaaten der EU zeigt, dass im Vergleich zum Vorjahr in 2023 eine Zunahme an Anträgen auf Freisetzung zu verzeichnen ist. Waren es in 2022 insgesamt nur drei Anträge aus EU-Staaten, wurden in 2023 elf Anträge gestellt. Konkret waren es in Spanien drei Anträge, wovon einer die Freisetzung einer genomeditierten Tabakpflanze betraf. In Belgien wurden zwei Anträge zu genomeditierten Maislinien gestellt, in Schweden drei Anträge zu einer transgenen Pappellinie, einer transgenen Kartoffellinie sowie zu einer transgenen und genomeditierten Ackerschmalwand. In Dänemark wurden zwei Anträge zur Freisetzung genomeditierter Kartoffellinien eingereicht und in Lettland zur Freisetzung einer transgenen Kartoffellinie. Sechs der beantragten Freisetzungen beinhalteten somit genomeditierte pflanzliche Linien. Einzelheiten zu den Anträgen können dem von der Europäischen Kommission geführten Register entnommen werden.2 Innerhalb Europas wurden zudem in der Schweiz in einer protected site Freisetzungsversuche mit genomeditierten Gerstenlinien beantragt3, in Großbritannien Freisetzungen von Weizen.4
Inverkehrbringen von GVO
Unter Inverkehrbringen versteht man die Abgabe von GVO und Produkten, die GVO enthalten oder aus solchen hergestellt wurden, an Dritte, meist zu Zwecken der Vermarktung.
Für das Inverkehrbringen von GVO bedarf es eines EU-weiten Zulassungsverfahrens. In diesem Verfahren wird unterschieden, ob der GVO als Lebens- oder Futtermittel genutzt werden soll [Verordnung (EG) Nr. 1829/2003] oder nicht [Richtlinie 2001/18/EG]. Produkte aus GVO, die nicht in den Geltungsbereich der genannten Verordnung oder Richtlinie fallen, wie zum Beispiel Kleidung aus Baumwolle, bedürfen keiner Genehmigung zum Inverkehrbringen. Nach Durchlaufen des EU-weiten Verfahrens gilt die Zulassung für alle Mitgliedstaaten der EU.
Das BVL ist die zuständige deutsche Behörde und gibt eine nationale Stellungnahme zu Anträgen auf Inverkehrbringen von GVO im Benehmen mit dem BfN, dem BfR und dem RKI ab. Zuvor wird eine Stellungnahme des JKI und, falls es sich bei den GVO um Wirbeltiere oder Mikroorganismen handelt, die an Wirbeltieren angewendet werden sollen, auch eine Stellungnahme des FLI und des Paul-Ehrlich-Instituts (PEI) eingeholt.
Zudem bittet das BVL die ZKBS um eine Stellungnahme zu solchen Anträgen nach Richtlinie 2001/18/EG, die in Deutschland eingereicht wurden. Bei Anträgen nach Verordnung (EG) Nr. 1829/2003 holt das BVL dann eine Stellungnahme der ZKBS ein, wenn Deutschland von der European Food Safety Authority (EFSA) mit einer Umweltrisikoprüfung eines Antrages auf Anbau beauftragt wurde. In 2023 gab es keine diesbezüglichen Anfragen an die ZKBS.
Derzeit sind events (Anzahl in Klammern) folgender Pflanzen zumeist für die Einfuhr als vermehrungsfähiger GVO und dessen Verarbeitung oder als Lebens- und Futtermittel zugelassen:
- –
-
Baumwolle (15, +/–0 im Vergleich zum Vorjahr)
- –
-
Mais (87, +5 im Vergleich zum Vorjahr)
- –
-
Raps (18, +/–0 im Vergleich zum Vorjahr)
- –
-
Soja (28, +/–0 im Vergleich zum Vorjahr)
- –
-
Zierpflanzen (5, –1 im Vergleich zum Vorjahr)
- –
-
Zuckerrübe (1, +/–0 im Vergleich zum Vorjahr)
Weiterführende Details sind auf den Internetseiten des BVL5 sowie in den Einträgen des Registers der EU zu finden.6 Im Unterschied zu örtlich und zeitlich begrenzten Freisetzungsversuchen ist der landwirtschaftliche Anbau gentechnisch veränderter Pflanzen nicht auf bestimmte Standorte oder Versuchsjahre beschränkt. Ein Anbau von gentechnisch veränderten Pflanzen durch Landwirte kann erst dann stattfinden, wenn das Inverkehrbringen des gentechnisch veränderten Saatguts zum Zweck der Ausbringung in die Umwelt zugelassen worden ist. Eine Zulassung gilt in der Regel für zehn Jahre und kann danach verlängert werden. Verantwortlich für die wissenschaftliche Bewertung ist die EFSA.
Vorschlag der EU-Kommission zur Neuregulierung genomeditierter Pflanzen
Nachdem in 2022 von der EU-Kommission eine intensive Diskussion unter Beteiligung von stakeholdern und zuständiger Behörden zum Risikopotenzial von genomeditierten Pflanzen und entsprechendem Regulierungsbedarf geführt worden ist, legte sie am 5. Juli 2023 Parlament und Rat einen Gesetzesentwurf zur Neuregulierung von Pflanzen vor, die mithilfe bestimmter neuer genomischer Techniken hergestellt werden beziehungsweise worden sind, einschließlich ihrer Produkte (Lebens- und Futtermittel)7. Der Vorschlag sieht unter anderem vor, dass NGT-Pflanzen, deren genetische Veränderungen auch durch natürliche Prozesse oder klassische Züchtungsmethoden entstehen können (NGT-1), mit klassisch gezüchteten Pflanzen rechtlich auf eine Stufe gestellt werden und von der GVO-Regulierung ausgenommen sind. Unter spanischer Ratspräsidentschaft startete der Diskurs hierzu im Europäischen Rat und im Europäischen Parlament. Das BMEL berichtete hierzu regelmäßig auf den Sitzungen der ZKBS.
Klinische Prüfungen mit GVO-haltigen Prüfprodukten und Anwendung von GVO-haltigen Arzneimitteln am Menschen
Gemäß § 2 Absatz 3 GenTG ist die Anwendung GVO-haltiger Prüfprodukte am Menschen von gentechnikrechtlichen Regularien in Deutschland ausgenommen. Die Genehmigung klinischer Prüfungen mit Prüfpräparaten, die aus einem GVO oder einer Kombination von GVO bestehen oder solche enthalten, ist im § 40 des Arzneimittelgesetzes geregelt. Für die Erteilung der Genehmigung ist in Deutschland das PEI als obere Bundesbehörde zuständig. Das BVL wird als Benehmensbehörde bei der Bewertung des Risikos für Dritte und die Umwelt und bei der Feststellung zur Abgrenzung bestimmter Tätigkeiten zum GenTG beteiligt und berichtet der ZKBS hierzu. In einigen Fällen bewertet die ZKBS das Gefährdungspotenzial der verwendeten GVO in einer Stellungnahme.
Im Jahr 2023 wurden 26 Genehmigungen durch das PEI erteilt, bei denen das BVL beteiligt war. Bei den Prüfprodukten handelte es sich um potenzielle Arzneimittel für neuartige Therapien (ATMP), die mehrheitlich lenti- oder retroviral transduzierte körpereigene Zellen umfassen, aber auch um Impfstoffe, onkolytische Adenoviren zur Behandlung von Krebserkrankungen und rekombinante Bakterien (Lactococcis lactis) zur immunstimulierten Behandlung von Diabetes mellitus. Eine Übersicht zu allen in der EU beantragten klinische Prüfungen bietet das Register der Europäischen Union.8
Die Zulassung der Anwendung von Arzneimitteln, die aus einem GVO oder einer Kombination von GVO bestehen oder solche enthalten, erfolgt über ein zentralisiertes Verfahren durch die Europäische Kommission gemäß der Verordnung 726/2004/EG. Die Antragstellung erfolgt bei der Europäischen Arzneimittelbehörde (EMA), die im Rahmen ihrer Aufgabe Leitfäden für die Bewertung erstellt und die wissenschaftliche Koordinierung der Verfahren übernimmt. Bei der Umweltverträglichkeitsanalyse werden die gemäß der Richtlinie 2001/18/EG zuständigen Behörden der Mitgliedsstaaten beteiligt, welche in Deutschland das BVL ist. Bei den im Jahr 2023 beantragten Produkten handelt es sich um zwei Veterinärimpfstoffe für Hühner (Vectormune HVT-AIV, Poulvac Procerta HVT-IBD-ND), um umprogrammierte humane hämatopoetische Stamm- und Vorläuferzellen für die Therapie von ß-Thalassämie und Sichelzellanämie (Casgevy), um replikationsdefekte virale Vektoren für die Genersatztherapie bei Hämophilie B (BEQVEZ) beziehungsweise Dystrophe Epidermolysis Bullosa (Vyjuvek) und um einen Impfstoffkandidaten gegen eine Erkrankung durch eine Infektion mit dem Chikungunyavirus (IXCHIQ). Auch hierzu wird der ZKBS regelmäßig berichtet.
2 Zusammensetzung der ZKBS
In der ZKBS kommen Expertinnen und Experten verschiedener Fachgebiete zusammen. Auf diese Weise wird für die im GenTG vorgegebenen Aufgaben der ZKBS, nämlich die Bewertung von Mikroorganismen als Spender- und Empfängerorganismen für gentechnische Arbeiten, die Sicherheitseinstufung gentechnischer Arbeiten, die Bewertung sicherheitstechnischer Maßnahmen gentechnischer Anlagen sowie die Bewertung von Freisetzungen und Inverkehrbringen von GVO, ein breit gefächerter Sachverstand institutionalisiert und zur Verfügung gestellt. In Tabelle 3 ist die Besetzung der ZKBS dargestellt.
Prof. Dr. Dr. Thomas Vahlenkamp ist seit 2022 Vorsitzender der ZKBS. Stellvertretende Vorsitzende sind Prof. Dr. Sigrun Smola und Prof. Dr. Uwe Groß.
Die in 2022 aufgetretenen Verzögerungen bei der Wieder- und Neuberufung von Expertinnen und Experten in die ZKBS setzten sich auch in 2023 fort. In mehreren Schreiben seitens der ZKBS und von betroffenen Fachverbänden und -gesellschaften wurden die an den Berufungsverfahren beteiligten Ressorts (BMEL, BMUV, BMBF, BMG, BMAS, BMWK) auf die resultierende Einschränkung der Arbeitsfähigkeit der Kommission hingewiesen. Die bestehende langanhaltende fehlende Einigkeit bei der Abstimmung der Ressorts führte dann tatsächlich zu einer Einschränkung der Arbeitsfähigkeit der ZKBS. Die eingeschränkte Expertise durch die fehlende Besetzung von Mitgliedern wirkte sich negativ auf die Bearbeitung von Anträgen aus. So wurde die Erstellung von gesetzlich erforderlichen Stellungnahmen mit Sicherheitsempfehlungen insbesondere im Bereich Virologie erschwert. Damit verbunden seien, so wurde vielfach geäußert, Verzögerungen von Genehmigungsverfahren, die auch eine Minderung der Konkurrenzfähigkeit im internationalen Wettbewerb im Bereich der Biotechnologie, einschließlich der Grundlagenforschung, bedeuten.
Im Mai 2023 konnten die Abstimmungsprozesse innerhalb der Bundesregierung erfolgreich abgeschlossen werden, so dass aus dem Jahr 2022 noch ausstehende Wiederberufungen vorgenommen werden konnten und auch Neuberufungen erfolgten. Nach Abschluss der Berufungsverfahren waren alle Bereiche besetzt.
Die Verzögerungen der Wiederberufungen machten auch eine Neuwahl der stellvertretenden Vorsitzenden Frau Prof. Dr. Sigrun Smola erforderlich, da in der Zwischenzeit ihr Berufungszeitraum abgelaufen war. Nach der Wiederberufung wurde sie in diesem Amt bestätigt.
Die in Tabelle 3 dargestellte Zusammensetzung der ZKBS entspricht dem GenTG in der aktuell gültigen Fassung. Die neuberufenen Mitglieder sind mit einem Sternchen* versehen.
Tabelle 3: Fachgebiete und Mitglieder der ZKBS (Stand: Dezember 2023)
| Fachgebiet | Mitglied | stellvertretendes Mitglied |
| Sachverständige nach § 4 Absatz 1 Nummer 1 GenTG | ||
| Mikrobiologie | Prof. Dr. Petra Dersch Universität Münster |
Prof. Dr. Susanne Hartmann Freie Universität Berlin |
| Zellbiologie | Prof. Dr. Michael Meisterernst Universität Münster |
Prof. Dr. Ingo Drexler* Universität Düsseldorf |
| Virologie | Prof. Dr. Dr. Thomas W. Vahlenkamp Universität Leipzig |
Prof. Dr. Edgar Maiß Universität Hannover |
| Virologie | Prof. Dr. Sigrun Smola Universität des Saarlandes |
Prof. Dr. Stefan Pöhlmann Deutsches Primatenzentrum GmbH, Göttingen Prof. Dr. Anja Ehrhardt |
| Genetik | Prof. Dr. Jürgen Wienands Universität Göttingen |
Prof. Dr. Jens Boch Universität Hannover |
| Genetik | Prof. Dr. Uwe Sonnewald Universität Erlangen-Nürnberg |
Prof. Dr. Uwe Völker Universität Greifswald |
| Hygiene | Prof. Dr. Uwe Groß Universität Göttingen |
Prof. Dr. Werner Solbach Universität zu Lübeck |
| Ökologie | Prof. Dr. Michael Pester Deutsche Sammlung von Mikroorganismen und Zellkulturen, Braunschweig |
Prof. Dr. Elke Genersch* Freie Universität Berlin |
| Ökologie | Prof. Dr. Rainer Waldhardt Universität Gießen |
Prof. Dr. Martin Hasselmann Universität Hohenheim |
| Pflanzenzucht | Prof. Dr. Karl Schmid Universität Hohenheim |
Prof. Dr. Maria v. Korff-Schmising Universität Düsseldorf |
| Sicherheitstechnik | Dr. Sven Deutschmann Roche-Diagnostics GmbH, Penzberg |
Dr. Holger Lübben GlaxoSmithKline, Marburg |
| Toxikologie | Prof. Dr. Edmund Maser Universität zu Kiel |
Prof. Dr. Angela Mally* Universität Würzburg |
| Sachkundige nach § 4 Absatz 1 Nummer 2 GenTG | ||
| Arbeitsschutz | Frank Gerschke Landesamt für Arbeitsschutz Potsdam |
Dr. Daniela Harkensee Berufsgenossenschaft Rohstoffe und chemische Industrie, Hamburg |
| Gewerkschaften | Prof. Dr. Dr. h. c. Wilfried Wackernagel Universität Oldenburg |
Dr. Brigitte Dreiseikelmann Universität Bielefeld |
| Landwirtschaft | Prof. Dr. Joseph-Alexander Verreet Universität zu Kiel |
Prof. Dr. Ulrich Schurr Universität Düsseldorf |
| Naturschutz | Dr. Elisabeth Bücking* BioTechPark Freiburg |
Dr. Katja Heubach* Palmen- und Botanischer Garten, Frankfurt |
| Forschungsfördernde Organisationen |
Dr. Ingrid Ohlert Deutsche Forschungsgemeinschaft, Bonn |
Dr. Jan-Wolfhard Kellmann Universität Marburg |
| Umweltschutz | Prof. Dr. Katja Tielbörger* Universität Tübingen |
N. N. |
| Verbraucherschutz | Sigrid Lewe-Esch Deutscher Evangelischer Frauenbund e. V., Duisburg |
Annette Neuhaus Detmold |
| Wirtschaft | Dr. Thorsten Lamla* Boehringer Ingelheim Pharma GmbH & Co. KG, Biberach |
Dr. Anja Matzk KWS SAAT SE & Co. KGaA |
- *
- in 2023 neuberufene Mitglieder
3 Beratungstätigkeit der ZKBS im Jahre 2023
3.1 Arbeitsweise
Die Arbeitsweise der ZKBS ist in ihrer Geschäftsordnung geregelt.
Im Jahr 2023 wurden fünf ordentliche Sitzungen in Form von Videokonferenzen durchgeführt. Zwei Sitzungen erfolgten in Präsenz am BVL, wobei eine digitale Zuschaltung möglich war. Regelmäßig begrüßte der Präsident des BVL, Friedel Cramer, die Expertinnen und Experten der Kommission. Er würdigte die ehrenamtlich zu erfüllende Aufgabe, Fragen, die die Sicherheit von Mensch, Tier und Umwelt in ihrem Gefüge bei der Herstellung und im Umgang mit GVO betreffen, zu beantworten und Stellungnahmen in Anmelde- und Genehmigungsverfahren unverzüglich zur Verfügung zu stellen.
Der überwiegende Teil der ZKBS-Stellungnahmen wurde im Rahmen der Sitzungen verabschiedet. Daneben wurden aber auch Entscheidungen im schriftlichen Verfahren getroffen, wenn einfachere Fragestellungen vorlagen, die keine ausführliche Diskussion zwischen allen Mitgliedern erforderten.
3.2 Festveranstaltung anlässlich der 250. ordentlichen Sitzung der ZKBS
Am 5. September 2023 fand die 250. ordentliche Sitzung der ZKBS seit Inkrafttreten des GenTG statt. Anlässlich des Jubiläums wurden am 4. September 2023 Vertretende von Bundesministerien, Bundesoberbehörden, zuständigen Behörden der Länder und Fachverbände zu einer Festveranstaltung im silent green Kulturquartier in Berlin begrüßt.
Eröffnet wurde die Veranstaltung vom Präsidenten des BVL, Friedel Cramer. Die Staatssekretärin des BMEL, Silvia Bender, würdigte in ihrem Grußwort die Arbeit der ZKBS. Sie wies auf das Anliegen des BMEL hin, die gesetzlich vorgeschrieben Bereiche innerhalb der ZKBS vollständig und möglichst paritätisch besetzen zu wollen. Mit Blick auf den von der Europäischen Kommission vorgelegten Vorschlag zur Neuregulierung bestimmter genomeditierter Pflanzen betonte sie, dass auch zukünftig in Deutschland die ökologische Landwirtschaft möglich sein muss. Hierfür seien Regeln der Koexistenz notwendig und eine Transparenz, die eine Wahlfreiheit für die Verbraucher zulässt.
Moderiert vom Vorsitzenden der ZKBS, Prof. Dr. Dr. Thomas Vahlenkamp, und der stellv. Vorsitzenden, Prof. Dr. Sigrun Smola, wurde zunächst verdienten ZKBS-Mitgliedern für ihr engagiertes Ehrenamt gedankt, bevor in zwei Abschnitten Vorträge zu den Themenblöcken „The Regulation of Genetic Engineering“ und „The Science of Genetic Engineering“ von ZKBS-Mitgliedern, eingeladenen Wissenschaftlerinnen und Wissenschaftlern, aber auch einer Vertreterin der Europäischen Kommission, Ilaria Ciabatta, präsentiert wurden.
Am Rande der Festveranstaltung wurde der Vorsitzende der ZKBS vom Tagesspiegel interviewt. Neben Fragen zur Historie der ZKBS und zu Meilensteinen der Sicherheitsbewertung in der Gentechnik wurden auch die politische Unabhängigkeit der ZKBS angesprochen und die in 2023 bekannt gewordenen Verzögerungen bei der Berufung wegen der fehlenden Einigkeit der hieran beteiligten Ressorts. Herr Prof. Dr. Dr. Thomas Vahlenkamp stellte heraus, dass das Expertenteam ehrenamtlich arbeite und seine Stellungnahmen ausschließlich anhand von wissenschaftlichen Daten erstelle. Um eine kontinuierliche Arbeitsweise sicherzustellen, müsse die politische Unabhängigkeit gegeben sein.
3.3 Arbeitskreise
Auch im Jahr 2023 wurde der Arbeitskreis „Synthetische Biologie“ unter der Leitung von Dr. Jan Kellmann weitergeführt, um sicherheitsrelevante Aspekte neuer Entwicklungen der Synthetischen Biologie zu identifizieren und einzuordnen. Der Arbeitskreis orientierte sich dabei an den Schutzzielen des GenTG (§ 1 Satz 1). Kontinuierlich wurden Publikationen hinsichtlich neuester Entwicklungen gesichtet und auf ein Erfordernis für eine Anpassung gentechnik- oder anderer rechtlicher Regularien überprüft. Die Ergebnisse des kontinuierlichen Monitorings werden regelmäßig auf der Homepage der ZKBS zur Verfügung gestellt.9
Seit einigen Jahren werden auch im Rahmen des Abkommens über die Biologische Vielfalt (Convention on Biological Diversity, CBD) von den beteiligten Vertragsstaaten die Entwicklungen der Synthetischen Biologie beobachtet und Informationen gesammelt, um gegebenenfalls Regulierungsempfehlungen zu formulieren. Regelmäßig bittet das Sekretariat der CBD fachlich einschlägige Organisationen, Vorschläge für Expertinnen und Experten zu unterbreiten, die sich beispielsweise an Online-Foren beteiligen oder in einer Ad hoc technical expert group (AHTEG) mitarbeiten. Für das Online-Forum in 2023 wurden Prof. Dr. Uwe. Sonnewald und Dr. Jan Kellmann nominiert.
Zudem wurde vom Sekretariat der CBD dazu aufgerufen, von der AHTEG identifizierte Trends zu kommentieren und dabei auf potenzielle positive und negative Auswirkungen auf die Ziele der CBD einzugehen beziehungsweise Regulierungslücken aufzuzeigen. Ein vom Arbeitskreis vorgeschlagener und von der ZKBS abgestimmter Beitrag an die CBD wies darauf hin, dass die Interpretation des Begriffes Synthetische Biologie von der ZKBS wissenschaftlich enger interpretiert wird und somit einige von der AHTEG aufgezeigte Trends wie zum Beispiel die Anwendung neuer genomischer Techniken nicht darunterfallen. In diesem Zusammenhang wurde auf das seit 2010 laufende kontinuierliche Monitoring der ZKBS hingewiesen und dessen Schlussfolgerung, dass bislang keine regulatorischen Lücken erkennbar sind.
Auch der Arbeitskreis „Neue genomische Techniken“ unter Leitung von Herrn Prof. Dr. J. Boch tagte in 2023 regelmäßig, um sich mit dem Entwurf der EU-Kommission zu befassen, der die Neuregulierung von genomeditierten Pflanzen und deren Produkte thematisiert. Auf Bitte des BMEL wurde eine Stellungnahme mit einer wissenschaftlichen Bewertung des Vorschlags der EU-Kommission für eine Abstimmung im Gremium vorbereitet, die mit individuell formulierten Minderheitsvoten zweier Mitglieder der ZKBS verabschiedet worden ist. Sowohl die Stellungnahme als auch die Minderheitsvoten wurden dem BMEL zur Verfügung gestellt und auf der Homepage der ZKBS unter der Rubrik „Kommentare“ veröffentlicht.10
Mit einem in 2023 vorgelegten Antrag auf Genehmigung der Errichtung einer weiteren gentechnischen Anlage der Sicherheitsstufe 4 wurde der Arbeitskreis „Sicherheitstechnik“ innerhalb der ZKBS wieder einberufen. Unter Leitung von Dr. Sven Deutschmann wurde sich über die beantragten sicherheitstechnischen Maßnahmen ausgetauscht, deren Ergebnisse in einer Stellungnahme der ZKBS an die anfragende Behörde zusammengefasst worden sind. Zudem wurden Nachfragen hierzu in einem Amtshilfeschreiben beantwortet.
3.4 Beratung der Bundesregierung, der zuständigen Landesbehörden und des BVL
Neben der Bitte des BMEL um eine wissenschaftliche Bewertung des Vorschlags der EU-Kommission zur Neuregulierung genomeditierter Pflanzen wurden folgende Anfragen der zuständigen Landesbehörden von der ZKBS diskutiert und bewertet:
- –
-
Prüfung des Abluftfilters der raumlufttechnischen Anlage einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 6790-01-1658
- –
-
Überprüfung der Risikobewertung gentechnischer Arbeiten mit SARS-CoV-2, Az. 45110.1985
- –
-
Beratung hinsichtlich erforderlicher Sicherheitsmaßnahmen für den Betrieb von Geräten in einer gentechnischen Anlage der Sicherheitsstufe 2, Az. 45110.2229
- –
-
Amtshilfe im Genehmigungsverfahren zur Errichtung einer gentechnischen Anlage der Sicherheitsstufe 4, Nachfragen zum Brandschutzkonzept und zur Abluftbehandlung von Durchreicheautoklaven, Az. 45110.2238
- –
-
Beratung zur Zulässigkeit der Nutzung älterer Sicherheitswerkbänke für virologische S2-Arbeiten, Az. 45220
- –
-
Beratung zur Eignung eines Gittergewächshauses für gentechnische Arbeiten der Sicherheitsstufe 1, Az. 45220
- –
-
Amtshilfe zur Bewertung rekombinanter Baculoviren mit Latrotoxin-Genen, Az. 45220
- –
-
Amtshilfe zur Bewertung von Mäusen 21 Tage nach Prime-Boost-Immunisierung mit rekombinanten Masernimpfvektoren, Az. 45310.0115
3.5 Risikobewertung von Spender- und Empfängerorganismen
Im Jahr 2023 wurden insgesamt 64 Mikroorganismen, die bei gentechnischen Arbeiten als Spender- oder Empfängerorganismen verwendet werden, gemäß § 5 in Verbindung mit Anlage I GenTSV einer Risikogruppe zugeordnet oder deren Einstufung überprüft. Darunter waren 15 Viren, 33 Bakterien oder Archaea und 16 eukaryote Mikroorganismen. Bei folgenden Mikroorganismen wurde eine Risikobewertung durchgeführt:
Tabelle 4: Neu eingestufte Mikroorganismen, Stand 31. Dezember 2023
| Organismus | Risikogruppe | Aktenzeichen | Verfahren |
|---|---|---|---|
| Bakterien | |||
| Agathobacter rectalis | 1 | 45110.2223 | S |
| Alteromonas alba | 1 | 45241.0260 | E |
| Arcobacter butzleri | 2 | 45241.0254 | S |
| Brucella sp. aus einem Blaupunktrochen | 2 | 45241.0242 | S |
| Brucella sp. aus einem Pantherchamäleon | 2 | 45241.0242 | S |
| Colidextribacter massiliensis | 1 | 45241.0249 | E |
| Collinsella aerofaciens | 2 | 45110.2223 | S |
| Coprococcus comes | 1 | 45110.2223 | S |
| Corynebacterium accolens | 2 | 45241.0252 | S |
| Corynebacterium propinquum | 2 | 45241.0252 | S |
| Corynebacterium tuberculostearicum | 2 | 45241.0252 | S |
| Enterocloster bolteae | 2 | 45110.2223 | S |
| Lacrimispora saccharolytica | 1 | 45110.2223 | S |
| Lactobacillus johnsonii | 1 | 45241.0249 | E |
| Leuconostoc mesenteroides ssp. mesenteroides | 2 | 45241.0251 | S |
| Parabacteroides merdae | 2 | 45110.2223 | S |
| Paraburkholderia agricolaris | 1 | 45241.0253 | E |
| Paraburkholderia bonniea | 1 | 45241.0253 | E |
| Paraburkholderia hayleyella | 1 | 45241.0253 | E |
| Phocaeicola vulgatus | 2 | 45110.2223 | S |
| Providencia burhodogranariea | 1 | 45243.0131 | S |
| Providencia sneebia | 1 | 45243.0131 | S |
| Providencia thailandensis | 1 | 45243.0131 | S |
| Providencia vermicola | 2 | 45243.0131 | S |
| Pseudomonas alloputida | 2 | 6790-05-01-099 | S |
| Ralstonia pickettii | 2 | 45241.0251 | S |
| Roseburia intestinalis | 1 | 45110.2223 | S |
| Ruminococcus gnavus | 2 | 45110.2223 | S |
| Salmonella enterica ssp. enterica Serovar Abortusequi | 2 | 45241.0256 | S |
| Staphylococcus capitis | 2 | 45241.0256 | S |
| Staphylococcus caprae | 2 | 45241.0256 | S |
| Staphylococcus hominis | 2 | 45241.0256 | S |
| Streptococcus parasanguinis | 2 | 45110.2223 | S |
| Eukaryote Einzeller | |||
| Akanthomyces dipterigenus | 1 | 45243.0131 | E |
| Akanthomyces muscariae | 1 | 45243.0131 | E |
| Aspergillus pseudoterreus | 2 | 45243.0127 | S |
| Clavispora lusitaniae | 2 | 45243.0128 | S |
| Cutaneotrichosporon oleaginosum | 1 | 45243.0129 | E |
| Diaporthe eres | 1 | 45243.0126 | E |
| Diplodia bulgarica | 1 | 45243.0126 | E |
| Eutypa lata | 1 | 45243.0126 | E |
| Guillardia theta | 1 | 45247.0011 | E |
| Hymenopleella hippophaeicola | 1 | 45243.0126 | E |
| Ilyonectria robusta | 1 | 45243.0126 | E |
| Lodderomyces elongisporus | 2 | 45243.0128 | S |
| Monilinia fructigena | 1 | 45243.0126 | E |
| Monilinia laxa | 1 | 45243.0126 | E |
| Verticillium albo-atrum | 1 | 45243.0126 | E |
| Verticillium dahliae | 1 | 45243.0126 | E |
| Viren | |||
| Chikungunya virus Δ5nsP3 | 1 | 45110.2123 | S |
| Dianlovirus menglaense | 4 | 45242.0211 | S |
| Domestic cat hepatitis B virus | 3** | 45110.0228 | S |
| Human mastadenovirus C, Impfstamm ONRAB | 2 | 45110.2247 | S |
| Phlebovirus bogoriaense | 2 | 45242.0210 | S |
| Phlebovirus embossosense | 2 | 45242.0210 | S |
| Phlebovirus kiborgochense | 2 | 45242.0210 | S |
| Phlebovirus ntepesense | 2 | 45242.0210 | S |
| Phlebovirus perkerraense | 2 | 45242.0210 | S |
| Respirovirus bovis | 2 | 45242.0212 | S |
| Ringtail hepatitis B virus (RtHBV) | 3** | 45110.2228 | S |
| Striavirus antennarii | 2 | 45242.0211 | S |
| Thamnovirus thamnaconi | 2 | 45242.0211 | S |
| Thicket rat hepatitis B virus (TRHBV) | 3** | 45110.2228 | S |
| White bream virus | 2 | 45110.2246 | S |
S: Sitzung
E: Einfaches Verfahren per E-Mail
Die Zuordnungen zu Risikogruppen sind in der Organismendatenbank der ZKBS zu finden.11 Allgemeine Stellungnahmen zur Risikobewertung von Organismen werden auf der Homepage der ZKBS veröffentlicht.12
3.6 Sicherheitseinstufung gentechnischer Arbeiten und Bewertung sicherheitstechnischer Maßnahmen von gentechnischen Anlagen
Im Jahr 2023 hat die ZKBS 50 Stellungnahmen zur Sicherheitseinstufung gentechnischer Arbeiten und/oder zu erforderlichen Sicherheitsmaßnahmen abgegeben. Die bewerteten gentechnischen Arbeiten und Anlagen betrafen die in der folgenden Auflistung zusammengestellten Themen. Bei vielen gentechnischen Arbeiten, die bewertet wurden, erfolgte für die Sicherheitsmaßnahmen lediglich ein Hinweis auf die GenTSV. Bei einigen hingegen erfolgte eine detaillierte Bewertung der in der gentechnischen Anlage vorliegenden beziehungsweise vorgesehenen technischen und organisatorischen Sicherheitsmaßnahmen.
Sicherheitsbewertete gentechnische Arbeiten und Anlagen im Jahr 2023. Die Titel der gentechnischen Arbeiten wurden aus den eingereichten Antragsunterlagen übernommen.
Sicherheitsstufe 2 (23)
- –
-
Vermehrung von gentechnisch veränderten Stämmen des afrikanischen Schweinepest-Virus (ASFV) auf permanenten Zelllinien, Az. 45110.2127_1. Aktualisierung
- –
-
Adenovirale Onkolyse mit mutierten humanen Adenoviren – 1. Erweiterung: Onkolytische Adenoviren: Expression von Dinukleotid Synthasen und/oder Gasderminen und syngene Maus-Tumormodelle, Az. 45110.2196_1. Erweiterung
- –
-
Untersuchung mikrobieller Interaktionen und Medikamentenwirksamkeit mittels genetischer Methoden in gastrointestinalen Clostridienstämmen, Az. 45110.2223
- –
-
Bestimmung des Differenzierungs-, Aktivierungs- und apoptotischen Potenzials ausgesuchter zellulärer und viraler Signalmoleküle und Transkriptionsfaktoren durch retro- und adenoviralen Gentransfer in primäre, murine und humane Zellen und etablierte Zelllinien, diverse FLUAV-Anträge, Az. 45110.2227, 45110.1808, 45110.1971, 45110.1972, 45110.1993, 45110.1994
- –
-
Studie an nicht-menschlichen Primaten (Macaca fascicularis) zur Bewertung der Toxizität und Bioverteilung von rekombinanten Lymphozytären Choriomeningitis Virus (LCMV), Az. 45110.2229
- –
-
Herstellung von replikationsdefizienten Sendai-Virus/SARS-CoV-2-Chimären unter Verwendung eines replikationskompetenten Sendai Virus als Helfervirus, Az. 45110.2230
- –
-
Gezielte Manipulation mitochondrialer DNA zwecks Generierung von Krankheitsmodellen zur Untersuchung maternal vererbter Krankheiten, Az. 45110.2231
- –
-
Klonierung von HBV-Wildtyp und HBV-Deletions-Überlängenkonstrukten und anschließende in vitro-Transfektion/Infektion von immortalisierten Zelllinien der Risikogruppen S1, Az. 45110.2232
- –
-
Generierung, Charakterisierung und Herstellung der VSV-GP Varianten VSV-GP-huGSDMD, VSV-GP-huGSDME, VSV-GP-huGSDMD-DEVD, VS-VGP-GSDMD-DEVD-hull 18wt, VSV-GP-GSDME-hull 12_p40p35, VSV-GP-hull 12_p40p35 und VSV-GP-hull 18wt in HEK293 Zellen inklusive zugehöriger Analytik, Az. 45110.2234
- –
-
Verwendung attenuierter, replikationskompetenter LCMV und PICV Vektoren (artLCMV und artPICV) als therapeutischer Ansatz zur Behandlung solider Tumoren in Mäusen, Az. 45110.2235
- –
-
Herstellung und Charakterisierung replikationskompetenter chimärer Sendai Virus (SeV) Vektoren, welche nur das S-Protein von SARS-CoV-2 auf der Oberfläche tragen, Az. 45110.2237
- –
-
Entwicklung einer Vektorplattform basierend auf einem Nelson Bay Virus (NBV), Az. 45110.2240
- –
-
Onkolytische Virustherapie im gastrointestinalen Tumormodell: Untersuchung der Virus-induzierten Modulation des Tumormikromilieus und Etablierung neuer Kombinationstherapien, Az. 45110.2242
- –
-
Onkolytische Masernviren zur therapeutischen Polyneoepitop-Vakzinierung in soliden Tumoren, Az. 45110.2244
- –
-
Herstellung rekombinanter Rotaviren durch Transfektion von Plasmiden, Az. 45110.2245
- –
-
Strukturelle und funktionelle Charakterisierung sämtlicher Proteine und RNAs von repräsentativen Nidoviren der Risikogruppe 2, Az. 45110.2246
- –
-
Charakterisierung eines adenoviralen Tollwut-Vektorimpfstoffes, Az. 45110.2247
- –
-
Replikationskompetenz von Felinen lmmundefizienzvirus (FIV)-HIV chimären Viren in Tumorzellen, Az. 45110.2252
Sicherheitsstufe 3 (25)
- –
-
Wesentliche Änderung einer gentechnischen Anlage der Sicherheitsstufe 3 – Umbau der Thermischen Abwasserinaktivierungsanlage (TAI), Az. 6790-01-1573
- –
-
Herstellung und Charakterisierung gentechnisch veränderter Mutanten in M. tuberculosis, M. africanum undM. bovis, die in ihren Pathogenitäts-, Virulenz- und Viabilitätseigenschaften verändert wurden, Az. 45110.1865_7. Erweiterung
- –
-
Therapie der HIV-1 Infektion durch neutralisierende Antikörper – Rolle einer zusätzlichen NF-κB-Bindestelle für die HIV-1-Übertragung, Az. 45110.1899_4. Erweiterung
- –
-
Identifizierung von latent HIV-1 infizierten T-Zellen, Az. 45110.1935_3. Erweiterung
- –
-
Untersuchungen zur bakteriellen Pathogenese und Antibiotikaentwicklung bei Mycobacterium tuberculosis – 1. Erweiterung, Az. 45110.1947_1. Erweiterung
- –
-
Modifizierte rekombinante Viren des Macacine alphaherpesvirus 1 (Herpes B Virus) mit Deletionen oder konditionaler Replikation und deren Analyse in rekombinanten Zelllinien (Ergänzung), Az. 45110.1984
- –
-
Wesentliche Änderung einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 45110.2024
- –
-
Chikungunyavirus (CHIKV) Replikons zur in vitro und in vivo Expression von Alphavirus Genprodukten (S3), Az. 45110.2072_Aktualisierung
- –
-
Herstellung von und Infektion mit HIV mit veränderter Glykosylierung, Az. 45110.2116_1. Erweiterung
- –
-
Herstellung rekombinanter Coronaviren mithilfe des Hefe Systems und Untersuchung von Viren in Zellkultur, Az. 45110.2155_1. Erweiterung
- –
-
Tetrazyklin-abhängige Expressionskontrolle von essentiellen Genen zur Wirkstoffvalidierung gegen Mycobacterium tuberculosis, Az. 45110.2197_1. Erweiterung
- –
-
Charakterisierung der Erreger-Wirt-Interaktionen von einem mausadaptierten SARS-CoV-2 Isolat, Az. 45110.2198_1. Erweiterung
- –
-
Untersuchungen zu der Wechselwirkung von ethA und dem ESX-1 Sekretionssystem von Mycobacterium tuberculosis und dem Wirkmechanismus der anti-virulenten Substanz S3, Az. 45110.2221
- –
-
Wesentliche Änderung einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 45110.2222
- –
-
Errichtung und Betrieb einer gentechnischen Anlage der Sicherheitsstufe 3, Az. 45110.2226
- –
-
Revers-genetische Analyse von porcinen, aviären und humanen Influenzaviren vom Typ H1, H5 und H7, Az. 45110.2227
- –
-
Klonierung, Expression und Analyse von neu entdeckten hepadnaviralen Isolaten aus Akazienmäusen, Katzenfretten und Katzen, Az. 45110.2228
- –
-
Analyse des SARS-CoV-2 ORF3d Proteins, Az. 45110.2233
- –
-
SARS-CoV-2 BAC System: Klonierung, Produktion und Infektion rekombinanter SARS-CoV-2 Stämme, Az. 45110.2236
- –
-
Analyse der HIV-Interaktionen mit Wirtszellen, Az. 45110.2239
- –
-
Untersuchungen zur Alphavirus-Infektion von Hautexplantaten durch Mücken, Az. 45110.2241
- –
-
Erstellen eines Bacterial Artificial Chromosome (BAC) des Monkeypoxvirus (MPXV) Genoms aus den Isolaten I, IIa und IIb zur Untersuchung von verschiedenen Genen und deren Einfluss auf die Pathogenese, Az. 45110.2243
- –
-
Arbeiten mit verschiedenen Frühsommer-Meningoenzephalitis-Viren (FSMEV, engl. Tick-borne encephalitis virus, TBEV), Az. 45110.2249
- –
-
Rolle von CHD1L bei der HIV Replikation, Az. 45110.2250
- –
-
Mykobakterielle fluoreszierende Reporterstämme: Werkzeuge für die Entdeckung von Arzneimitteln und die Untersuchung von Wirt-Pathogen-Interaktionen, Az. 45110.2251
Sicherheitsstufe 4 (2)
- –
-
Vermehrung von rekombinanten (-)ssRNA ZsGreen-Reporter-Viren und revers-genetisch isolierten Wildtypstämmen in vitro unter S4-Bedingungen und Untersuchung der Dissemination von ZsG-Reporterviren in natürlichen Reservoirtieren und Tiermodellen, sowie deren Zellen, Az. 45110.2117_1. Erweiterung
- –
-
Antrag auf Genehmigung zur Errichtung einer gentechnischen Anlage der Sicherheitsstufe 4 gemäß § 8 Absatz 3 Nummer 1 GenTG, Az. 45110.2238
Zusammenfassend ist in Abbildung 3 die Anzahl der im Jahr 2023 abgegebenen Stellungnahmen der ZKBS im Vergleich zu der Anzahl der in den vergangenen vier Jahren abgegebenen Stellungnahmen grafisch dargestellt. Insgesamt sticht der im Vergleich zu anderen Jahren in 2020 deutlich vermehrte Bedarf an Stellungnahmen zu gentechnischen Arbeiten der Sicherheitsstufe 3 hervor. Dies ist auf die pandemiebedingte und seitens des Bundes geförderte Ausrichtung von Forschungsansätzen auf Coronaviren zurückzuführen und erforderte die Einberufung von außerordentlichen Sitzungen der ZKBS. Die Gesamtzahl der in 2023 der ZKBS vorgelegten Anträge entspricht der der Pandemie-Vor- und -Folgejahre. Auch der Fokus der eingereichten Anträge zur Durchführung gentechnischer Arbeiten der Sicherheitsstufe 3 deckt wieder mehr das gesamte Spektrum der virologischen und bakteriologischen Forschung ab. Der Trend zu Anträgen auf wesentliche Änderungen gentechnischer Anlagen der Sicherheitsstufe 3, um dem geforderten Stand von Wissenschaft und Technik zu entsprechen, setzte sich auch in 2023 fort.
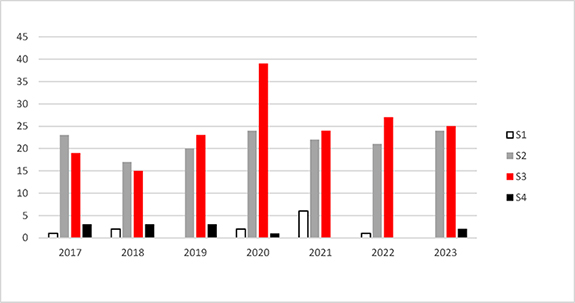
Abbildung 3: Die Abbildung zeigt die jeweilige Anzahl der von der ZKBS in den vergangenen Jahren verabschiedeten Stellungnahmen zu gentechnischen Arbeiten in gentechnischen Anlagen, differenziert nach den Sicherheitsstufen 1 bis 4 (S1 bis S4).
3.7 Allgemeine Stellungnahmen und Berichte
Die ZKBS hat im Jahr 2023 folgende allgemeine Stellungnahmen überabeitet:
- –
-
Aktualisierung der Stellungnahme der ZKBS zur Eignung von Pseudomonas alloputida KT2440 als Teil biologischer Sicherheitsmaßnahmen gemäß § 8 Absatz 1 GenTSV, Az. 45270_c
- –
-
Aktualisierung der Stellungnahme der ZKBS zur Risikobewertung von gentechnischen Arbeiten zur Expression von Prion-Proteinen, Az. 6790-10-75
- –
-
Aktualisierung der Stellungnahme der ZKBS zu Hände- und Flächendesinfektionsmaßnahmen bei gentechnischen Arbeiten mit Viren bis Sicherheitsstufe 4, Az. 6790-10-49, November 2023
Alle allgemeinen Stellungnahmen finden sich auf der Internetseite der ZKBS.13
3.8 Außerkraftsetzung von Stellungnahmen
Regelmäßig überprüft die ZKBS ihre Stellungnahmen auf Aktualität. In 2023 wurden keine Stellungnahmen außer Kraft gesetzt.
3.9 Stellungnahmen zu Freisetzungen
Stellungnahmen zu Freisetzungsanträgen von GVO wurden im Berichtszeitraum von der ZKBS nicht abgegeben.
3.10 Stellungnahmen zu Inverkehrbringen
Stellungnahmen zu Anträgen auf Inverkehrbringen von GVO wurden im Berichtszeitraum von der ZKBS nicht abgegeben.
3.11 Berichte über Themen von allgemeiner Bedeutung
Mithilfe der eigenen Homepage (https://www.zkbs-online.de) möchte die ZKBS auch die Möglichkeit nutzen, der Öffentlichkeit in geeigneter Weise über Themen von allgemeiner Bedeutung, wie die Entwicklungen im Bereich der Synthetischen Biologie, zu berichten. Im Jahr 2021 erschien die Homepage in einem neuen Design und mit einer neuen Struktur. In 2023 wurde ein Erklärvideo eingestellt, in dem die Herstellung eines rekombinanten Impfstoffes am Beispiel der Hepatitis-B-Impfung für die interessierte Öffentlichkeit erläutert wird.
Am 10. März 2023 richtete die niederländische Kommission für die Biologische Sicherheit COGEM das 10. Treffen der nationalen Expertenkomitees für die Biologische Sicherheit Europas aus. An dem Symposium in Amsterdam nahmen Herr Prof. Dr. Dr. W. Wackernagel und Vertretende der Geschäftsstelle teil.
- 1
- https://food.ec.europa.eu/plants/genetically-modified-organisms/reports-and-studies_en#implementation_of_legisla
- 2
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_B_Plants.php
- 3
- https://www.bafu.admin.ch/bafu/de/home/themen/biotechnologie/fachinformationen/freisetzungsversuche/freisetzungsversuche-mit-gentechnisch-veraenderten-organismen–g.html
- 4
- https://www.gov.uk/government/collections/genetically-modified-organisms-applications-and-consents
- 5
- https://www.bvl.bund.de/DE/Arbeitsbereiche/06_Gentechnik/02_Verbraucher/03_Genehmigungen/01_Inverkehrbringen/gentechnik_GenehmigungenInverkehrbringen_node.html
- 6
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_C.php
beziehungsweise https://webgate.ec.europa.eu/dyna/gm_register/index_en.cfm - 7
- https://food.ec.europa.eu/plants/genetically-modified-organisms/new-techniques-biotechnology_en
- 8
- https://webgate.ec.europa.eu/fip/GMO_Registers/GMO_Part_B_Others.php
- 9
- https://www.zkbs-online.de/ZKBS/DE/SynthetischeBiologie/SynthetischeBiologie_node.html
- 10
- https://www.zkbs-online.de/ZKBS/DE/Kommentare/03_Kommissionsentwurf%20Neuregulierung%20NGT/
Kommissionsentwurf%20Neuregulierung%20NGT_basepage.html;jsessionid=737C18033B9B8AC9AFDB5A2E62AF5D55.internet012 - 11
- https://zag.bvl.bund.de/organismen/index.jsf
- 12
- https://www.zkbs-online.de/ZKBS/DE/Stellungnahmen/stellungnahmen_node.html
- 13
- https://www.zkbs-online.de/ZKBS/DE/Stellungnahmen/stellungnahmen_node.html











Kommentar hinterlassen