Bundesministerium
für Umwelt, Naturschutz, nukleare Sicherheit
und Verbraucherschutz
Bekanntmachung
der wissenschaftlichen Bewertung
des Bundesamtes für Strahlenschutz
gemäß § 84 Absatz 3 des Strahlenschutzgesetzes:
Brustkrebsfrüherkennung mittels Röntgenmammographie
bei Frauen unter 50 Jahren
Nachstehend wird die wissenschaftliche Bewertung des Bundesamtes für Strahlenschutz gemäß § 84 Absatz 3 des Strahlenschutzgesetzes (StrlSchG) zur Brustkrebsfrüherkennung mittels Röntgenmammographie bei Frauen unter 50 Jahren bekannt gemacht.
Bonn, den 24. Januar 2024
Bundesministerium
für Umwelt, Naturschutz, nukleare Sicherheit
und Verbraucherschutz
Im Auftrag
Dr. Keller
Bericht
Brustkrebsfrüherkennung mittels Röntgenmammographie
bei Frauen unter 50 Jahren
Wissenschaftliche Bewertung des Bundesamtes für Strahlenschutz
gemäß § 84 Absatz 3 StrlSchG
Der vorliegende wissenschaftliche Bericht des Bundesamtes für Strahlenschutz (BfS) zur Früherkennung von Brustkrebs mittels Röntgenmammographie bei Frauen unter 50 Jahren wurde gemäß § 84 Absatz 3 StrlSchG in Verbindung mit der Allgemeinen Verwaltungsvorschrift zur wissenschaftlichen Bewertung von Früherkennungsuntersuchungen zur Ermittlung nicht übertragbarer Krankheiten (StrlSchGVwV-Früherkennung) erarbeitet. Dabei wurde das BfS gemäß StrlSchGVwV-Früherkennung Nummer 4 von einer Sachverständigengruppe beraten. Diese interdisziplinär besetzte Gruppe unabhängiger Sachverständiger hat unter dem Vorsitz des BfS zweimal getagt, alle relevanten Aspekte diskutiert und den Empfehlungen des BfS im Konsens zugestimmt. Abschließend wurden die im Rahmen eines Konsultationsverfahrens übermittelten Stellungnahmen einschlägiger Fachkreise geprüft und soweit möglich berücksichtigt.
Die Mitglieder dieser Sachverständigengruppe waren (in alphabetischer Reihenfolge):
| Prof. Dr. Ute-Susann Albert | Universitätsklinikum Würzburg |
| Prof. Dr. Stefan Delorme | Deutsches Krebsforschungszentrum |
| Prof. Dr. Nadia Harbeck | LMU Klinikum München |
| Prof. Dr. Sylvia H. Heywang-Köbrunner | Referenzzentrum Mammographie München |
| Dr. Vanessa Kääb-Sanyal | Bundesverband Deutscher Pathologen e. V. |
| Dr. Norbert Loskamp | Verband der privaten Krankenversicherung e. V. |
| Prof. Dr. Stefan Sauerland | Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen |
| Dipl.-Ing. Stephan Schopphoven | Referenzzentrum Mammographie SüdWest |
| Prof. Dr. Stefanie Weigel | Universitätsklinikum Münster Referenzzentrum Mammographie Münster |
| Prof. Dr. Evelyn Wenkel | Universitätsklinikum Erlangen |
| Prof. Dr. Hajo Zeeb | Leibniz-Institut für Präventionsforschung und Epidemiologie – BIPS |
| Der Gemeinsame Bundesausschuss war durch ein Mitglied der Geschäftsstelle vertreten. |
Seitens des Bundesamtes für Strahlenschutz waren folgende Personen an der Erstellung des Berichts beteiligt (in alphabetischer Reihenfolge):
| Prof. Dr. Gunnar Brix | Abteilung „Medizinischer und beruflicher Strahlenschutz“ |
| Dr. Theresa Hunger | |
| Dr. Erik Mille | |
| Dr. Elke Nekolla | |
| Dr. Helmut Schlattl | |
| Dr. Eva Wanka-Pail | |
| Dr. Katharina Stella Winter |
Das Bundesministerium für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz (BMUV) war durch Herrn Oliver Piel vertreten.
Inhaltsverzeichnis
Kurzfassung
Abstract
| 1 | Einleitung |
| 1.1 | Hintergrund zur Erkrankung |
| 1.2 | Hintergrund zur Röntgenmammographie |
| 1.3 | Mammographie in der Früherkennung |
| 2 | Nutzen-Risiko-Bewertung anhand von RCT |
| 2.1 | Forschungsfrage und Herangehensweise |
| 2.2 | Systematische Literaturübersicht |
| 2.2.1 | Methoden |
| 2.2.1.1 | Literaturrecherche |
| 2.2.1.2 | Ein- und Ausschlusskriterien |
| 2.2.1.3 | Literaturselektion, Qualitätsbewertung und Datenextraktion |
| 2.2.1.4 | Informationssynthese |
| 2.2.2 | Ergebnisse der Literaturrecherche |
| 2.2.2.1 | Erste Stufe: Systematischer Review |
| 2.2.2.2 | Zweite Stufe: Randomisierte kontrollierte Studien |
| 2.2.2.3 | Bewertung der eingeschlossenen Studien |
| 2.2.2.4 | Ergebnisse der Suche in Studienregistern |
| 2.2.3 | Ergebnisse zu Endpunkten |
| 2.2.3.1 | Mortalität |
| 2.2.3.2 | Morbidität |
| 2.2.3.3 | Lebensqualität |
| 2.2.3.4 | Sicherheit und Schadenspotential |
| 2.2.4 | Diskussion |
| 3 | Strahlenrisiko und Nutzen-Risiko-Verhältnis |
| 3.1 | Hintergrund |
| 3.2 | Methodik |
| 3.3 | Ergebnisse |
| 3.4 | Diskussion |
| 4 | Bedingungen und Anforderungen an die Brustkrebsfrüherkennung |
| 5 | Zusammenfassende Bewertung |
Anhang
| A.1 | Recherchesyntax |
| A.2 | In die systematische Literaturübersicht eingeschlossene Publikationen |
| A.3 | Beschreibung der eingeschlossenen Studien |
| A.4 | Im Rahmen der systematischen Literaturübersicht ausgeschlossene Volltexte mit Begründung |
| A.5 | Ergebnisse zur Brustkrebsmortalität |
Abkürzungsverzeichnis
Abbildungsverzeichnis
Tabellenverzeichnis
Literaturverzeichnis
Brustkrebsfrüherkennung mittels Röntgenmammographie bei Frauen unter 50 Jahren
Kurzfassung
Brustkrebs ist die häufigste Krebserkrankung und auch die häufigste Krebstodesursache bei Frauen in Deutschland. Fortgeschrittene Mammakarzinome werden oft als auffällige Tastbefunde in der Brust wahrgenommen, gerade im Frühstadium liegen meist keine Symptome vor. Die Prognose für Mammakarzinome in den Stadien I und II ist deutlich günstiger als in späteren Stadien, so dass der Früherkennung eine wichtige Rolle im Sinne der Diagnosevorverlegung zukommt. In Deutschland wurde daher bundesweit ein organisiertes Mammographie-Screening-Programm (MSP) für 50- bis 69-jährige Frauen eingeführt. Grundlage dafür waren Studien aus den späten 1970er Jahren, in denen gezeigt wurde, dass ein MSP die Brustkrebssterblichkeit in dieser Altersgruppe um etwa 20 bis 30 % reduzieren konnte.
Im vorliegenden Bericht soll bewertet werden, welchen Nutzen und welche Risiken eine Erweiterung der Altersgrenze auf unter 50 Jahre im MSP in Deutschland hätte.
Für diese Nutzen-Risiko-Bewertung der Brustkrebsfrüherkennung mittels Röntgenmammographie bei Frauen unter 50 Jahren wurden in einer systematischen Literaturübersicht acht randomisierte kontrollierte Studien (randomized controlled trial, RCT) aus Europa, den USA und Kanada identifiziert.
Die Studien rekrutierten Teilnehmerinnen im Alter von 39 bis 49 Jahren zwischen 1963 und 1996 und randomisierten diese in eine Screening- und Kontrollgruppe. Die Anzahl der eingeschlossenen Teilnehmerinnen reichte von 21 945 bis 160 921 Frauen. Die Länge der Screening-Intervalle betrug je nach Studie 12, 18, 24 oder 28 Monate. Die Anzahl der Screening-Runden variierte von einer bis zu neun Runden. Die maximale Follow-up-Dauer lag zwischen zehn und 30 Jahren nach Randomisierung. Nach Einladung betrug die Teilnahmerate in der ersten Screening-Runde zwischen 68 % und 93 %. Der Kontrollgruppe wurde während der Screening-Phase keine Mammographie angeboten, jedoch erhielten sie in der Hälfte der Studien eine einmalige Mammographie nach der letzten Screening-Runde der Interventionsgruppe.
Die Metaanalyse der acht Studien zur Brustkrebsmortalität umfasst 369 940 Frauen, die bei Studienbeginn unter 50 Jahre alt waren, davon 164 411 Frauen in der Screening-Gruppe. Während der Nachbeobachtungszeit von circa zehn Jahren ab Randomisierung traten insgesamt in der Screening-Gruppe 378 und in der Kontrollgruppe 556 Brustkrebstodesfälle auf. Es zeigt sich eine statistisch signifikante relative Reduktion der Brustkrebsmortalität von 18 % (Risk Ratio (RR)=0,82; 95%-Konfidenzintervall (KI): 0,71-0,96). Pro 10 000 Teilnehmerinnen starben in der Screening-Gruppe 23 Personen an Brustkrebs und in der Kontrollgruppe 27. Bei Ausschluss der Studien mit hohem Verzerrungsrisiko ist der Effekt mit 25 % Reduktion etwas größer (RR=0,75; 95%-KI: 0,64-0,88). Die Unterteilung nach Altersgruppen über beziehungsweise unter 45 Jahren zeigt einen weitgehend stabilen Effekt zugunsten des Mammographie-Screenings.
Zu einer möglichen Verschiebung der Tumorstadien durch das Screening können mangels ausreichender Daten keine sicheren Aussagen getroffen werden.
Das Risiko der Überdiagnose kann nicht verlässlich abgeschätzt werden, da eine teilweise durchgeführte Abschluss-Mammographie der Kontrollgruppe die Brustkrebsinzidenz verzerrt. Bei konservativer Schätzung liegt das mittlere Überdiagnoserisiko bei circa 14 %.
Eine weitere negative Konsequenz von Früherkennung betrifft die histologische (invasive) Abklärung gutartiger Läsionen. Der Großteil der in den Studien durchgeführten Biopsien führte zu einem benignen Ergebnis, dies betraf ca. 0,5 bis 3 % der Teilnehmerinnen. Allerdings entsprechen die Studien diesbezüglich nicht dem heutigen Stand meist minimal-invasiver Abklärung. Auch der heutige Stand der Mammographie-Technik und der ergänzenden Abklärungsdiagnostik wird nicht widergespiegelt. Die routinemäßige Zwei-Ebenen-Projektion mit digitaler Technik verbessert heute die Diagnostik bei gleichzeitig geringerer Strahlenexposition. Dies ist insbesondere für jüngere Frauen mit häufig dichterem Brustdrüsengewebe relevant.
Nehmen Frauen bereits vor einem Alter von 50 Jahren an einem Mammographie-Screening teil, so ist aufgrund der relativ niedrigen Brustkrebsinzidenz jüngerer Frauen der zusätzliche absolute Nutzen hinsichtlich vermiedener Brustkrebstodesfälle im Vergleich zu einem Screening-Beginn mit 50 Jahren geringer. Das Strahlenrisiko ist hingegen für jüngere Frauen deutlich höher. Entsprechend ist das Nutzen-Risiko-Verhältnis im Vergleich zu einem Screening ab 50 Jahren deutlich geringer. Dies träfe insbesondere dann zu, wenn die jüngeren Frauen an nur wenigen Screening-Runden teilnehmen würden. Die abgeschätzten Strahlenrisiken durch ein zweijährliches Mammographie-Screening sind sowohl für ein Screening gemäß des in Deutschland derzeit etablierten MSP als auch unter Annahme einer Herabsetzung der unteren Altersgrenze gering. So beliefe sich bei einer regelmäßigen Teilnahme am Screening von 45 bis 69 Jahren das damit verbundene Lebenszeitrisiko für eine strahlenbedingte Brustkrebserkrankung rein rechnerisch auf 0,04 %. Gleichwohl läge das geschätzte zusätzliche Lebenszeitrisiko damit 50 % über dem Strahlenrisiko bei einem Screening ab 50 Jahren; bei einem Screening ab 40 Jahren wäre das Strahlenrisiko im Vergleich zu einem Screening-Beginn mit 50 Jahren mehr als doppelt so hoch. Unter Berücksichtigung des zu erwartenden Nutzens und des Strahlenrisikos erscheint es aus Sicht des Strahlenschutzes gerechtfertigt, die untere Altersgrenze im etablierten und qualitätsgesicherten Mammographie-Screening-Programm auf 45 Jahre herabzusetzen. Anspruchsberechtigte Teilnehmerinnen sollen über das Nutzen-Risiko-Verhältnis auch unter Berücksichtigung des Strahlenrisikos informiert werden und gegebenenfalls eine persönliche ärztliche Beratung in Anspruch nehmen.
Breast Cancer Screening by X-Ray Mammography in Women aged 50 and younger
Abstract
Breast cancer is the most common cancer and also the most common cause of cancer death in women in Germany. Advanced breast carcinomas are often perceived as conspicuous palpable findings in the breast, especially in the early stages there are usually no symptoms. The prognosis for breast cancer in stages I and II is significantly better than in later stages, so that screening plays an important role in achieving an early diagnosis. In Germany, an organized nationwide mammography screening program (MSP) for 50 to 69 year old women was therefore introduced. This was based on studies from the late 1970s, which showed that an MSP could reduce breast cancer mortality in this age group by around 20-30 %.
The purpose of this report is to assess the benefits and risks of extending the age limit to under 50 years in the established MSP in Germany.
For this benefit-risk assessment of breast cancer screening using X-ray mammography in women under 50 years of age, eight randomized controlled trials (RCT) from Europe, the USA and Canada were identified in a systematic review of the literature.
The studies recruited participants aged 39-49 years between 1963 and 1996 and randomized them into screening and control groups. The number of participants included ranged from 21,945 to 160,921 women. Depending on the study, the length of the screening intervals was 12, 18, 24 or 28 months. The number of screening rounds varied from one to nine rounds. The maximum follow-up duration ranged from 10 to 30 years after randomization. After being invited, the participation rate in the first round of screening was between 68 % and 93 %. The control group was not offered a mammogram during the screening phase, but received a single mammogram after the last round of screening of the intervention group in half of the studies.
The meta-analysis of the eight studies on breast cancer mortality included 369,940 women who were under 50 years of age at baseline, thereof 164,411 women in the screening group. During the follow-up period of approximately 10 years from randomization, a total of 378 breast cancer deaths occurred in the screening group and 556 in the control group. There is a statistically significant relative reduction in breast cancer mortality of 18 % (risk ratio (RR)=0.82; 95% confidence interval (CI): 0.71-0.96). For every 10,000 participants, 23 women died of breast cancer in the screening group and 27 in the control group. If studies with a high risk of bias are excluded, the effect is slightly larger at 25 % reduction (RR=0.75; 95% CI: 0.64-0.88). The subdivision according to age groups above and below 45 years showed a largely stable effect in favor of mammography screening.
Due to a lack of sufficient data, no reliable statements can be made about a possible shift in tumor stages as a result of screening.
The risk of overdiagnosis cannot be reliably estimated because the final screening examination in some control groups skews the breast cancer incidence. With a conservative estimate, the mean risk of overdiagnosis is around 14 %.
Another negative consequence of screening concerns the histological (invasive) clarification of benign lesions. The majority of the biopsies performed in the studies led to a benign result, accounting for approximately 0.5-3 % of the participants. However, the studies do not correspond to the current status of mostly minimally invasive clarification. The current state of mammography technology and the diagnostic workup are not reflected either. Today, routine two-plane projection using digital technology improves diagnostics while at the same time reducing radiation exposure. This is particularly relevant for younger women, who often have denser breast tissue.
For women taking part in mammography screening before the age of 50, the additional absolute benefit in terms of avoided breast cancer deaths is lower compared to a screening that starts at the age of 50 because of the relatively low breast cancer incidence in younger women. The radiation risk, on the other hand, is significantly higher for younger women. Accordingly, the benefit-risk ratio is significantly lower compared to screening from the age of 50. This would be particularly true, if the younger women would only participate in a few rounds of screening. The estimated radiation risks from a biennial mammography screening are low, both for screening according to the MSP currently established in Germany and assuming a lowering of the lower age limit. With regular participation in screening from 45-69 years of age, the associated lifetime risk of radiation-induced breast cancer would amount to 0.04 %. Nevertheless, the estimated additional lifetime risk would be 50 % higher than the radiation risk with screening from the age of 50; with screening from the age of 40, the radiation risk would be more than twice as high as with screening starting at the age of 50.
Considering the expected benefit and the radiation risk, it appears justified from the radiation protection perspective to lower the age limit in the established and quality-assured mammography screening program to 45 years. Eligible participants should be informed about the benefit-risk ratio, also considering the radiation risk, and if necessary, seek individual medical advice.
1 Einleitung
Nach § 83 Absatz 2 StrlSchG sind Strahlenanwendungen am Menschen nur zulässig, wenn der Nutzen das Strahlenrisiko überwiegt. Dieses Rechtfertigungsprinzip gilt für jede Anwendung ionisierender Strahlung oder radioaktiver Stoffe am Menschen. Früherkennungsuntersuchungen stellen für die Rechtfertigung eine besondere Herausforderung dar, da die überwiegende Anzahl der untersuchten Personen nicht erkrankt ist und somit keinen unmittelbaren gesundheitlichen Nutzen aus der Früherkennung zieht. Weiterhin ist die Früherkennung mittels ionisierender Strahlung oder radioaktiver Stoffe zur Ermittlung nicht übertragbarer Krankheiten nach dem Stahlenschutzgesetz nur zulässig, wenn eine Rechtsverordnung nach § 84 Absatz 2 StrlSchG dies vorsieht. Das BMUV ist ermächtigt, durch Rechtsverordnung festzulegen, welche Früherkennungsuntersuchungen unter welchen Voraussetzungen für eine besonders betroffene Personengruppe zulässig sind. Dabei sind die Ergebnisse der wissenschaftlichen Bewertung des BfS zu berücksichtigen. Das Verfahren der wissenschaftlichen Bewertung durch das BfS ist in der Allgemeinen Verwaltungsvorschrift zur wissenschaftlichen Bewertung von Früherkennungsuntersuchungen zur Ermittlung nicht übertragbarer Krankheiten (StrlSchGVwV-Früherkennung) geregelt [1]. Gemäß dieser erfolgt im Rahmen einer ausführlichen Begutachtung eine Nutzen-Risiko-Bewertung sowie die Darlegung von Bedingungen und Anforderungen an die Durchführung der Früherkennungsuntersuchung (Nummer 3.2 StrlSchGVwV-Früherkennung).
Der vorliegende Bericht enthält die ausführliche Begutachtung für die Brustkrebsfrüherkennung mittels Röntgenmammographie für Frauen unter 50 Jahren, welche das BfS unter Beteiligung von Sachverständigen erstellt hat. Der Entwurf des Berichts wurde im Rahmen eines Konsultationsverfahrens zur Stellungnahme an einschlägige Fachkreise übermittelt. Die Stellungnahmen wurden geprüft und soweit möglich berücksichtigt.
1.1 Hintergrund zur Erkrankung
Als Brustkrebs (Mammakarzinom) werden bösartige Neubildungen der Brustdrüse bezeichnet. Brustkrebs ist die häufigste Krebserkrankung und die häufigste krebsbedingte Todesursache bei Frauen in Deutschland [2]. Fortgeschrittene Mammakarzinome werden mitunter durch Symptome in der Brust wahrgenommen, gerade Frühstadien machen sich jedoch oft nicht bemerkbar.
Im Jahr 2018 erkrankten in Deutschland 69 900 Frauen an Brustkrebs, davon 2 892 im Alter von 40 bis 44 und 5 434 im Alter von 45 bis 50 Jahren [2]. Eine von sechs betroffenen Frauen erkrankte vor dem 50. Lebensjahr. Für eine 45 Jahre alte brustgesunde Frau liegt das Erkrankungsrisiko in den nächsten 10 Jahren bei 2,2 % (eine von 46 Frauen), das Sterberisiko bei 0,3 % (eine von 400 Frauen). Die relative 5-Jahres-Überlebensrate betrug für alle Altersstufen zusammen 88 % (10-Jahres-Überlebensrate: 83 %) [2] und ist vor allem abhängig vom Tumorstadium bei Diagnosestellung. Die Prognose für Mammakarzinome in den Stadien I und II ist deutlich günstiger als in den Stadien III und IV. Für die Stadien I und II lag die relative 5-Jahres-Überlebensrate bei insgesamt 95 % und mehr [2].
1.2 Hintergrund zur Röntgenmammographie
Die 2D-Mammographie (im Folgenden: Mammographie) ist eine Röntgenuntersuchung der Brust. Unter Kompression der Brust wird mithilfe niederenergetischer Röntgenstrahlung das Brustgewebe dargestellt. Die Untersuchung erfolgt in der Regel in zwei Ebenen (craniocaudal und mediolateral oblique, kurz: oblique). Mammographiesysteme machen über radiologische Dichteunterschiede die Zusammensetzung des Gewebes erkennbar, so dass zwischen Fettgewebe, Drüsengewebe und Läsionen unterschieden werden kann. Herde und suspekter Mikrokalk können wichtige Hinweise auf Brustkrebs sein.
Bei dichtem Brustgewebe kann der überlagernde hohe Anteil an Drüsengewebe die Brustkrebsentdeckung und somit die Früherkennung limitieren. Jüngere Frauen haben, neben einer geringeren Brustkrebsinzidenz, häufiger ein dichteres Brustgewebe als Frauen nach der Menopause [3, 4].
Die Mammographie wird als Standardverfahren der Mammadiagnostik und insbesondere auch zur Brustkrebsfrüherkennung eingesetzt. In der Regel handelt es sich dabei heutzutage um die digitale Vollfeldmammographie, welche im Vergleich zu analoger Film-Folien- oder der zwischenzeitlich eingesetzten Speicherfolien-Mammographie insbesondere bei jüngeren Frauen und dichtem Brustgewebe eine verbesserte Bildqualität und geringe Strahlendosis aufweist [5]. Dadurch werden vor allem mehr kleine Tumoren bei gleichzeitig niedrigerer Wiedereinbestellungs- beziehungsweise Abklärungsrate detektiert [6-8]. Im deutschen Mammographie-Screening-Programm (MSP) wird inzwischen ausschließlich die digitale Vollfeldmammographie eingesetzt.
Weitere bildgebende Verfahren für die Diagnostik von Brustkrebs sind die Sonographie, die Tomosynthese und die Magnetresonanztomographie. Diese kommen in der Abklärungsdiagnostik auffälliger Befunde aus der Brustkrebsfrüherkennung nach ärztlicher Indikationsstellung zum Einsatz.
Die Mammographie ist mit einer geringen Strahlenexposition verbunden. Da eine Strahlenexposition im jüngeren Alter mit einem höheren Strahlenrisiko verbunden ist als im höheren Alter, sind mammographische Untersuchungen bei Frauen unter 50 Jahren sorgfältig zu bewerten.
1.3 Mammographie in der Früherkennung
Der Nutzen der Brustkrebsfrüherkennung mittels Röntgenmammographie wurde anhand mehrerer randomisiert kontrollierter Studien (randomized controlled trial, RCT) gezeigt. Die International Agency for Research on Cancer (IARC) schließt in ihrem Bericht aus 2016 aus den Metaanalysen der RCT, dass bei Frauen im Alter von 50 bis 69 Jahren die Brustkrebsmortalität um etwa 23 % reduziert wird [9].
Nach einer Implementierungsphase ab 2005 existiert in Deutschland seit 2009 für die Altersgruppe der 50- bis 69-jährigen Frauen flächendeckend ein etabliertes, qualitätsgesichertes, organisiertes MSP, in welchem Frauen im Abstand von zwei Jahren postalisch zur Teilnahme eingeladen werden [10]. Darüber hinaus haben alle Frauen über 30 Jahre Anspruch auf eine jährliche Tastuntersuchung der Brust [10]. Das deutsche MSP stellt mit hohen Qualitätsstandards unter Einhaltung europäischer Leitlinien eine sichere und effektive Früherkennungsmaßnahme dar, wie sie außerhalb dieser Strukturen (z. B. im grauen/opportunistischen Screening) nicht erreicht werden kann.
Die World Health Organization (WHO) empfiehlt in ihrem Positionspapier von 2014 ein organisiertes, populationsbezogenes MSP für Frauen zwischen 40 und 49 Jahren nur dann, wenn es durch Forschung, Monitoring und Evaluation begleitet wird, das Gesundheitssystem bestimmte Voraussetzungen erfüllt und die Frauen eine selbstbestimmte Entscheidung treffen können (bedingte Empfehlung basierend auf moderater Evidenz); allerdings besteht Unsicherheit bezüglich der Balance von Nutzen und Schaden [11]. Zudem ist es wichtig, dass bereits ein organisiertes populationsbezogenes Screening-Programm für Frauen von 50 bis 69 Jahren etabliert ist.
Die Guidelines Development Group (GDG) der European Commission Initiative on Breast Cancer (ECIBC) empfiehlt für asymptomatische Frauen von 40 bis 44 Jahren mit einem durchschnittlichen Risiko für Brustkrebs im Rahmen eines organisierten Programms kein Mammographie-Screening (bedingte Empfehlung, moderate Evidenz), für asymptomatische Frauen von 45 bis 49 Jahren mit einem durchschnittlichen Risiko für Brustkrebs empfiehlt die GDG der ECIBC im Rahmen eines organisierten Programms ein Mammographie-Screening (bedingte Empfehlung, moderate Evidenz) alle zwei oder drei Jahre (bedingte Empfehlung, sehr niedrige Evidenz) [12]. Aktuelle Beratungen der EU-Kommission betonen auch das Potential risikoadaptierter Screening-Strategien [13].
Die US Preventive Services Task Force (USPSTF) empfiehlt seit 2016, Frauen unter 50 Jahren die individuelle Entscheidung (basierend auf professioneller Beurteilung und persönlicher Präferenz) zur Teilnahme an einem zweijährlichen Mammographie-Screening zu ermöglichen [14]. Die USPSTF gibt zu bedenken, dass ein Screening zwischen 40 und 49 Jahren das Risiko senke, an Brustkrebs zu versterben, wobei die Anzahl an verhinderten Todesfällen geringer sei als für ältere Frauen, die Anzahl an falsch-positiven Ergebnissen und unnötigen Biopsien jedoch größer. Zudem sei ein früher Screening-Beginn in jüngerem Alter möglicherweise mit einem höheren Risiko der Überdiagnose und daraus resultierender Übertherapie verbunden. Die Empfehlungen der USPSTF werden derzeit überarbeitet. Der aktuelle Entwurf sieht ein Screening ab 40 Jahren vor [15]. Die Empfehlung beruht auf moderater Evidenz für einen insgesamt moderaten Nettonutzen und berücksichtigt insbesondere die hohe Brustkrebstodesrate unter schwarzen Frauen.
In der interdisziplinären S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms wird vorgeschlagen, dass sich Frauen im Alter zwischen 40 und 49 Jahren für oder gegen das Mammographie-Screening in diesem Alter auf Basis einer individuellen Risikoanalyse, einer Nutzen-Risiko-Abwägung und unter Berücksichtigung der Präferenzen und der Einwände der Frau entscheiden sollen (Evidenzgrad B: Empfehlung, Level of Evidence 1b, starker Konsens; [16]).
Nur in wenigen europäischen Ländern existieren flächendeckend MSP für Frauen unter 50 Jahren [17]: In Schweden ist das MSP bereits für Frauen ab 40 Jahren empfohlen, in drei weiteren Ländern wird ein Screening ab 45 Jahren angeboten (Österreich, Tschechische Republik, Ungarn). Zusätzlich gibt es in Italien und Portugal Regionen, in denen Frauen ab 45 Jahren am Mammographie-Screening teilnehmen können, sowie in Österreich die Option der Selbsteinladung für Frauen ab 40 Jahren.
2 Nutzen-Risiko-Bewertung anhand von RCT
2.1 Forschungsfrage und Herangehensweise
Die Fragestellung der Nutzen-Risiko-Bewertung lautet: Welchen Nutzen und welche Risiken hat die Brustkrebsfrüherkennung mittels Röntgenmammographie bei Frauen unter 50 Jahren? Dabei ist in erster Linie ein früherer Beginn des Mammographie-Screenings vor dem 50. Lebensjahr gemeint, nicht ein Screening ausschließlich im Alter von unter 50 Jahren.
Die Betrachtung des Nutzens fokussiert auf positive Effekte der Früherkennungsuntersuchung, die relevant für die Zielgruppe sind. Das Risiko umfasst sowohl den Schaden durch unerwünschte Wirkungen als auch das Strahlenrisiko. Die unerwünschten Wirkungen können aus der Früherkennungsuntersuchung selbst sowie aus der nachfolgenden Abklärungsdiagnostik resultieren.
Grundlage der Nutzen-Risiko-Bewertung in diesem Kapitel ist eine systematische Literaturübersicht (Kapitel 2.2). Zur Beurteilung der Strahlenexposition und des damit verbundenen Strahlenrisikos wurden eigene Analysen durchgeführt (Kapitel 3).
2.2 Systematische Literaturübersicht
2.2.1 Methoden
Die Forschungsfrage wurde anhand einer systematischen Literaturübersicht nach den Methoden der evidenzbasierten Medizin untersucht. Als Grundlage für das Vorgehen dienten das PRISMA-Statement (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [18] sowie das Handbuch der Cochrane Collaboration [19]. Um möglichst effizient vorzugehen, wurden in der ersten Stufe systematische Übersichtsarbeiten zum Thema gesucht, auf deren Basis anschließend in der zweiten Stufe nach weiteren, neueren Publikationen zu RCT gesucht wurde.
Um die Forschungsfrage im Hinblick auf die Literatursuche und -auswahl zu präzisieren, wurden ihre Kernelemente nach dem PICOS-Schema (Population, Intervention, Comparator, Outcome (Zielkriterien), Studientypen) in der untenstehenden Tabelle näher definiert (Tabelle 2.2-1).
Tabelle 2.2-1: Forschungsfrage im PICOS-Schema
| Population | – | Alter: unter 50 Jahren |
| – | Geschlecht: Frauen | |
| – | asymptomatisch bzgl. Brustkrebs | |
| – | kein früherer Brustkrebs | |
| Intervention | – | Röntgenmammographie |
| Komparator | – | kein Screening mit bildgebenden Verfahren |
| – | übliche Versorgung | |
| Outcome | Primär: | |
| – | krankheitsspezifische Mortalität | |
| Sekundär: | ||
| – | Gesamtmortalität | |
| – | krankheitsspezifische Morbidität (Inzidenz, Intervallkarzinome und Stadienverteilung) | |
| – | Mastektomierate, Chemotherapierate | |
| – | invasive Abklärung falsch-positiver Befunde | |
| – | Komplikationen bei invasiver Abklärung | |
| – | Überdiagnose | |
| – | Lebensqualität | |
| Studientypen | – | 1. Stufe: Systematischer Review |
| – | 2. Stufe: RCT | |
RCT: randomized controlled trial
2.2.1.1 Literaturrecherche
Die Literaturrecherche für die erste Stufe wurde zuletzt am 14. März 2022 in den elektronischen Datenbanken MEDLINE (via PubMed®) und Cochrane Database of Systematic Reviews durchgeführt. Die Suchstrategie beinhaltete Thesaurus- und Klartextbegriffe für Brustneoplasien, Bevölkerungs-Screening, Mammographie und systematische Übersichtsarbeiten sowie Metaanalysen, die mit geeigneten Operatoren verknüpft wurden (Anhang A.1 – Tabelle 1-1). Publikationszeitraum und Sprache wurden auf Ebene der Datenbankabfrage nicht eingegrenzt. In der Literaturrecherche wurden systematische Reviews mit oder ohne Metaanalyse gesucht, welche die Forschungsfrage zu Nutzen und Risiken des Mammographie-Screenings für Frauen unter 50 Jahren adressieren.
Die Literaturrecherche für die zweite Stufe wurde zuletzt am 17. Juni 2022 in den elektronischen Datenbanken MEDLINE (via PubMed®) und Cochrane Central Register of Controlled Trials durchgeführt. Der Suchzeitraum wurde mit Beginn im April 2016 so gewählt, dass er an den letzten Suchzeitpunkt des Ausgangsreviews anschloss. Die Suchstrategie war bis auf einen Filter für die Selektion nach RCT statt Klartextbegriffen für systematische Übersichtsarbeiten und Metaanalysen identisch zu dem der ersten Stufe (Anhang A.1 – Tabelle 1-2).
Zusätzlich zur elektronischen Datenbanksuche wurden die Referenzlisten eingeschlossener Publikationen hinsichtlich möglicher weiterer relevanter Veröffentlichungen gesichtet. Außerdem wurde am 7. November 2022 in Studienregistern (ClinicalTrials.gov, EU-CTR, Deutsches Register Klinischer Studien) nach bisher unveröffentlichten Studien zum Thema recherchiert.
2.2.1.2 Ein- und Ausschlusskriterien
Die Ein- und Ausschlusskriterien für die Auswahl der Literaturstellen aus der Datenbankrecherche orientierten sich für die Endpunkte Mortalität und Morbidität an der PICOS-Fragestellung (Tabelle 2.2-2). Für die Analyse der weiteren Endpunkte wurden ebenfalls die Referenzen der elektronischen Datenbankrecherche herangezogen.
Die Zielpopulation sind Frauen im Alter unter 50 Jahren, daher wurden nur Studien eingeschlossen, die Ergebnisse für die (Sub-)Gruppe von Frauen berichten, die zu Studienbeginn jünger als 50 Jahre alt waren. Gemäß Tabelle 2.2-1 wurde als Intervention das Mammographie-Screening definiert. Dabei ist im Sinne des „Intention-To-Treat“-Prinzips die Randomisierung einer Frau in die Screening-Gruppe, und damit das Angebot einer Mammographie, entscheidend, unabhängig von der tatsächlichen Teilnahme an einzelnen Screening-Runden. Die Vergleichsintervention sollte aus keinem Screening mit bildgebenden Verfahren beziehungsweise üblicher Versorgung bestehen. Das primäre Zielkriterium war die brustkrebsspezifische Mortalität. Weitere Zielkriterien waren Gesamtmortalität, Morbidität und Stadienverteilung sowie die gesundheitsbezogene Lebensqualität und Schaden in Form von Überdiagnose, falsch-positiven Ergebnissen und invasiven Eingriffen. Studien mit dem Endpunkt Testcharakteristika beziehungsweise diagnostische Güte der Mammographie tragen nicht direkt zur Beantwortung der Forschungsfrage bei, so dass reine Diagnostikstudien nicht eingeschlossen wurden.
Tabelle 2.2-2: Ein- und Ausschlusskriterien der Literaturselektion
| Einschlusskriterien | Ausschlusskriterien |
|---|---|
|
|
RCT: randomized controlled trial
2.2.1.3 Literaturselektion, Qualitätsbewertung und Datenextraktion
Die Literaturstellen aus der Datenbankrecherche wurden in einem zweistufigen Prozess geprüft und selektiert. In der ersten Selektionsrunde wurden auf der Ebene von Titel und Abstract alle Referenzen ausgewählt, die zunächst relevant für die Forschungsfrage erschienen. Dazu selektierten zwei Personen mit epidemiologischer Expertise unabhängig voneinander Referenzen aus der Trefferliste der Datenbankabfrage. Die ausgewählten Referenzen wurden im Volltext beschafft. In der zweiten Selektionsrunde wurden von einer Person anhand des Volltextes die Artikel ausgewählt, die alle Einschlusskriterien erfüllen. Eine zweite Person prüfte unabhängig die Auswahl. Gründe für den Ausschluss von Artikeln wurden dokumentiert. Das Vorgehen bei der Literaturselektion verlief für die erste und zweite Stufe der Recherche identisch.
Da methodische Mängel der Studien zu einer Verzerrung der Ergebnisse führen können, wurde das Verzerrungsrisiko anhand der Kriterien des Cochrane-Risk-of-Bias-Tools, Version 2 [20] bewertet.
Anhand eines festgelegten Extraktionsschemas wurden von drei Personen aus allen eingeschlossenen Artikeln relevante Daten zum Studiendesign, den Teilnehmenden, der Intervention und dem Vergleich sowie zu den Endpunkten nach dem Vier-Augen-Prinzip extrahiert. Bei unterschiedlicher Einschätzung erfolgt ein Konsens mit allen drei Personen.
2.2.1.4 Informationssynthese
Für die Endpunkte brustkrebsspezifische Mortalität und Gesamtmortalität wurde eine Metaanalyse mit Zufallseffekten (random effects model) mit der Software Review Manager 5 der Cochrane Collaboration durchgeführt. Alle anderen Outcomes wurden in Evidenztabellen und narrativer Evidenzsynthese zusammengeführt. Grundsätzlich werden die Analysen nach dem Intention-To-Treat-Prinzip durchgeführt, soweit die verfügbaren Daten dies ermöglichen.
2.2.2 Ergebnisse der Literaturrecherche
2.2.2.1 Erste Stufe: Systematischer Review
Für die erste Stufe wurde im Rahmen der Literaturrecherche ein systematischer Review gesucht (Ausgangsreview), welcher die Forschungsfrage zu Nutzen und Risiken des Mammographie-Screenings für Frauen unter 50 Jahren adressiert. Bei der Sichtung der Trefferliste der Datenbankrecherche hat sich die systematische Übersichtsarbeit von Canelo-Aybar et al. [21] als aktuell und geeignet erwiesen, welche für die ECIBC erstellt wurde und den Nutzen und Schaden des Mammographie-Screenings für Frauen mit einem durchschnittlichen Risiko für Brustkrebs untersucht. Die Hauptfragestellung dort lautete: Welches ist der beste Altersbereich, um ein Brustkrebs-Screening durchzuführen? Dabei wurden drei Altersgruppen untersucht: Frauen jünger als 50 Jahre, Frauen von 50 bis 69 Jahren und Frauen von 70 bis 74 Jahren. Die initiale Literatursuche wurde von Canelo-Aybar et al. im März und April 2016 durchgeführt. Im Juni 2018 ist die Recherche erneut durchgeführt worden, es konnten jedoch keine relevanten Studien gefunden werden, die möglicherweise die Empfehlungen geändert hätten, weshalb die Literaturübersicht nicht aktualisiert wurde. Die Publikation von Canelo-Aybar [21] umfasst also alle bis März/April 2016 in den durchsuchten Datenbanken veröffentlichten Publikationen. In diese wurden RCT eingeschlossen, welche Kohorten mit Einladung zum Brustkrebs-Screening mit Kohorten ohne Einladung zum Brustkrebs-Screening verglichen. Wurden zu einem Zielparameter keine RCT identifiziert, so wurden systematische Reviews von Beobachtungsstudien eingeschlossen. Die Autorinnen und Autoren berücksichtigten nur Beobachtungsstudien, die innerhalb einer Programmstruktur durchgeführt wurden. Für die Altersgruppe unter 50 Jahre wurden 27 Publikationen zu insgesamt sieben RCT (CNBSS, Göteborg, HIP, Malmö, Stockholm, Two-County, UK Age) eingeschlossen [22-48]. Die Autorinnen und Autoren kamen zu dem Schluss, dass das Mammographie-Screening die Brustkrebsmortalität von Frauen unter 50 Jahren um 12 % senkt (risk ratio (RR)=0,88; 95%-Konfidenzintervall (KI): 0,76-1,02; moderate Evidenz), und dass die Gesamtmortalität durch das Brustkrebs-Screening nicht beeinflusst werden dürfte (RR=1,04; 95%-KI: 0,95-1,15; sehr niedrige Evidenz).
2.2.2.2 Zweite Stufe: Randomisierte kontrollierte Studien
Literaturselektion
In der zweiten Stufe der Recherche wurde für den vorliegenden Bericht auf Basis des gewählten Ausgangsreviews [21] nach weiteren oder auch neueren Publikationen von RCT gesucht, welche nach dem Suchzeitpunkt dieses systematischen Reviews publiziert wurden.
Die Literaturrecherche in den elektronischen Datenbanken ergab 1 318 Treffer, die Handsuche lieferte 78 Referenzen. Nach Ausschluss von Duplikaten, Sichtung und Selektion wurden 41 Publikationen zu acht RCT für die Evidenzsynthese eingeschlossen (Abbildung 1, Tabelle 2.2-3). Es wurden im Vergleich zum Ausgangsreview keine neuen RCT identifiziert. Jedoch wurden weitere Publikationen gefunden, welche nicht in den systematischen Review von Canelo-Aybar et al. eingeschlossen [49-70] beziehungsweise erst nach der initialen Recherche von Canelo-Aybar publiziert [71-74] wurden. Eine Liste mit ausgeschlossenen Volltext-Publikationen inklusive Begründung ist in Anhang A.4 zu finden.
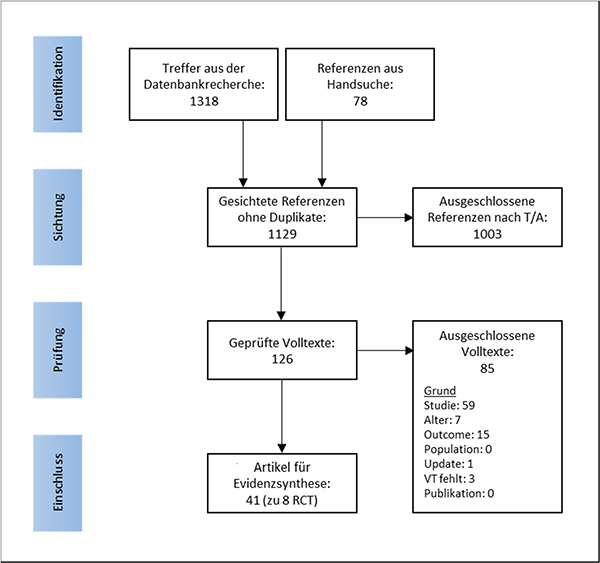
Abbildung 1: PRISMA-Flussdiagramm der Literaturselektion
T/A: Titel/Abstract; Studie: kein RCT; Alter: keine Ergebnisse zu Outcomes separat für Frauen unter 50 Jahren; Outcome: keine Ergebnisse für primären Outcome-Parameter; Population: auch Frauen mit Risikofaktoren, vorangegangenem Brustkrebs oder brustkrebsspezifischen Symptomen eingeschlossen; Update: Es gibt ein Update beziehungsweise neuere Ergebnisse; VT: Volltext; Publikation: z. B. Kurzmitteilung oder Ähnliches.
Folgende RCT wurden in die Evidenzsynthese eingeschlossen, wobei Nyström et al. [74] einige der schwedischen Studien in einer Übersichtsarbeit darstellen:
- –
-
CNBSS: Canadian National Breast Screening Study 1 aus Kanada [35, 36, 61, 64, 71]
- –
-
Edinburgh: Edinburgh Randomised Trial of Breast Cancer Screening aus U.K. [49, 50, 65]
- –
-
Göteborg: Gothenburg Trial of Mammographic Screening aus Schweden [23-25, 74]
- –
-
HIP: Trial by HIP (Health Insurance Plan) aus den USA [28, 31, 43, 53, 66, 67]
- –
-
Malmö: Malmö Mammographic Screening Trial I und II aus Schweden [22, 51, 52, 74]
- –
-
Stockholm: Stockholm Mammographic Screening Trial aus Schweden [29, 30, 56-58, 60, 74]
- –
-
Two-County: Two-County Trial aus Schweden [45-47, 54, 55, 68-70]
- –
-
UK Age: U.K. Age Trial aus U.K. [39, 59, 62, 63, 73, 75]
Die von Canelo-Aybar et al. [21] aufgrund von bedeutsamen Unterschiedenen in den Studiengruppen ausgeschlossene Edinburgh-Studie wird im vorliegenden Bericht eingeschlossen und in den entsprechenden Auswertungen berücksichtigt, da sich auch in anderen eingeschlossenen Studien nach der Randomisierung Unterschiede in den Studiengruppen finden.
Angaben zur brustkrebsspezifischen Mortalität finden sich in 30 von 41 Publikationen (acht Studien). Zur Gesamtmortalität wird in zwölf Publikationen (fünf Studien) berichtet. Angaben zur Inzidenz beziehungsweise Überdiagnose finden sich in 27 (sieben Studien), zur Stadienverteilung in 17 (sieben Studien), zur invasiven Abklärung in zehn (fünf Studien) und zu Intervallkarzinomen in 13 Publikationen (sieben Studien). In keiner der 41 eingeschlossenen Publikationen werden Angaben zu Komplikationen bei der invasiven Abklärung oder zur Lebensqualität gemacht.
Bei den ausgeschlossenen Studien handelt es sich entweder nicht um RCT, und/oder es werden nicht die interessierenden Endpunkte behandelt, und/oder sie umfassen auch andere Populationen als die in der Forschungsfrage spezifizierten. Häufig umfassen diese Populationen Frauen im Alter von 50 bis 69 Jahren in Screening-Programmen.
Charakteristika der eingeschlossenen Studien
In die acht RCT wurden unter anderem Frauen im Alter von 40 bis 49 Jahren eingeschlossen. Dieses Alter entspricht der Zielgruppe der vorliegenden Literaturübersicht. Ausnahmen bilden die Göteborg-Studie, in die Frauen im Kalenderjahr ihres 40. Geburtstag eingeschlossen wurden (also gegebenenfalls bereits mit 39 Jahren), die UK-Age-Studie, zu der nur Frauen von 39 bis 41 Jahren eingeladen wurden, die Malmö-II-Studie, die entgegen der ursprünglichen Planung Frauen zwischen 43 und 49 Jahren eingeschlossen hat und die Edinburgh-Studie, die ausschließlich Frauen von 45 bis 49 Jahren eingeladen hat. In den Studien wurden Frauen ohne Brustkrebs in der Anamnese eingeschlossen beziehungsweise im Fall einer Brustkrebsdiagnose in der Vorgeschichte wurden diese von der Studienanalyse ausgeschlossen. Eine Ausnahme bildet die Malmö-Studie: hier wurden Frauen mit einer Brustkrebsanamnese eingeschlossen; es ist jedoch unklar, inwieweit diese in die Auswertungen der eingeschlossenen Publikationen mit einbezogen wurden. Die Studien rekrutierten ihre Teilnehmerinnen im Zeitraum 1963 bis 1966 (HIP) bis 1990 bis 1996 (UK Age) und randomisierten diese zumeist gleichmäßig in Screening- und Kontrollgruppe. Für die HIP-Studie lag nur die Gesamtanzahl der Teilnehmerinnen vor, diese wurden zu gleichen Teilen randomisiert. In der Stockholm-Studie wurden die Frauen circa im Verhältnis 2:1 randomisiert, in der UK-Age-Studie ungefähr im Verhältnis 1:2. In die Stockholm-Studie wurden die wenigsten Teilnehmerinnen eingeschlossen (21 945), in die UK-Age-Studie die meisten (160 921). Die Länge der Screening-Intervalle betrug je nach Studie zwölf, 18, 24 oder 28 Monate. Auch die Anzahl der Screening-Runden variierte von einer bis zu neun Runden und war rekrutierungs-, alters- beziehungsweise kohortenabhängig. Die maximale Follow-up-Dauer lag zwischen zehn und 30 Jahren nach Randomisierung. Die Teilnahmerate in der ersten Screening-Runde betrug zwischen 68 % (UK Age) und 93 % (Two-County).
Alle Frauen der Screening-Gruppe erhielten eine Mammographie (analoge Film- oder Film-Folien-Technik) in einer oder zwei Ebenen, die von einer oder zwei Personen befundet wurde (Stockholm und Two-County ausschließlich einfach, UK Age ausschließlich doppelt befundet). Frauen der Screening-Gruppe der CNBSS- und HIP-Studie erhielten zudem in jeder Screening-Runde eine körperliche Untersuchung, in der Edinburgh-Studie sogar in jährlichem Abstand, also auch zwischen den Mammographien. In der CNBSS-Studie wurden die Frauen zum Selbstabtasten der Brust angeleitet.
Die Kontrollgruppen erhielten kein Screening-Angebot im Rahmen der Studie während der Screening-Phase, den Kontrollgruppen von Göteborg-, Malmö-, Stockholm- und Two-County-Studie wurde jedoch eine Screening-Untersuchung nach der letzten Runde der Screening-Gruppe angeboten. Die Kontrollgruppe der CNBSS-Studie erhielt initial eine Tastuntersuchung der Brust und wurde zum Selbstabtasten der Brust angeleitet, weiterhin erhielten sie jährlich mit dem Fragebogen eine Erinnerung an die Selbstuntersuchung der Brust.
Zudem ist es sowohl in den Kontrollgruppen als auch vereinzelt in der Screening-Gruppe zu Kontamination gekommen, das heißt, Teilnehmerinnen haben außerhalb der Studie Mammographie-Untersuchungen erhalten (Tabelle 2.2-5).
Das Studiendesign und die Einschlusskriterien sind in Tabelle 2.2-3 zusammengefasst. Tabelle 2.2-4 gibt einen Überblick zu den Interventionen jeder Studie. Die Charakteristika der Studienpopulation finden sich in Tabelle 2.2-5. Zudem werden die Studien im Anhang einzeln beschrieben (Anhang A.3).
Tabelle 2.2-3: Studiendesign und Einschlusskriterien
| Studie | Rekrutierungs- zeitraum |
Studien- zentren [Anzahl] |
Einschlusskriterien | Randomi- sierung |
Screening- Intervall [Monate] |
Screening- Runden [Anzahl] |
Follow-up- Dauer nach Randomi- sierung [Jahre] |
|
|---|---|---|---|---|---|---|---|---|
| CNBSS | 01/1980-03/1985 | 15 | 40 bis 49 Jahre | individuell | 12 | 4-5a | 25e | |
| keine MG in letzten zwölf Monaten | ||||||||
| bisher kein MaCa | ||||||||
| Edinburgh | Kohorte 1: 09/1978-12/1981 Kohorte 2: Kohorte 3: |
87 | Kohorte 1: 45 bis 64 Jahre Kohorte 2: Kohorte 3: |
Cluster (Arztpraxis) |
24 | 2-4b | 10-14b, e | |
| bisher kein MaCa | ||||||||
| Göteborg | 12/1982-04/1984 | 1 | 39 bis 59 Jahre | Cluster (Geburtstag) |
18 | 5 | 24e | |
| 11/1987-06/1991 (Kontrollen) |
auch Frauen mit Z. n. MaCa* | |||||||
| HIP | 12/1963-06/1966 | k. A. | 40 bis 64 Jahre | k. A. | 12 | 4 | 18e | |
| auch Frauen mit Z. n. MaCa* | ||||||||
| Malmö | I | 10/1976-08/1978 | k. A. | Geburtsjahrgänge 1908 bis 1932 | individuell | 18-24 | 6-9c | 30e |
| 10/1992-02/1993 (Kontrollen) |
auch Frauen mit Z. n. MaCa | |||||||
| II | 09/1978-11/1990 | k. A. | Geburtsjahrgänge 1933 bis 1945 | individuell | 18-24 | 1-7c | 23f | |
| 09/1991-04/1994 (Kontrollen) |
auch Frauen mit Z. n. MaCa | |||||||
| Stockholm | 03/1981-10/1985 | k. A. | 40 bis 64 Jahre | quasi-randomisiert nach Geburtstag | 28 | 2 | 26f | |
| 10/1985-05/1986 (Kontrollen) |
auch Frauen mit Z. n. MaCa* | |||||||
| Two-County | 10/1977-03/1981 | k. A. | 40 bis 74 Jahre | Cluster (geographisch) |
24 | 4-5a | 13e | |
| bisher kein MaCa | ||||||||
| UK Age | 1990-1996 | 23 später 20 |
39 bis 41 Jahre | individuell | 12 | 8 | 23f | |
| bisher kein MaCa | ||||||||
* jedoch von Analyse ausgeschlossen, a rekrutierungsabhängig, b kohortenabhängig, c altersabhängig, d nach letzter Runde der Screening-Gruppe, e Maximum, f Median
k. A.: keine Angabe, MaCa: Mammakarzinom, MG: Mammographie, Z. n.: Zustand nach
Tabelle 2.2-4: Intervention
| Studie | Untersuchung | Anzahl der Befundenen der Mammographie |
Anzahl der Ebenen der Mammographie |
Kontrolle | |
|---|---|---|---|---|---|
| CNBSS | MG + Tastuntersuchung der Brust + Anleitung zum Selbstabtasten + initiale Anamnese | 1, falls abnorm 2 |
2 | kein Screening, körperliche Eingangsuntersuchung mit Tastuntersuchung der Brust, jährlicher Fragebogen inklusive Erinnerung an Selbstabtasten der Brust |
|
| Edinburgh | MG + jährliche körperliche Untersuchung | k. A. | 2 (CC + oblique) (T1), danach 1 (oblique) |
kein Screening | |
| Göteborg | MG | 1 (T1-T3), danach 2 |
2 (T1), danach 1 oder 2 (je nach Brustdichte) |
1 Screeninga | |
| HIP | Film-MG + körperliche Untersuchung + initiale Anamnese | k. A. | 2 (CC + lateral) | kein Screening | |
| Malmö | I | Film-Folien-MG | soweit möglich 2 | 2 (CC + oblique) (T1 – T2), danach 1 (oblique) oder 2 (je nach Brustdichte) |
1 Screeninga |
| II | Film-Folien-MG | soweit möglich 2 | 2 | 1 Screeninga | |
| Stockholm | MG + initiale Anamnese | 1 | 1 (oblique), falls abnorm 3 |
1 Screeninga | |
| Two-County | MG | 1 | 1 (MLO) | 1 Screeninga | |
| UK Age | Film-MG | 2 | 2 (T1), danach 1 (MLO) |
kein Screening | |
a nach letzter Runde der Screening-Gruppe
CC: craniocaudal, k. A.: keine Angabe, MG: Mammographie, MLO: mediolateral olique, Tx: Screening-Runde x
Tabelle 2.2-5: Charakteristika der Studienpopulation
| Studie | Anzahl randomisierte Frauen |
Anzahl Frauen im Screening-Arm |
Anzahl Frauen im Kontrollarm |
Teilnahmerate/ Compliance |
Kontamination | |
|---|---|---|---|---|---|---|
| CNBSS-1 | 50 489 (40 bis 49 Jahre) |
25 246 (40 bis 49 Jahre) |
25 243 (40 bis 49 Jahre) |
85,6-89,4 % (Screening-Gruppe) 93,3-94,9 % |
mindestens 1 MG: 7,1 % (Screening-Gruppe außerhalb Studie) 26,4 % |
|
| Edinburgh | 21 746 (45 bis 49 Jahre) |
11 479 (45 bis 49 Jahre) |
10 267 (45 bis 49 Jahre) |
55,9-63,8 % (Screening-Gruppe) |
k. A. | |
| Göteborg | 26 113 (39 bis 49 Jahre) 24 091 |
11 792 (39 bis 49 Jahre) 10 888 |
14 321 (39 bis 49 Jahre) 13 203 |
85 % (Screening-Gruppe, 39 bis 49 Jahre, T1) 66 % |
k. A. | |
| HIP* | 13 000 (40 bis 44 Jahre) 14 480 |
6 500 (40 bis 44 Jahre) 7 240 |
6 500 (40 bis 44 Jahre) 7 240 |
ca. 66 % (Screening-Gruppe, T1) |
k. A. | |
| Malmö | I | 8 054 (45 bis 49 Jahre) |
3 987 (45 bis 49 Jahre) |
4 067 (45 bis 49 Jahre) |
78,6 % (Screening-Gruppe, 45 bis 49 Jahre, T1) |
35 % mindestens 1 MG während Studiendauer(Stichprobe aus Kontrollgruppe, 45 bis 49 Jahre) |
| II | 17 793 (40 bis 49 Jahre) |
9 581 (40 bis 49 Jahre) |
8 212 (40 bis 49 Jahre) |
75 bis 80 % (Screening-Gruppe, 43 bis 49 Jahre, T1) |
||
| Stockholm | 21 945 (40 bis 49 Jahre) |
14 842 (40 bis 49 Jahre) |
7 103 (40 bis 49 Jahre) |
80 bis 82 % | k. A. | |
| Two-County | 18 002 (40 bis 45 Jahre) 17 446 |
9 994 (40 bis 44 Jahre) 9 850 |
8 008 (40 bis 44 Jahre) 7 596 |
93 % (Screening-Gruppe, 40 bis 49 Jahre, T1) |
k. A. | |
| UK Age | 16 0921 (39 bis 41 Jahre) |
53 914 (39 bis 41 Jahre) |
10.7007 (39 bis 41 Jahre) |
68 % (Screening-Gruppe, 39 bis 41 Jahre, T1) |
4 % mindestens 1 MG in letzten drei Jahren (Stichprobe aus Kontrollgruppe) | |
* Angabe nur zur Gesamtanzahl der Teilnehmerinnen und Randomisierung zu gleichen Teilen
k. A.: keine Angabe, MG: Mammographie, Tx: Screening-Runde x
2.2.2.3 Bewertung der eingeschlossenen Studien
Die Bewertung des Verzerrungspotentials der eingeschlossenen Studien anhand des Cochrane-Risk-of-Bias-Tools [20] zeigt bei allen Studien außer der UK-Age-Studie Mängel im Studiendesign (Abbildung 2). In erster Linie sind dies Schwächen im Randomisierungsprozess, z. B. bei der verdeckten Zuteilung der Studiengruppen (allocation concealment). Es ist nicht immer zu beurteilen, ob lediglich die Beschreibung in den Publikationen lückenhaft ist, oder ob die Randomisierung tatsächlich mangelhaft durchgeführt wurde. Zwei Studien führten eine Cluster-Randomisierung durch, die Edinburgh-Studie anhand von Arztpraxen und die Two-County-Studie anhand geographischer Regionen. Die Stockholm-Studie teilte die Frauen nach einem festgelegten Schema anhand des Geburtstags den Studiengruppen zu, sodass von einer Quasi-Randomisierung gesprochen werden muss. Bei der CNBSS-Studie erhielten alle Frauen vor der Randomisierung eine Tastuntersuchung der Brust, und es ist nicht auszuschließen, dass das Ergebnis der Tastuntersuchung einen Einfluss auf die Zuteilung der Frauen beziehungsweise auf ihre Bereitschaft zur Randomisierung in eine Studiengruppe gehabt haben könnte.
In der Two-County-Studie erzielte die Randomisierung ein Ungleichgewicht bezüglich des Alters der Teilnehmerinnen. In der Screening-Gruppe war das Alter etwas höher als in der Kontrollgruppe und dadurch auch die Gesamtmortalität.
Die Verblindung der Teilnehmerinnen und des Studienpersonals wurde in keiner Studie umgesetzt, was der begrenzten Praktikabilität beim Mammographie-Screening geschuldet ist. Trotzdem ist dieser Aspekt nicht als kritisch für das Verzerrungsrisiko einzustufen, da die Brustkrebsmortalität ein objektiver Endpunkt ist, der zudem in der Regel extern adjudiziert wurde.
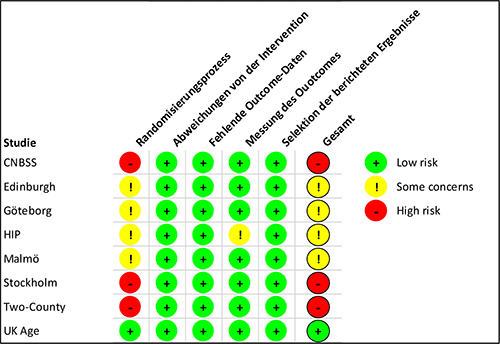
Abbildung 2: Bewertung des Verzerrungsrisikos für den Endpunkt (Brustkrebs-)Mortalität
Grün (+) bedeutet, es besteht kein Verzerrungsrisiko, Gelb (!) zeigt eine mögliches Verzerrungsrisiko oder unzureichende Informationen an, bei Rot (-) besteht ein hohes Verzerrungsrisiko.
Für die Interpretation der Studienergebnisse ist außerdem relevant, dass die Hälfte der Studien am Ende der Screening-Phase auch die Kontrollgruppe zu einem einmaligen Mammographie-Screening einlud (Göteborg, Malmö, Stockholm, Two-County). Die Intervention in der Screening-Gruppe umfasste vereinzelt nicht nur eine Mammographie, sondern auch eine jährliche körperliche Untersuchung (HIP, Edinburgh) beziehungsweise eine jährliche Tastuntersuchung der Brust (CNBSS). Die Teilnehmerinnen der CNBSS wurden zusätzlich zur Selbstabtastung der Brust angeleitet. In der Malmö-Studie erhielten während der laufenden Studie 35 % der Frauen aus der Kontrollgruppe eine Mammographie außerhalb der Studie. Die Definition des Endpunkts Brustkrebssterblichkeit umfasste mitunter auch Frauen, bei denen Brustkrebs nicht als primäre Todesursache vorlag (Edinburgh).
Die Analyse des Verzerrungsrisikos ist wichtig für die Interpretation der Ergebnisse und das Verständnis von Unterschieden zwischen den Studien. Die Metaanalyse berücksichtigt das unterschiedliche Verzerrungsrisiko der einzelnen Studien, indem sie stratifiziert dargestellt werden. Es wird jedoch kein RCT ausgeschlossen, da sie alle relevante Informationen liefern und auch bei anderen Bewertungen des Mammographie-Screenings herangezogen wurden [9, 12].
2.2.2.4 Ergebnisse der Suche in Studienregistern
Die Suche in Studienregistern lieferte einen Hinweis auf einen laufenden RCT. Die Nationwide Cluster-randomised Trial of Extending the NHS Breast Screening Age Range in England (AgeX) untersucht laut Studienprotokoll Nutzen und Risiken einer Erweiterung des bestehenden MSP in England durch die Einladung zu i) einer zusätzlichen Mammographie für Frauen im Alter von 47 bis 49 Jahren und ii) bis zu drei zusätzlichen Mammographien im Abstand von drei Jahren für Frauen älter als 70 Jahre (www.agex.uk, Identifikationsnummer: NCT01081288). Die Studie startete 2009 und randomisierte bis 2020 circa vier Millionen Frauen. Erste Mortalitätsauswertungen werden 2026 erwartet.
2.2.3 Ergebnisse zu Endpunkten
2.2.3.1 Mortalität
Brustkrebsmortalität
Von allen acht eingeschlossenen Studien konnten Ergebnisse zur Brustkrebssterblichkeit herangezogen werden. Zumeist lagen Daten für unterschiedliche Follow-up-Zeitpunkte vor, teilweise separat für die Altersgruppen bis 44 Jahren und ab 45 Jahren. Darüber hinaus verwendeten die Studien unterschiedliche Methoden, welche Brustkrebstodesfälle in die Auswertung eingingen. Nach dem Evaluationsmodell wurden nur diejenigen Brustkrebstodesfälle in die Auswertung mit einbezogen, für welche die Brustkrebsdiagnose während der aktiven Screening-Phase der Studie gestellt wurde. Im Follow-up-Modell hingegen wurden alle Brustkrebstodesfälle gezählt, auch solche, welche aus Brustkrebsfällen resultierten, die erst in der Nachbeobachtungsphase, also nach Screening-Ende, diagnostiziert wurden. Ein interner Vergleich beider Modelle innerhalb derselben Studie zeigte jedoch sowohl in der Göteborg- als auch in der UK-Age-Studie keinen signifikanten Unterschied.
Die Metaanalyse der acht Studien umfasst 369 940 Frauen, die bei Studienbeginn unter 50 Jahre alt waren, mit insgesamt 934 Brustkrebstodesfällen nach dem Evaluationsmodell (Edinburgh, Göteborg, HIP, Malmö, Two-County) beziehungsweise dem Follow-up-Modell (CNBSS, Stockholm, UK Age) (Abbildung 3). Die Nachbeobachtungszeit liegt zwischen sechs und 14 Jahre nach Randomisierung. Die Auswertung erfolgt getrennt nach Studien mit geringem/moderatem Verzerrungsrisiko und Studien mit hohem Verzerrungsrisiko. Insgesamt zeigt sich eine statistisch signifikante relative Reduktion der Brustkrebsmortalität von 18 % (RR=0,82; 95%-KI: 0,71-0,96). Pro 10 000 Teilnehmerinnen sterben in der Screening-Gruppe 23 Frauen an Brustkrebs und in der Kontrollgruppe 27. Bei Ausschluss der Studien mit hohem Verzerrungsrisiko ist der Effekt mit 25 % etwas größer (RR=0,75; 95%-KI: 0,64-0,88).
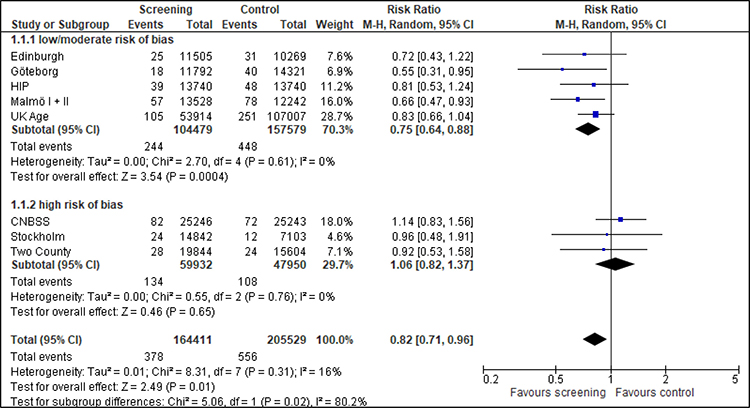
Abbildung 3: Forest-Plot-Brustkrebsmortalität für Frauen unter 50 Jahren bei einer Follow-up-Dauer von 6 bis 14 Jahren
Quadrate mit Balken zeigen den Effektschätzer der einzelnen Studien mit Konfidenzintervall an. Die Größe des Quadrats bildet die Gewichtung der Studie ab. Die Raute symbolisiert den gemeinsamen Effekt mehrerer Studien.
Zusätzliche Analysen zum Nachbeobachtungszeitpunkt 15 Jahre (verfügbar für sieben Studien) und zum maximalen Nachbeobachtungszeitpunkt (verfügbar für sieben Studien) ergeben einen ähnlichen Effekt (siehe Anhang A.5).
Für die nach Altersgruppen getrennte Analyse können für die Frauen im Alter von 39 bis 44 Jahren zwei Studien (HIP, UK Age) und für die Frauen im Alter von 45 bis 49 Jahren drei Studien (Edinburgh, HIP, Malmö II) berücksichtigt werden. Der Effekt ist konsistent und zeigt einen Nutzen des Screenings, wenn auch für die 45- bis 49-Jährigen aufgrund der kleineren Fallzahlen nicht statistisch signifikant (siehe Anhang A.5).
Gesamtmortalität
Für die Analyse der Gesamtmortalität können nur vier Studien herangezogen werden (Abbildung 4). Die Studien waren nicht auf diesen Endpunkt ausgelegt und zeigen erwartungsgemäß keinen Effekt des Mammographie-Screenings auf die Gesamtmortalität.
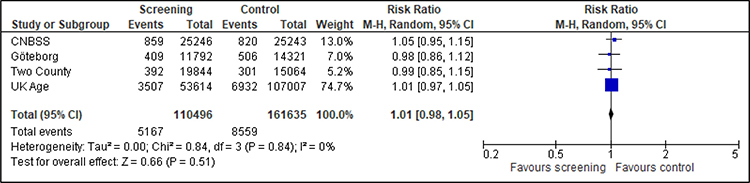
Abbildung 4: Forest-Plot-Gesamtmortalität für Frauen unter 50 Jahren bei einer Follow-up-Dauer von 8 bis 23 Jahren
Quadrate mit Balken zeigen den Effektschätzer der einzelnen Studien mit Konfidenzintervall an. Die Größe des Quadrats bildet die Gewichtung der Studie ab. Die Raute symbolisiert den gemeinsamen Effekt mehrerer Studien. Da kein Hinweis auf Heterogenität vorliegt, wurde auf die Auswertung getrennt nach Verzerrungsrisiko der Studien verzichtet.
2.2.3.2 Morbidität
Für sieben der acht RCT sind Angaben zur Inzidenz vorhanden (Tabelle 2.2-6). Hieraus wurden die Anzahlen der Brustkrebsdiagnosen während des Screenings pro 1 000 Teilnehmerinnen berechnet. Hinsichtlich der Vergleichbarkeit der Brustkrebsinzidenz sind die unterschiedliche Dauer der Screening-Phasen zu beachten.
Sechs RCT berichten die Stadienverteilung (Stadium 0 versus Stadien I-IV) für unterschiedliche Follow-up-Dauern (Tabelle 2.2-7). Die Stockholm-Studie liefert diese nur für die Screening-, nicht jedoch für die Kontrollgruppe. Die Edinburgh- und die Malmö-Studie berichten nicht über Stadienverteilungen. Für fünf Studien (CNBSS, Göteborg, HIP, Two-County, UK Age) können die Erkrankungsraten pro 1 000 Teilnehmerinnen nach Tumorstadium berechnet werden. Es zeigt sich, dass die Erkrankungsraten im Stadium 0 in der Screening-Gruppe jeweils höher sind als in der Kontrollgruppe, solange aktiv gescreent wurde. In den Stadien I-IV zeigt sich dagegen kein konsistenter Unterschied zwischen Screening- und Kontrollgruppe.
Hinsichtlich der Morbidität ist das Auftreten fortgeschrittener Tumoren das relevante Zielkriterium. Allerdings wird nur für die HIP-Studie die differenzierte Stadienverteilung der diagnostizierten Tumoren berichtet (Tabelle 2.2-7). Die Unterschiede zwischen Screening- und Kontrollgruppe sind in den Stadiengruppen nicht statistisch signifikant (Tabelle 2.2-8).
Zu Intervallkarzinomen finden sich in sieben von acht RCT Angaben. Allerdings werden diese jeweils unterschiedlich definiert und sind auch aufgrund der, je nach Studie, teils unterschiedlich langen Intervalle zwischen den Screening-Runden nicht sinnvoll zusammenzufassen. Daher kann lediglich angegeben werden, welcher Anteil der Brustkrebsfälle in der zum Screening eingeladenen Gruppe nicht mittels Screening-Mammographie entdeckt wurde (Tabelle 2.2-6). Dies beinhaltet Intervallkarzinome im engeren Sinne, die zwischen zwei regulären Screening-Runden auftraten, aber auch Fälle, die bei Frauen diagnostiziert wurden, die an einer oder mehreren Runden nicht teilgenommen haben. Die Two-County-Studie, welche ein Intervall von 24 Monaten ansetzt, berichtet von 35,5 % (91 von 246) echten Intervallkarzinomen [46].
Tabelle 2.2-6: Brustkrebsinzidenz und -raten (berechnet pro 1 000 Teilnehmerinnen)
| Studie | Dauer der Screening-Phase [Jahre] |
Brustkrebsfälle (pro 1 000 TN) Screening-Gruppe |
Brustkrebsfälle (pro 1 000 TN) Kontrollgruppe ohne Screening |
Brustkrebsfälle nicht mittels Screening- Mammographie detektiert (Anteil [%] an Brustkrebsfällen der Screening-Gruppe) |
|---|---|---|---|---|
| CNBSS | 5 | 290 (11,49) | 237 (9,39) | 82 (28,3) |
| Edinburgh | k. A. | k. A. | k. A. | |
| Göteborg | 6 | 144* (12,21*) (39 bis 49 J) | 155* (10,82*) (39 bis 49 J) | 61 (42,4) (39 bis 49 J) |
| HIP | 5 | 49 (7,54) (40 bis 44 J)
67 (9,25) (45 bis 49 J) |
46 (7,08) (40 bis 44 J)
68 (9,39) (45 bis 49 J) |
k. A. (74) |
| Malmö I | 8,8 | 22 (6,01) (45 bis 49 J bei Diagnose) |
14 (3,71) (45 bis 49 J bei Diagnose) |
6 (27,3) (45 bis 49 J bei Diagnose) |
| Malmö II | k. A. | k. A. | k. A. | |
| Stockholm | 2,3 | 67* (1,74*) (40 bis 49 J) | 21* (2,96*) | 21 (31,3) |
| Two-County | 8 | 256 (12,90) | 115 (7,37) | 101 (39,5) |
| UK Age | 7 | 953* (17,69*) | 1 731* (16,18*) | 579# (69,3#) |
* CIS+invasiv, alle anderen Studien ohne Angabe, # nur invasiv
CIS: carcinoma in-situ, J: Jahre, k. A.: keine Angabe, TN: Teilnehmerinnen
Tabelle 2.2-7: Stadienverteilung und Raten (berechnet pro 1 000 Teilnehmerinnen)
| Studie | Stadium 0 (in-situ) (pro 1.000 TN) | Stadium I-IV (pro 1.000 TN) | ||
|---|---|---|---|---|
| Screening | Kontrolle | Screening | Kontrolle | |
| CNBSS | 13 J FU*:
71 (2,82) |
13 J FU*:
29 (1,15) |
13 J FU*:
592 (23,48) |
13 J FU*:
552 (21,89) |
| Edinburgh | k. A. | k. A. | k. A. | k. A. |
| Göteborg | 6 J FU:
24 (2,04) |
6 J FU:
13 (0,91) |
6 J FU:
125 (10,60) |
6 J FU:
183 (12,78) |
| HIP# | 6 J FU:
17 (1,24) |
6 J FU:
10 (0,73) |
6 J FU:
I: 65 II: 49 III: 12 IV: 8 (9,75 Stadium I-IV) |
6 J FU:
I: 63 II: 49 III: 15 IV: 8 (9,83 Stadium I-IV) |
| Malmö I + II | k. A. | k. A. | k. A. | k. A. |
| Stockholm | 7,4 J FU*:
12 (k. A.) |
k. A. | 7,4 J FU*:
34 (k. A.) |
k. A. |
| Two-County | 8 J FU:
28 (1,41) |
8 J FU:
10 (0,64) |
8 J FU:
230 (11,49) |
8 J FU:
152 (9,74) |
| UK Age | 7 J FU:
118 (2,19) |
7 J FU:
103 (0,96) |
7 J FU:
835 (15,50) |
7 J FU:
1 628 (15,22) |
* Durchschnitt, ** Median, # Angabe nur zur Gesamtanzahl der TN und Randomisierung zu gleichen Teilen
FU: follow-up, J: Jahre, k. A.: keine Angabe, TN: Teilnehmerinnen
Tabelle 2.2-8: Stadienverteilung als Anzahl (Anteil) der diagnostizierten Tumoren je Studiengruppe in der HIP-Studie
| Screening-Gruppe (n=13.740) |
Kontrollgruppe (n=13.740) |
|
|---|---|---|
| Stadium 0-I | 82 (54,3 %) | 73 (50,3 %) |
| Stadium II-III | 61 (40,4 %) | 64 (44,1 %) |
| Stadium IV | 8 (5,3 %) | 8 (5,5 %) |
2.2.3.3 Lebensqualität
In den für die Nutzen-Risiko-Bewertung eingeschlossenen RCT finden sich keine Analysen zu Auswirkungen auf die Lebensqualität des Mammographie-Screenings für Frauen jünger als 50 Jahre. Der systematische Review von Canelo-Aybar et al. identifiziert wenige Publikationen, die sich mit den psychologischen Effekten des Mammographie-Screenings im Allgemeinen oder der Auswirkung von falsch-positiven Screening-Ergebnissen im Speziellen befassen, jedoch wird in keinem der dort zitierten Reviews eine gesonderte Auswertung für Frauen jünger als 50 Jahre durchgeführt [21]. In den zitierten Publikationen waren Frauen ab 40 bis 69 Jahren eingeschlossen. Für diese Frauen können weiterführende Untersuchungen nach einem suspekten Screening-Befund in Abhängigkeit von der durchzuführenden Untersuchung kurzzeitig oder auch längerfristig Angstgefühle hervorrufen [27]. Das Risiko negativer Effekte war größer, je invasiver die Untersuchung war (Biopsie versus weitere Mammographie) [26]. Falsch-positive Screening-Ergebnisse können auch knapp drei Jahre später noch negative Auswirkungen auf die Psyche haben [26]. Es muss also angenommen werden, dass sich die Teilnahme am Mammographie-Screening mit dem Erleben eines falsch-positiven Befunds negativ auf die Lebensqualität auswirken kann.
2.2.3.4 Sicherheit und Schadenspotential
Überdiagnose
Überdiagnose ist der Nachweis einer Erkrankung durch eine (Screening-)Untersuchung, welche in der Lebenszeit der jeweiligen Person klinisch nicht manifest geworden wäre. Überdiagnose wird als Schaden des Screenings angesehen, da sie zu Folgemaßnahmen, Wiederholungsuntersuchungen und unnötigen Behandlungen (Übertherapie) führen kann. Überdiagnose kann in Studien nicht direkt gemessen, sondern nur abgeschätzt werden [76]. Als einfachste Näherung kann Überdiagnose durch den Überschuss an Brustkrebsdiagnosen in der Screening-Gruppe im Vergleich zur Kontrollgruppe abgeschätzt werden. Dieser Überschuss wird ins Verhältnis gesetzt zu den in der Screening-Gruppe diagnostizierten Brustkrebsfällen [77]. Durch das Screening werden Diagnosen typischerweise vorverlegt (lead time), während bei Personen in der Kontrollgruppe ein existenter Brustkrebs womöglich erst im Laufe der Zeit (catch-up time) symptomatisch geworden und dann diagnostiziert worden wäre. Daher muss in Studien die Follow-up-Dauer nach Beendigung des Screenings ausreichend lang sein, um zwischen Überdiagnose und dem Lead-Time-Effekt differenzieren zu können, denn ohne Überdiagnose würden sich die Inzidenzen der Screening- und der Kontrollgruppe nach Beendigung des Screenings im Laufe der Zeit angleichen.
Für alle Studien außer der Edinburgh-Studie kann die Wahrscheinlichkeit einer Überdiagnose berechnet werden. Problematisch ist hierbei, dass bei der Hälfte der Studien der Kontrollgruppe ebenfalls eine Screening-Mammographie nach Ende der aktiven Studienphase der Screening-Gruppe angeboten wurde beziehungsweise diese am allgemeinen Screening-Programm teilnehmen konnten. Vergleicht man die Inzidenz der beiden Studiengruppen direkt nach Screening-Ende und noch bevor die Kontrollgruppe eine Mammographie erhält, wird die Überdiagnose überschätzt. Werden hingegen die Inzidenzen der beiden Studiengruppen erst nach dem Screening der Kontrollgruppe verglichen, wird die Überdiagnose unterschätzt, weil dadurch in der Kontroll-Gruppe auch asymptomatische Brustkrebsfälle diagnostiziert werden. Selbst bei konservativer Schätzung mit Berücksichtigung der Brustkrebsfälle direkt nach der Screening-Phase zeigt sich ein mäßiger Inzidenzüberschuss und ein mittleres Überdiagnoserisiko von circa 14 % der in der Screening-Gruppe diagnostizierten Mammakarzinome (Tabelle 2.2-9). Allerdings sind die Ergebnisse der einzelnen Studien so heterogen, dass dieser Wert zurückhaltend zu interpretieren ist. Bei der Stockholm-Studie wurden (korrigiert für die unterschiedlichen Gruppengrößen) während der aktiven Phase in der Kontroll-Gruppe mehr Mammakarzinome diagnostiziert als in der Screening-Gruppe, daher ist nach dieser Methode kein sinnvoller Wert zu berechnen beziehungsweise besteht kein Hinweis auf Überdiagnose.
Tabelle 2.2-9: Überdiagnose
| Studie | Zeitpunkt der Inzidenzerhebung für die Screening-Gruppe |
Screening der Kontrollgruppe |
Berechnete Wahrscheinlichkeit** [%], dass ein in der Screening-Gruppe entdeckter Brustkrebs eine Überdiagnose darstellt |
|---|---|---|---|
| CNBSS | 5 beziehungsweise 20 Jahre nach Screening-Ende | nein | 17,5 beziehungsweise 7,8 |
| Edinburgh | k. A. | ||
| Göteborg | Ende der Screening-Phase | ja, einmaliges Abschluss-Screening | 14,1 |
| HIP | 4 Jahre nach Screening-Ende | nein | 0,6 |
| Malmö I* | Ende der Screening-Phase | allgemeines MSP nach Studienende | 14,4 |
| Stockholm | Ende der Screening-Phase | ja, einmaliges Abschluss-Screening | negativer Wert |
| Two-County | Ende der Screening-Phase | ja, einmaliges Abschluss-Screening | 42,9 |
| UK Age | Ende der Screening-Phase | nein | 8,5 |
* bezogen auf Teilnehmerinnen im Alter von 40 bis 49 Jahren bei Diagnose
** Überdiagnosewahrscheinlichkeit = (Anzahl Mammakarzinome in der Screening-Gruppe – Anzahl Mammakarzinome in der Kontroll-Gruppe)/Anzahl Mammakarzinome in der Screening-Gruppe
Abklärungsdiagnostik und Konsequenzen falsch-positiver Screening-Ergebnisse
Mehr als die Hälfte der eingeschlossenen Studien (CNBSS, Göteborg, Malmö, Stockholm, UK Age) machen Angaben zur Häufigkeit (invasiver) Abklärungsuntersuchungen (z. B. Biopsien) in Folge des Screenings (Tabelle 2.2-10). Je nach Studie und Screening-Runde wurden bis zu 5,9 % der Teilnehmerinnen zur bildgebenden Abklärung wiedereinbestellt und bis zu 2,5 % wurden invasiven Eingriffen unterzogen.
Abklärungsmaßnahmen bei erkrankten Personen müssen in Kauf genommen werden, für gesunde Personen können sie jedoch einen vermeidbaren Schaden darstellen, da sie hier aufgrund eines falsch-positiven Screening-Ergebnisses erfolgen. Die UK-Age-Studie berichtet, dass in der ersten Screening-Runde 4,6 % der Teilnehmerinnen ein falsch-positives Ergebnis erhielten, in den Folgerunden nur noch durchschnittlich 3,4 %, und über die gesamte Studiendauer kumuliert erhielten 18 % der Personen mindestens ein falsch-positives Screening-Ergebnis (Tabelle 2.2-10). Von diesen Personen wurden insgesamt 4 % einer Biopsie unterzogen (2 % einer offenen chirurgischen Biopsie). In der kanadischen Studie (CNBSS) erhielten nach der ersten Screening-Runde 3,4 % der Teilnehmerinnen eine Biopsie, deren Ergebnis benigne war. Im Vergleich dazu wurden in der Kontrollgruppe nur 1,15 % der Teilnehmerinnen einer Biopsie mit benignem Ergebnis unterzogen. Der Anteil benigner Befunde an allen durchgeführten Biopsien betrug in der ersten Screening-Runde der Stockholm-Studie 90 % bei den 40- bis 45-Jährigen und 83 % bei den 45- bis 49-Jährigen. Das Verhältnis von Biopsien mit benignem versus malignem Ergebnis lag in der Stockholm-Studie bei 9 beziehungsweise 4,1 für 40- bis 44-Jährige in der ersten beziehungsweise zweiten Screening-Runde und jeweils niedriger mit 4,7 beziehungsweise 3,7 für 45- bis 49-Jährige [60]. Über Komplikationen bei der Abklärungsdiagnostik machen die Studien keine Angaben.
Tabelle 2.2-10: Abklärungsdiagnostik
| Studie | TN mit Abklärung allgemein [%] |
TN mit bildgebender Abklärung [%] |
TN mit invasiver Abklärung [%] |
|---|---|---|---|
| CNBSS | k. A. | T1: 0,8
T2-3: 0,1 |
Zytologie:
T1: 1,3; T2: 1,2; T3: 1,2; T4:1,1; T5: 1,4 |
| Biopsie:
T1: 1,3; T2: 0,8; T3: 0,8; T4: 0,6; T5: 0,6 |
|||
| operativ:
T1: 2,5; T2: 1,2; T3: 1,0; T4: 0,8; T5: 0,8 |
|||
| Edinburgh | k. A. | k. A. | k. A. |
| Göteborg | k. A. | T1: 5,1 (39 bis 44 J); 6,8 (45 bis 49 J)
T2-5: 2,8 (39 bis 44 J); 2,5 (45 bis 49 J) |
Zytologie:
T1: 1,2 (39 bis 44 J); 1,9 (45 bis 49 J) T2: 1,2 (39 bis 44 J); 1,0 (45 bis 49 J) |
| operativ:
T1: 0,3 (39 bis 44 J); 0,7 (45 bis 49 J) T2-5: 0,3 (39 bis 44 J); 0,3 (45 bis 49 J) |
|||
| HIP | k. A. | k. A. | k. A. |
| Malmö | T1-8: 4,0 | k. A. | k. A. |
| Stockholm | k. A. | T1: 5,1
T2: 4,0 |
k. A. |
| Two County | k. A. | k. A. | k. A. |
| UK Age | T1: 4,6
T2-8: 3,4 |
k. A. | T1: 0,3
T2-8: 0,2 |
J: Jahre, MG: Mammographie, k. A.: keine Angabe, Tx: Screening-Runde x, TN: Teilnehmerinnen
Tabelle 2.2-11: Konsequenzen falsch-positiver Screening-Ergebnisse
| Studie | Falsch-positive Screening-Ergebnisse | Biopsie mit benignem Ergebnis |
|---|---|---|
| CNBSS | k. A. | T1: 3,4 % der TN
T2: 1,8 % der TN T3: 1,3 % der TN T4: 1,2 % der TN T5: 1,3 % der TN |
| Edinburgh | k. A. | k. A. |
| Göteborg | k. A. | operativ: 0,27 % der TN |
| HIP | k. A. | k. A. |
| Malmö | T1: 2,3 % | T1: 0,4 % der TN |
| Stockholm | 355/100.000 PJ | T1: 90 % (40-44 J) beziehungsweise 83 % (45-49 J) der Biopsien
T2: 80 % (40-44 J) beziehungsweise 79 % (45-49 J) der Biopsien; 49 pro 100.000 PJ |
| Two County | k. A. | k. A. |
| UK Age | T1: 4,9 % der MG
T2-T8: 3,2 % der MG T1-T8: 18,1 % der TN |
gesamt: 4 % der TN mit falsch-positiver MG
operativ: 2 % der TN mit falsch-positiver MG |
J: Jahre, MG: Mammographie, k. A.: keine Angabe, PJ: Personenjahre, Tx: Screening-Runde x, TN: Teilnehmerinnen
Strahlenexposition und Strahlenrisiko
Die Strahlenexposition wird lediglich für die Malmö-Studie berichtet. Die mittlere absorbierte Dosis wird dort mit 1 Milligray pro Ebene angegeben [51]. Nach Berechnung der Autoren ergab sich pro 20 gerettete Leben ein strahlenbedingter Brustkrebstodesfall [52].
2.2.4 Diskussion
Die präsentierte systematische Literaturübersicht zielte darauf ab, den Effekt von Mammographie-Screening auf die Brustkrebsmortalität bei Frauen unter 50 Jahren zu bewerten. Die Metaanalyse aller acht eingeschlossenen Studien zeigt eine statistisch signifikante relative Reduktion der Brustkrebsmortalität von 18 % bei einer Nachbeobachtungsdauer der Teilnehmerinnen von circa zehn Jahren. Bei Ausschluss der Studien mit hohem Verzerrungsrisiko ist der Effekt größer (25 % statistisch signifikante relative Risikoreduktion).
Die Unterteilung nach Altersgruppen über beziehungsweise unter 45 Jahren zeigt einen weitgehend stabilen Effekt zugunsten des Mammographie-Screenings. Der Effekt für die jüngere Altersgruppe unter 45 Jahren beruht jedoch weitgehend auf einer Studie, in der die Frauen zwischen 39 und 41 Jahren eingeschlossen wurden, im Laufe der aktiven Screening-Phase aber das 45. Lebensjahr überschritten. Es handelt sich somit um einen altersgemischten Effekt.
Es ist zu berücksichtigen, dass teilweise auch Frauen aus der Kontrollgruppe Mammographie-Untersuchungen wahrgenommen haben, einerseits außerhalb der Studien (Kontamination), andererseits in Form einer einmaligen Abschluss-Mammographie im Rahmen der Studien selbst beziehungsweise durch die Teilnahme am allgemeinen MSP im Anschluss an die Studienphase. Beides könnte den beobachteten Unterschied in der Brustkrebsmortalität zwischen den Studiengruppen abgeschwächt haben. Jedoch bilden Konstellationen, in denen Frauen ab dem 50. Lebensjahr regulär gescreent werden, die Fragestellung nach einem früheren Beginn des existierenden deutschen MSP besser ab.
Nicht alle Brustkrebserkrankungen werden im Screening entdeckt. In etablierten Programmen treten die meisten der im Intervall zwischen zwei Screening-Untersuchungen diagnostizierten Mammakarzinome mit einer neuen mammographischen Darstellbarkeit auf, nur wenige werden im Screening tatsächlich übersehen. Da Intervallkarzinome in den eingeschlossenen Studien unterschiedlich definiert werden und die Intervalle zwischen den regulären Screening-Untersuchungen unterschiedlich lang waren, können die Daten nicht über alle Studien hinweg zusammengefasst werden. Eine Studie mit zweijährlichem Screening-Intervall berichtet von 35,5 % echten Intervallkarzinomen [46]. Dies ist vergleichbar mit der Häufigkeit im deutschen MSP, wo die Intervallkarzinomrate im Jahr 2012 für Frauen im Alter von 50 bis 69 Jahren für das zweijährliche Screening-Intervall bei 34 % aller entdeckten Brustkrebsfälle lag [78]. Ein Einfluss der Länge des Screening-Intervalls auf den Effekt des Screenings hinsichtlich der Brustkrebsmortalität wurde nicht festgestellt [79].
Das Risiko der Überdiagnose kann aufgrund des Studiendesigns, nach welchem bei der Hälfte der Studien die Kontrollgruppe ein Abschluss-Screening erhielt, nicht adäquat bewertet werden. Insgesamt dürfte das mittlere Überdiagnoserisiko bei konservativer Schätzung bei circa 14 % der Mammakarzinome liegen. Es ist jedoch davon auszugehen, dass diese Fälle auch bei einem Screening-Beginn mit 50 Jahren diagnostiziert worden wären. Entsprechend muss die Vorverlegung des Screening-Beginns nicht zwingend zu mehr Überdiagnosen führen.
In Deutschland erkrankten im Jahr 2018 im Alter von 40 bis 44 Jahren weniger als 3 000 Frauen an Brustkrebs, im Alter von 45 bis 50 Jahren waren es bereits über 5 000 und im Alter von 50- bis 54 Jahren circa 8 500 [2]. Dementsprechend könnten nur vergleichsweise wenige Frauen unter 50 Jahren von einer Früherkennung profitieren. In den hier ausgewerteten Studien starben in absoluten Zahlen 23 von 10 000 Frauen der Screening-Gruppe und 27 von 10 000 Frauen der Kontrollgruppe an Brustkrebs, die Reduktion betrug damit 4 von 10 000. Bei einem Screening für die Altersgruppe von 50 bis 69 Jahren sind es etwa 4 von 1 000 [9]. Dies verdeutlicht den Unterschied in der absoluten Zahl vermiedener Brustkrebstodesfälle zwischen den Altersgruppen bei vergleichbarer relativer Brustkrebsmortalitätsreduktion. Allerdings können bei jüngeren Frauen pro vermiedenem Brustkrebstodesfall mehr Lebensjahre gewonnen werden.
Es ist zu berücksichtigen, dass die Studien zum Großteil in den 1980er Jahren durchgeführt wurden und insbesondere hinsichtlich der Übertragbarkeit auf die aktuelle Situation in Deutschland Schwächen und Limitationen aufweisen. Die damalige Mammographie-Technik entspricht nicht dem heutigen Stand. So hat die Einführung der digitalen Mammographie die Auswertung von Mammogrammen substantiell verbessert.
Insbesondere bei dichtem Brustgewebe, wie es häufig bei jüngeren Frauen vorliegt, zeigte sich in der digitalen Mammographie eine erhöhte Sensitivität gegenüber der analogen Film-Folien-Mammographie [3, 5]. Auch die aktuell etablierte, routinemäßige Zwei-Ebenen-Darstellung verbessert heute die Diagnostik und detektiert vor allem mehr kleine Tumoren bei gleichzeitig niedrigerer Wiedereinbestellungs- beziehungsweise Abklärungsrate [6-8]. Zudem sind die Abklärungsuntersuchungen heute weniger invasiv, da vermehrt minimal invasive Biopsien statt offener chirurgischer Biopsien zum Einsatz kommen. Im deutschen MSP wurden im Jahr 2020 94 % der im Screening entdeckten Karzinome vor einem operativen Eingriff durch Nadelbiopsie gesichert [80]. Hinzu kommt, dass bei den eingeschlossenen RCT die Mammographien oft nur einfach befundet wurden. Im deutschen MSP werden dagegen alle Mammographien doppelt befundet und konsentiert, was die Brustkrebsdetektionsrate – unabhängig von der Brustdichte – erhöht und gleichzeitig die Wiedereinbestellungsrate reduziert [81, 82]. Bei den eingeschlossenen Studien lagen bei allen, außer der UK-Age-Studie, Probleme beim Randomisierungsprozess vor, oder dieser war nicht ausreichend dokumentiert. So wurden z. B. Cluster-Randomisierungen und eine Quasi-Randomisierung vorgenommen. Ferner könnten Untersuchungen vor der Randomisierung den Zuteilungsprozess beeinflusst haben. Die Screening-Gruppe erhielt zwar teilweise zusätzliche Maßnahmen (jährliche körperliche beziehungsweise Tastuntersuchung oder Anleitung zur Selbstabtastung der Brust), diese dürften jedoch kaum Einfluss auf die Brustkrebssterblichkeit gehabt haben. Bei einigen Studien wurde trotz Randomisierung keine gleiche Altersverteilung in den Gruppen erzielt. Somit könnte dahingehend ein Bias vorliegen.
Unsere Bewertung deckt sich in weiten Teilen mit den Ergebnissen anderer systematischer Übersichtsarbeiten. Der Systematische Review von Canelo-Aybar [21] kommt zu dem Ergebnis, dass das Mammographie-Screening die Brustkrebsmortalität von Frauen unter 50 Jahren um 12 % beziehungsweise 8 % senkt (Evaluations- beziehungsweise Follow-up-Modell, beides nicht statistisch signifikant). Hierbei ist zu berücksichtigen, dass dort im Gegensatz zum vorliegenden Bericht eine Studie aufgrund von demographischen Unterschieden ausgeschlossen wurde. Das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) führte 2022 eine systematische Literaturübersicht zum Nutzen des Mammographie-Screenings für Frauen ab 45 Jahren durch [79]. Dabei wurden dieselben Studien ausgewertet wie im vorliegenden Review, allerdings soweit möglich nur mit der Altersgruppe ab 45 Jahren. Die Ergebnisse der Brustkrebsmortalität nach zehn Jahren Nachbeobachtungszeit sind mit den hier präsentierten vergleichbar. Auch die vom IQWiG beauftragte Modellierung für Frauen ab 45 Jahren kommt zu dem Ergebnis, dass der frühere Beginn des Mammographie-Screenings im Vergleich zum bestehenden MSP einen höheren inkrementellen Nutzen hinsichtlich gewonnener Lebensjahre als auch qualitätsadjustierter Lebensjahre bietet [79].
Die noch laufende AgeX-Studie, welche Frauen im Alter von 47 bis 49 Jahren eine einzelne Mammographie-Aufnahme vor Einstieg in das reguläre Screening ab 50 Jahren anbietet, kann sicherlich die Erkenntnisse aus der vorliegenden Analyse ergänzen. Es ist aber nicht damit zu rechnen, dass sie an der grundsätzlichen Aussage etwas ändert, dass die Mammographie-Früherkennung auch bei Frauen unter 50 Jahren die Brustkrebsmortalität reduzieren kann (www.agex.uk).
Insgesamt zeigt sich auf Grundlage ausreichender Evidenz die Reduktion der Brustkrebsmortalität durch Mammographie-Screening bei Frauen unter 50 Jahren. Hinsichtlich des Schadenspotentials liegen weniger umfassende Daten vor. Die Ergebnisse dazu sind mitunter aufgrund der heute verbesserten Mammographie-Technik und der zwischenzeitlich eingeführten Befundungsstandards nur begrenzt auf die Situation im deutschen MSP übertragbar.
3 Strahlenrisiko und Nutzen-Risiko-Verhältnis
3.1 Hintergrund
Aufgrund der relativ niedrigen und auf die Brust beschränkten Strahlenexposition, die mit Mammographien einhergeht, wird im Folgenden lediglich auf stochastische Strahlenwirkungen eingegangen und hierbei speziell auf das strahlenbedingt erhöhte Brustkrebsrisiko.
Das Risiko strahlenbedingter maligner Erkrankungen wird aus strahlenepidemiologischen Studien zumeist höher strahlenexponierter Personengruppen abgeleitet, bei denen im Vergleich zu nicht exponierten Personen erhöhte Krebsraten beobachtet wurden. Strahlenepidemiologisch ist eine signifikante Erhöhung des Krebsrisikos allerdings erst bei Dosiswerten nachzuweisen, die sehr viel höher sind als die mit den meisten Röntgenuntersuchungen verbundene Strahlendosis. Für den Niedrigdosisbereich lassen sich somit keine sicheren Angaben zum Verlauf der Dosis-Effekt-Kurve machen, so dass man auf eine Extrapolation der im höheren Dosisbereich beobachtbaren Wirkungen hin zu kleinen Dosen angewiesen ist. Hierzu wird im Strahlenschutz von einem linearen Zusammenhang zwischen Krebsrisiko und Dosis ohne Annahme einer Schwellendosis ausgegangen (linear non threshold, LNT). Die Verwendung des LNT-Modells stellt nach Ansicht der Internationalen Strahlenschutzkommission (International Commission on Radiological Protection, ICRP) den besten praktischen Ansatz zur Bewertung des Strahlenrisikos dar und ist dem Vorsorgeprinzip geschuldet [83]. Die ICRP nimmt allerdings für den niedrigen Dosisbereich einen Dosis- und Dosisraten-Effektivitätsfaktor (DDREF) von zwei für solide Krebserkrankungen an. Bei dem DDREF handelt es sich um einen Reduktionsfaktor, der die von der ICRP angenommene geringere biologische Wirksamkeit (pro Dosiseinheit) der Strahlenexposition bei niedrigen Dosen und niedrigen Dosisleistungen im Vergleich zu Expositionen bei hohen Dosen und hohen Dosisleistungen berücksichtigen soll. Andere Kommissionen nehmen einen DDREF von 1,5 (BEIR-VII-Komitee [84]; Biological Effects of Ionising Radiation, BEIR) beziehungsweise von 1 (Strahlenschutzkommission, SSK [85]) an. Das BfS teilt die Einschätzung der SSK.
Die Abschätzung von Strahlenrisiken kann sich auf eine solide Basis epidemiologischer Daten stützen. Die sogenannte Life Span Study (LSS) der japanischen Atombombenüberlebenden stellt aufgrund ihres Umfangs (mehr als 85 000 Personen beider Geschlechter und aller Altersstufen mit Dosisschätzungen), der langen Beobachtungsdauer (> 50 Jahre) sowie der großen internen Kontrollgruppe gering oder nicht exponierter Überlebender die Hauptquelle des derzeitigen Wissens über Strahlenrisiken dar und bildet die wichtigste Basis für quantitative Risikoabschätzungen [84, 86]. Für die japanische LSS liegen Daten sowohl zu Krebsinzidenz (Follow-up ab 1958, dem Beginn der Krebsregister in Hiroshima und Nagasaki) als auch zu Krebsmortalität (Follow-up ab 1950) vor. Darüber hinaus sind speziell für Brustkrebs auch Studien von westlichen Kohorten relevant, die aus diagnostischen oder therapeutischen Gründen ionisierender Strahlung ausgesetzt waren. Zu nennen ist beispielsweise eine Follow-up-Studie zu strahleninduziertem Brustkrebs bei Frauen, die aufgrund einer Tuberkuloseerkrankung eine Pneumothorax-Therapie erhielten, bei der wiederholt Kontroll-Durchleuchtungen des Thorax durchgeführt wurden. Für eine Übersicht relevanter Studien siehe BEIR VII [84], Nekolla et al. [87] und eine Empfehlung mit wissenschaftlicher Begründung der SSK [88]. Insbesondere relevant ist hier auch eine Metaanalyse von Preston et al. [89].
3.2 Methodik
Die Methodik zur Abschätzung des strahlenbedingten Risikos infolge eines Mammographie-Screenings wurde ausführlich im wissenschaftlichen Bericht zur Brustkrebsfrüherkennung mittels Röntgenmammographie bei Frauen ab 70 Jahren [90] sowie in Nekolla et al. [91] dargestellt. Daher wird im Folgenden nur kurz darauf eingegangen.
Im Jahr 2006 wurde der zurzeit aktuellste Bericht des BEIR-Komitees publiziert [84]. Er ist der siebte Report in einer Reihe von Beiträgen des National Research Council der USA, der sich mit der Wirkung ionisierender Strahlung im niedrigen Dosisbereich befasst hat. Im vorliegenden Bericht des BfS basiert die Abschätzung des Strahlenrisikos auf einem modifizierten Risikoansatz des BEIR-Komitees. Es fließen zwei Modelle ein, einerseits ein Risikomodell auf Basis einer Risikomodellierung mittels der Daten der Atombombenüberlebenden (LSS-Modell), andererseits ein Risikomodell aus einer Metaanalyse von Preston et al. [89] (Metaanalyse-Modell), bei der zudem Studien medizinisch exponierter Frauen berücksichtigt wurden. In beiden Modellen wird von einer linearen Dosiswirkungsbeziehung ausgegangen. Zudem besteht jeweils eine Altersabhängigkeit (abnehmendes Strahlenrisiko mit zunehmendem Alter). Das Metaanalyse-Modell prognostiziert ein geringeres Strahlenrisiko als das LSS-Modell und wird vom BEIR-VII-Komitee favorisiert, da bei der Modellierung nicht nur die japanischen, sondern auch westliche Kohorten berücksichtigt wurden.
Das strahlenbedingt zusätzliche Risiko, nach einer Strahlenexposition bis zum Lebensende an Krebs zu erkranken beziehungsweise zu versterben, wird als zusätzliches Lebenszeitrisiko (Lifetime Attributable Risk, LAR) bezeichnet. Im BEIR-VII-Bericht werden entsprechende Schätzwerte für eine US-Population zur Verfügung gestellt. Der vorliegende Bericht präsentiert aktuelle altersspezifische LAR für eine deutsche weibliche Bevölkerung. Bei der Abschätzung wurden eine minimale Latenzzeit von fünf Jahren bis zur klinischen Manifestation einer strahlenassoziierten Krebserkrankung sowie konkurrierende (Lebenszeit verkürzende) Risiken mittels aktueller deutscher Sterbetafel-Daten berücksichtigt. In die Abschätzung gingen aktuelle deutsche Normalraten für Brustkrebsinzidenz beziehungsweise -mortalität sowie – abweichend vom BEIR-VII-Ansatz – konservativ beide oben genannten Risikomodelle ein.
In Tabelle 3.2-1 sind die Unterschiede zwischen der BEIR-VII-Methodik und dem BfS-Ansatz zusammengefasst.
Tabelle 3.2-1: Unterschiede zwischen dem BEIR-VII-Ansatz und dem BfS-Ansatz
| BEIR-VII-Ansatz | Ansatz des BfS auf Basis der BEIR-VII-Modelle für Brustkrebs |
|---|---|
| DDREF = 1,5 | DDREF = 1 |
| Abschätzung des LAR auf Basis US-amerikanischer Brustkrebsraten und Sterbetafeln aus den 1990er Jahren | Abschätzung des LAR auf Basis aktueller deutscher Brustkrebsraten [2] und Sterbetafeln |
| Abschätzung des LAR mittels Metaanalyse-Risikomodell (Berücksichtigung auch westlicher Kohorten) | Abschätzung des LAR mittels Metaanalyse-Modell sowie mittels LSS-Modell mit anschließender Wichtung (0,3 beziehungsweise 0,7; geometrisches Mittel) |
DDREF: Dosis- und Dosisraten-Effektivitätsfaktor; LAR: Lifetime Attributable Risk = zusätzliches Lebenszeitrisiko
Die nachfolgende Abbildung 5 gibt für eine einmalige Mammographie-Untersuchung das zusätzliche Lebenszeitrisiko für die Brustkrebsinzidenz in Abhängigkeit vom Alter bei Mammographie-Untersuchung an. Als repräsentative mittlere Organäquivalentdosis der Brust (Brustdosis) für eine beidseitige Mammographie in zwei Ebenen wurden 2,7 mSv angenommen. Die obere Kurve resultiert aus der Annahme des LSS-Modells, die untere aus der Annahme des Metaanalyse-Modells. Die mittlere Kurve entspricht den LAR-Werten, die sich aus dem BfS-Ansatz mit unterschiedlicher Wichtung beider Modelle ergeben.
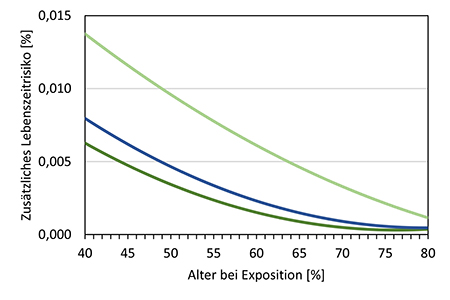
Abbildung 5: Zusätzliches Lebenszeitrisiko LAR (Krebsinzidenz) in Abhängigkeit vom Alter bei Exposition nach einmaliger Exposition mit einer mittleren Brustdosis von 2,7 mSv nach dem LSS-Modell (oben; hellgrün), dem BfS-Ansatz (Mitte; blau) und dem Metaanalyse-Modell (unten; dunkelgrün)
Bei der quantitativen Nutzen-Risiko-Bewertung von Screening-Verfahren mit ionisierender Strahlung wird der Nutzen (also die relative Reduktion der Mortalität der im Screening betrachteten Erkrankung multipliziert mit dem Lebenszeitrisiko für die jeweilige erkrankungsspezifische Mortalität; hier: die durch Screening vermiedenen Brustkrebstodesfälle) mit dem strahlenbedingt zusätzlichen Lebenszeitrisiko LAR (hier: den „strahlenbedingten“ Brustkrebstodesfällen) ins Verhältnis gesetzt. Dabei beziehen sich beide Größen auf die Lebenszeit ab der ersten Screening-Maßnahme. Bei der nachfolgenden Analyse wurde von einem zweijährlichen Screening ausgegangen sowie von einer mittleren relativen Mortalitätsreduktion von 18 % für ein Screening unter 50 Jahren sowie von 25 % für ein Screening ab 50 Jahren. Des Weiteren wird angenommen, dass der Nutzen nach Screening-Ende mit 69 Jahren weitere zehn Jahre fortbesteht und danach gleichmäßig abfällt.
3.3 Ergebnisse
Nachfolgend werden die Abschätzungen für das Lebenszeitrisiko sowie für das Nutzen-Risiko-Verhältnis präsentiert.
In Abbildung 6 ist in Abhängigkeit vom Alter bei Screening-Beginn das LAR (Brustkrebsinzidenz) für ein Screening in Zweijahresintervallen bis 69 Jahre dargestellt. Das LAR nimmt mit zunehmendem Alter bei Screening-Beginn relativ steil ab und liegt bei Screening-Beginn mit 40, 45 beziehungsweise 50 Jahren und Inanspruchnahme aller Runden bis 69 Jahren bei circa 0,06 %, 0,04 % beziehungsweise 0,025 %.
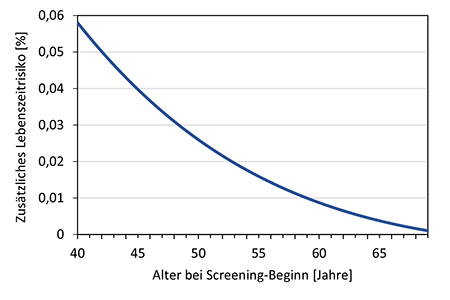
Abbildung 6: Zusätzliches Lebenszeitrisiko LAR (Krebsinzidenz) nach dem BfS-Ansatz in Abhängigkeit vom Alter bei Screening-Beginn unter Annahme eines zweijährlichen Mammographie-Screenings (mittlere Brustdosis = 2,7 mSv pro Runde)
Abbildung 7 gibt Schätzungen für das Nutzen-Risiko-Verhältnis in Abhängigkeit vom Alter bei Screening-Beginn und unter Annahme eines zweijährlichen Screenings bis zum 70. Lebensjahr wieder. Mit steigendem Einstiegs-Alter nehmen die Werte stark zu, wobei der Verlauf der Kurve anfangs noch beinahe linear ist und ab einem Alter von ca. 50 Jahren deutlich steiler wird. Für ein Screening-Beginn im Alter von 40, 45 beziehungsweise 50 Jahren liegt das Nutzen-Risiko-Verhältnis bei ca. 25, 35 beziehungsweise 50; ab einem Screening-Beginn im Alter von 60 Jahren nimmt das Nutzen-Risiko-Verhältnis Werte oberhalb von 100 an. Der mit Alter bei Screening-Beginn zunehmend steile Anstieg des Nutzen-Risiko-Verhältnisses liegt darin begründet, dass der Nutzen mit zunehmendem Alter in geringerem Maße abnimmt als das zusätzliche Strahlenrisiko.
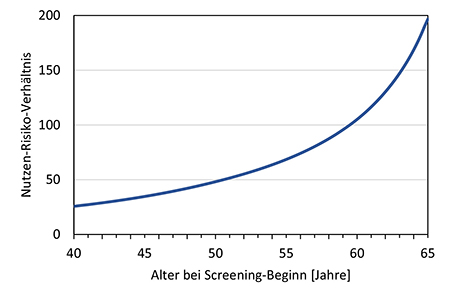
Abbildung 7: Nutzen-Risiko-Verhältnis nach dem BfS-Ansatz in Abhängigkeit vom Alter bei Screening-Beginn unter Annahme einer Reduktion der Brustkrebsmortalität von 18 % für ein zweijährliches Mammographie-Screening zwischen 40 und 49 Jahren und von 25 % für ein zweijährliches Screening zwischen 50 und 69 Jahren (mittlere Brustdosis = 2,7 mSv pro Runde)
Wird das Screening nicht bis 69 Jahre wahrgenommen, sondern nur über wenige Runden, so vermindert sich das Nutzen-Risiko-Verhältnis für jüngere Alter drastisch. Zur Verdeutlichung sind in Abbildung 8 die Nutzen-Risiko-Verhältnisse für ein Screening ab 40 und ab 45 Jahren jeweils über einen Zeitraum von zehn Jahren beziehungsweise bis 69 Jahre dargestellt. Nimmt eine Frau lediglich zehn Jahre am Screening teil, so beträgt das Nutzen-Risiko-Verhältnis bei einem Screening-Beginn mit 40 Jahren ca. 5, bei einem Screening-Beginn mit 45 Jahren immerhin ca. 10.
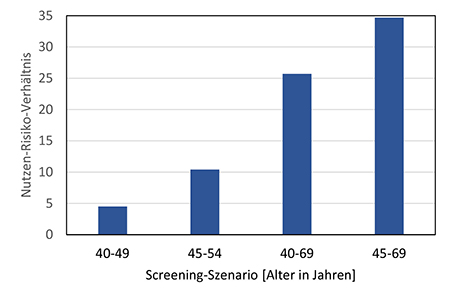
Abbildung 8: Nutzen-Risiko-Verhältnis nach dem BfS-Ansatz in Abhängigkeit vom Alter bei Screening-Beginn unter Annahme einer Reduktion der Brustkrebsmortalität von 18 % für ein zweijährliches Mammographie-Screening zwischen 40 und 49 Jahren und von 25 % für ein zweijährlich Screening zwischen 50 und 69 Jahren für verschiedene Screening-Szenarien (mittlere Brustdosis = 2,7 mSv pro Runde)
3.4 Diskussion
Die angegebenen Strahlenrisiken durch ein zweijährliches Mammographie-Screening sind sowohl für ein Screening gemäß des in Deutschland derzeit etablierten MSP (Teilnahme zwischen 50 und 69 Jahren) als auch unter Annahme einer Herabsetzung der unteren Altersgrenze relativ gering, obwohl die Annahmen für die Risikoschätzungen durch die Verwendung eines DDREF von 1 und des BfS-Ansatzes für die Abschätzung des LAR konservativ sind. Gleichwohl beträgt das LAR bei einem Screening von 40 bis 69 Jahren mehr als das Doppelte und bei einem Screening von 45 bis 69 Jahren das ca. 1,5-Fache im Vergleich zu einem Screening von 50 bis 69 Jahren. Der Unterschied im LAR fällt für einen Screening-Beginn ab 45 Jahren anstatt von 40 Jahren somit deutlich geringer aus.
Bei Annahme eines Screenings über alle Screening-Runden im Abstand von zwei Jahren bis zum 70. Lebensjahr liegt das Nutzen-Risiko-Verhältnis auch für Frauen, die bereits vor einem Alter von 50 Jahren mit dem Screening beginnen würden, bei mindestens 25. Da die Rate der Brustkrebstodesfälle für Frauen unter 50 Jahren noch relativ gering ist und in der vorliegenden Analyse für ein Screening zwischen 40 und 49 Jahren konservativ ein geringerer Nutzen von 18 % angenommen wurde, ist der absolute Lebenszeit-Nutzen für Frauen mit einem Einstiegsalter unter 50 Jahren durchgängig nur geringfügig höher als für Frauen mit einem Einstiegsalter von 50 Jahren. Andererseits fällt das zusätzliche strahlenassoziierte Lebenszeitrisiko jedoch mit zunehmendem Alter bei Screening-Beginn relativ steil ab, so dass das Nutzen-Risiko-Verhältnis bei einem Screening-Beginn mit 50 Jahren im Vergleich zu dem Nutzen-Risiko-Verhältnis bei Screening-Einstieg mit 40 beziehungsweise 45 Jahren etwa 1,9-beziehungsweise etwa 1,4-fach so hoch ist. Verschiedentlich wird diskutiert, ob ein Screening für Frauen in jüngeren Jahren jährlich anstelle von zweijährlich stattfinden sollte. Wird dies für Frauen unter 50 Jahren angenommen, so ergäbe sich für ein Screening bis 69 Jahren und einen Beginn mit 40 beziehungsweise 45 Jahren ein Nutzen-Risiko-Verhältnis von 17 beziehungsweise von 27 (ca. ein Drittel beziehungsweise halb so hoch wie bei Annahme eines Screenings von 50 bis 69 Jahren).
Nehmen Frauen ab 40 oder 45 Jahren nicht bis zu ihrem 70. Lebensjahr, sondern nur an wenigen Screening-Runden teil, so fällt das Nutzen-Risiko-Verhältnis deutlich ungünstiger aus. Dies würde insbesondere für Frauen ins Gewicht fallen, die bereits mit 40 Jahren das erste Mal an einem Screening teilnehmen würden. Nach dem Vorsorgeprinzip sieht das BfS daher einen Screening-Beginn unterhalb von 45 Jahren als kritisch an. Generell empfiehlt das BfS eine möglichst durchgängige und lange Teilnahme am MSP, damit das Nutzen-Risiko-Verhältnis optimiert wird.
Alle Abschätzungen beziehen sich auf eine mittlere Brustdosis von 2,7 mSv pro Screening-Runde. Da bezüglich des Strahlenrisikos eine lineare Abhängigkeit von der Dosis angenommen werden kann, lassen sich die Schätzwerte für das Strahlenrisiko (proportional) wie auch für das Nutzen-Risiko-Verhältnis (umgekehrt proportional) leicht für andere Dosiswerte umrechnen. Beispielsweise könnte so einer zusätzlichen Strahlenexposition infolge einer radiologischen Abklärung falsch-positiver Screening-Befunde Rechnung getragen werden.
Im Vergleich zu Analysen von Miglioretti et al. [92] sind die hier präsentierten Schätzungen für das Nutzen-Risiko-Verhältnis geringer. Die Autoren berechnen mittels zweier Simulationsmodelle für verschiedene Screening-Strategien jeweils die Anzahlen von strahlenassoziierten Brustkrebs- beziehungsweise Brustkrebstodesfällen sowie den Nutzen (vermiedene Todesfälle) und das entsprechende Nutzen-Risiko-Verhältnis. Für die Abschätzung des strahlenassoziierten Risikos geht das Metaanalyse-Modell von Preston et al. [89] (siehe Kapitel 3.2) in die Simulationsmodelle ein. Für ein zweijährliches Mammographie-Screening für Frauen ab 40, 45 beziehungsweise 50 bis 74 Jahren stimmen die Schätzwerte von Miglioretti et al. [92] für die zusätzlichen Brustkrebsfälle mit den hier vorliegenden Werten nahezu überein, jedoch ergeben sich nach den Simulationsmodellen um etwa 25 % höhere Werte für den Nutzen sowie insbesondere niedrigere Zahlen für die strahlenassoziierten Brustkrebstodesfälle, woraus sich die Unterschiede in den Nutzen-Risiko-Schätzungen erklären. Für die Abschätzung der strahlenbedingten Todesfälle wurde bei Miglioretti et al. nach einer anderen Methodik vorgegangen („Microsimulation of Screening Analysis-Fatal Diameter“) als im vorliegenden Bericht (nach BEIR VII). Zudem wurde die Screening-bedingte Mortalitätsreduktion auch auf die strahlenassoziierten Brustkrebstodesfälle angewendet, was angesichts der Latenzzeiten für strahlenbedingte Krebsfälle nicht unkritisch ist.
Wie immer bei Früherkennungsmaßnahmen, die mit einem Strahlenrisiko einhergehen, ist auch beim Mammographie-Screening weiterhin zu berücksichtigen:
- –
-
Einen unmittelbaren Nutzen aus der Teilnahme am Screening haben nur Frauen, die an Brustkrebs erkrankt sind, wohingegen das Strahlenrisiko alle Screening-Teilnehmerinnen betrifft.
- –
-
Erkrankte Personen haben einen unmittelbaren Nutzen durch die Initiierung einer Therapie, während eine strahlenbedingte Krebserkrankung von hypothetischem Charakter ist und gegebenenfalls erst nach einer längeren Latenzzeit, also in einem höheren Lebensalter auftreten würde, das mit einer geringeren Rest-Lebenserwartung verbunden ist.
4 Bedingungen und Anforderungen an die Brustkrebsfrüherkennung
Um sicherzustellen, dass auch in der Versorgungsrealität der Nutzen gegenüber den unerwünschten Wirkungen und dem Strahlenrisiko überwiegt, sind Bedingungen und Anforderungen an den Früherkennungsprozess festzulegen (Nummer 3.2.2 StrlSchGVwV-Früherkennung).
Basierend auf den im vorhergehenden Kapitel präsentierten Nutzen-Risiko-Abwägungen wird eine Herabsetzung des Einstiegsalters des aktuell bestehenden Mammographie-Screenings von 50 auf 45 Jahre empfohlen.
Ein Screening-Intervall von zwei Jahren erscheint auch für jüngere Frauen sinnvoll. Eine Verlängerung des Screening-Intervalls würde zwar das Strahlenrisiko reduzieren, andererseits aber das Risiko bergen, invasive und auch aggressive Karzinome nicht rechtzeitig zu entdecken. Ein systematischer Review für die ECIBC ergab für Frauen von 45 bis 49 Jahren, dass im Vergleich zu einem zweijährlichen Screening ein dreijähriges Intervall zwar zu geringerem Schaden (hinsichtlich falsch-positiv Raten, falsch-positiver Biopsie-Empfehlungen, Überdiagnosen), aber auch zu einer geringeren Mortalitätsreduktion führt [93]. Auf Basis schwacher Evidenz wird im systematischen Review von Canelo-Aybar et al. geschlussfolgert, dass die Unterschiede bezüglich der Vor- und Nachteile bei Screening-Intervallen von einem, zwei oder drei Jahren für Frauen von 45 bis 49 Jahren sehr gering zu sein scheinen [93]. Insgesamt weisen längere Intervalle gegenüber einem jährlichen Screening in dieser Altersgruppe eine geringfügig günstigere Gesamtbilanz auf [93]. Die vom IQWiG beauftragten Modellierungen ergaben, dass ein Screening-Intervall von einem Jahr für Frauen von 45 bis 49 Jahren und einem anschließenden Screening in zweijährlichem Abstand für Frauen von 50 bis 69 Jahren bezogen auf die qualitätsadjustierten Lebensjahre keine Verbesserung darstellt im Vergleich zu einem durchgängigen Screening-Intervall von zwei Jahren für Frauen von 45 bis 49 Jahren [79]. Zudem würde sich bei einem einjährigen Screening das Nutzen-Strahlenrisiko-Verhältnis verringern. Ein Screening-Intervall von zwei Jahren ist auch aus Akzeptanzgründen und organisatorischen Gegebenheiten zu empfehlen [94].
Um Frauen eine informierte Entscheidung für oder gegen den früheren Teilnahmebeginn am qualitätsgesicherten MSP zu ermöglichen, ist bei ihrer Aufklärung neben den klinischen Vorteilen bei der Behandlung eines frühzeitig entdeckten Mammakarzinoms insbesondere das für Frauen zwischen 45 und 49 Jahren im Vergleich zu Frauen von 50 bis 69 Jahren höhere Strahlenrisiko zu thematisieren. In diesem Zusammenhang ist es gerade für einen Screening-Beginn mit 45 Jahren wichtig, den Hinweis zu geben, dass das Nutzen-Risiko-Verhältnis umso günstiger ist, je länger eine Teilnahme am MSP erfolgt. Es ist darüber hinaus empfehlenswert, dass Frauen im Alter zwischen 45 und 49 Jahren gegebenenfalls eine persönliche medizinische Beratung in Anspruch nehmen, welche eventuell auch die Einbettung in ein bio-psycho-soziales Konzept umfasst.
Ansonsten sollte ein Screening für Frauen ab 45 Jahren unter den gleichen Bedingungen und Anforderungen stattfinden wie bei dem in Deutschland für Frauen zwischen 50 und 69 Jahren etablierten qualitätsgesicherten und evaluierten MSP. Für die Bewertung altersabhängiger Effekte wird eine altersgruppenspezifische Berichterstattung und Evaluation für alle Altersgruppen als notwendig erachtet.
5 Zusammenfassende Bewertung
Das Mammographie-Screening kann die Brustkrebsmortalität auch bei Frauen unter 50 Jahren senken. Gleichzeitig ist das mit dem Screening verbundene Strahlenrisiko vertretbar und führt insgesamt zu einem ausreichend hohen Nutzen-Risiko-Verhältnis, sofern die Teilnahme über einen längeren Zeitraum erfolgt. Daher ist eine Herabsetzung des Eintrittsalters für das etablierte MSP auf 45 Jahre gerechtfertigt.
Eine noch weitere Absenkung der Altersgrenze scheint dagegen unter dem Strahlenschutzaspekt nicht gerechtfertigt. Im Gegensatz zu Frauen zwischen 50 und 69 Jahren, die bislang zum Screening eingeladen werden, ist die Brustkrebsinzidenz in den Altersgruppen unter 50 Jahren deutlich niedriger. Daher können bei jüngeren Frauen weniger Fälle durch ein Screening frühzeitig entdeckt und letztlich weniger Todesfälle potentiell vermieden werden. Das beträfe vor allem die bei Screening-Beginn 40- bis 44-Jährigen. Gleichzeitig ist deren Strahlenrisiko höher, wobei das Lebenszeitrisiko für eine strahlenassoziierte Krebserkrankung bei einem Screening ab 40 Jahren etwa 50 % über dem Strahlenrisiko bei einem Screening ab 45 Jahren läge.
Der Nutzen der Brustkrebsfrüherkennung wird durch die regelmäßige und langfristige Teilnahme erzielt. Nehmen Frauen ab 45 Jahren nur über wenige Runden an einem Screening teil, so ist das Nutzen-Risiko-Verhältnis gering. Das Ziel sollte daher sein, dass speziell jüngere Frauen über einen möglichst langen Zeitraum am MPS teilnehmen.
Das individuelle Nutzen-Risiko-Verhältnis ist umso besser, je höher das individuelle Brustkrebsrisiko einer Frau ist. Dies ist vor allem bei jüngeren Frauen relevant. Ein höheres Brustkrebsrisiko besteht zum Beispiel bei einer familiären Vorbelastung oder beim Vorliegen bestimmter hormoneller Einflussfaktoren. Ein mammographisch dichtes Brustgewebe stellt ebenfalls einen eigenständigen Risikofaktor für Brustkrebs dar. Dichteres Brustgewebe liegt bei jüngeren Frauen häufiger vor, so dass diese besonders von einem frühen Screening-Beginn profitieren könnten.
Mammatumoren können jedoch bei dichtem Gewebe maskiert sein. Es steht zur Diskussion, ob die Anwendung der digitalen Tomosynthese eine geeignetere Früherkennungsmethode für Frauen mit dichter Brust darstellen könnte. Dies ist jedoch eine gesonderte Fragestellung und nicht Gegenstand des vorliegenden Berichts.
Frauen mit einer gesicherten Hochrisikokonstellation sollten bereits zu einem früheren Zeitpunkt an speziellen Programmen mit umfassenderer Bildgebung (auch mittels Verfahren ohne Einsatz von Röntgenstrahlung) im Sinne einer intensivierten Früherkennung teilnehmen. Da diese für Frauen der Hochrisikogruppe nicht flächendeckend, wohnortnah verfügbar ist, wird für diese Frauen als bessere Alternative zu keiner systematischen Früherkennung die Teilnahme am qualitätsgesicherten, flächendeckenden MSP ab 45 Jahren empfohlen.
Eine Reevaluation der Fragestellung dieses Berichts wird gemäß StrlSchGVwV-Früherkennung regulär nach fünf Jahren erfolgen, im Fall substantiell neuer Erkenntnisse auch früher.
A.1 Recherchesyntax
Anhang A.1 – Tabelle 1-1: Recherchesyntax in PubMed für systematische Übersichtsarbeiten
| Search | Query |
|---|---|
| #1 | (breast neoplasm [MeSH Terms]) OR (breast cancer [Title/Abstract]) |
| #2 | (mammography [MeSH Terms]) OR (mammogra*[Title/Abstract]) |
| #3 | (mass screening [MeSH Terms]) OR (screen* [Title/Abstract]) OR (early detection of cancer [MeSH Terms]) OR (early detection of cancer [Title/Abstract]) |
| #4 | ((systematic review [Title/Abstract]) OR (systematic [sb])) OR ((meta-analysis [Publication Type]) OR (meta-analys* [Title/Abstract]) OR (metaanalys* [Title/Abstract])) |
| #5 | (animals [mh] NOT humans [mh]) |
| #6 | (#1 AND #2 AND #3 AND #4) NOT #5 |
Anhang A.1 – Tabelle 1-2: Recherchesyntax in PubMed für RCT mit RCT-Filter nach Cochrane-Handbuch
| Search | Query |
|---|---|
| #1 | (breast neoplasm [MeSH Terms]) OR (breast cancer [Title/Abstract]) |
| #2 | (mammography [MeSH Terms]) OR (mammogra*[Title/Abstract]) |
| #3 | (mass screening [MeSH Terms]) OR (screen* [Title/Abstract]) OR (early detection of cancer [MeSH Terms]) OR (early detection of cancer [Title/Abstract]) |
| #4 | (randomized controlled trial [Publication Type]) OR (controlled clinical trial [Publication Type]) OR (randomized [Title/Abstract]) OR (placebo [Title/Abstract]) OR (Drug Therapy [MeSH Subheading]) OR (randomly [Title/Abstract]) OR (trial [Title/Abstract]) OR (groups [Title/Abstract]) |
| #5 | (animals [mh] NOT humans [mh]) |
| #6 | „2016/04/01“ [Date – Entry] : „3000“ [Date – Entry] |
| #7 | ((#1 AND #2 AND #3 AND #4) NOT #5) AND #6 |
RCT-Filter (#4 NOT #5) nach (Lefebvre, Glanville et al. 2022)
A.2 In die systematische Literaturübersicht eingeschlossene Publikationen
Anhang A.2 – Tabelle 2-1: In die systematische Literaturübersicht eingeschlossene Publikationen
| Referenz | Studie |
|---|---|
| Baines CJ, To T, Miller AB. Revised estimates of overdiagnosis from the Canadian National Breast Screening Study. Prev Med 2016; 90: 66-71. https://dx.doi.org/10.1016/j.ypmed.2016.06.033 | CNBSS-1 und 2 |
| Miller AB, Baines CJ, To T et al. Canadian National Breast Screening Study: 1. Breast cancer detection and death rates among women aged 40 to 49 years. CMAJ 1992; 147(10): 1459-1476. | CNBSS-1 |
| Miller AB, To T, Baines CJ and Wall C. The Canadian National Breast Screening Study: update on breast cancer mortality. J Natl Cancer Inst Monogr 1997; 22: 37-41. | CNBSS-1 |
| Miller AB, To T, Baines CJ et al. The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med 2002; 137(5 Part 1): 305-312. https://dx.doi.org/10.7326/0003-4819-137-5_part_1-200209030-00005 |
CNBSS-1 |
| Narod SA, Sun P, Wall C et al. Impact of screening mammography on mortality from breast cancer before age 60 in women 40 to 49 years of age. Curr Oncol 2014; 21(5): 217-221. https://dx.doi.org/10.3747/co.21.2067 |
CNBSS-1 |
| Alexander FE, Anderson TJ, Brown HK et al. The Edinburgh Randomized Trial of Breast-Cancer Screening – Results after 10 Years of Follow-Up. Br J Cancer, 1994; 70(3): 542-548. | Edinburgh |
| Alexander FE, Anderson TJ, Brown HK et al. 14 years of follow-up from the Edinburgh randomised trial of breast-cancer screening. Lancet 1999; 353(9168): 1903-1908. https://dx.doi.org/10.1016/s0140-6736(98)07413-3 |
Edinburgh |
| Roberts MM, Alexander FE, Anderson TJ et al. Edinburgh trial of screening for breast cancer: mortality at seven years. Lancet 1990; 335(8684): 241-246. https://dx.doi.org/10.1016/0140-6736(90)90066-e |
Edinburgh |
| Bjurstam N, Björneld L, Duffy SW et al. The Gothenburg breast screening trial: first results on mortality, incidence, and mode of detection for women ages 39-49 years at randomization. Cancer 1997; 80(11): 2091-2099. | Göteborg |
| Bjurstam N, Björneld L, Warwick J et al. The Gothenburg Breast Screening Trial. Cancer 2003; 97(10): 2387-2396. https://dx.doi.org/10.1002/cncr.11361 | Göteborg |
| Bjurstam NG, Bjorneld LM, Duffy SW. Updated results of the Gothenburg Trial of Mammographic Screening. Cancer 2016; 122(12): 1832-1835. https://dx.doi.org/10.1002/cncr.29975 | Göteborg |
| Aron JL and Prorok PC. An analysis of the mortality effect in a breast cancer screening study. Int J Epidemiol 1986; 15(1): 36-43. https://dx.doi.org/10.1093/ije/15.1.36 | HIP |
| Chu KC, Smart CR and Tarone RE. Analysis of breast cancer mortality and stage distribution by age for the Health Insurance Plan clinical trial. J Natl Cancer Inst 1988; 80(14): 1125-1132. https://dx.doi.org/10.1093/jnci/80.14.1125 |
HIP |
| Habbema JD, van Oortmarssen GJ, van Putten DJ et al. Age-specific reduction in breast cancer mortality by screening: an analysis of the results of the Health Insurance Plan of Greater New York study. J Natl Cancer Inst 1986; 77(2): 317-320. | HIP |
| Shapiro S. Evidence on screening for breast cancer from a randomized trial. Cancer 1977; 39(6 Suppl): 2772-2782. https://dx.doi.org/10.1002/1097-0142(197706)39:6<2772::aidcncr2820390665>3.0.co;2-k |
HIP |
| Shapiro S, Venet W, Strax P et al. Ten- to fourteen-year effect of screening on breast cancer mortality. J Natl Cancer Inst 1982; 69(2): 349-355. | HIP |
| Shapiro S. Periodic screening for breast cancer: the HIP Randomized Controlled Trial. Health Insurance Plan. J Natl Cancer Inst Monogr 1997; (22): 27-30. https://dx.doi.org/10.1093/jncimono/1997.22.27 |
HIP |
| Andersson I. Radiographic screening for breast carcinoma. I. Program and primary findings in 45–69 year old women. Acta Radiol Diagn (Stockh) 1981; 22(2): 185-194. https://dx.doi.org/10.1177/028418518102200213 |
Malmö I |
| Andersson I, Aspegren K, Janzon L et al. Mammographic screening and mortality from breast cancer: the Malmö mammographic screening trial. BMJ 1988; 297(6654): 943-948. https://dx.doi.org/10.1136/bmj.297.6654.943 |
Malmö I |
| Andersson I and Janzon L. Reduced breast cancer mortality in women under age 50: updated results from the Malmö Mammographic Screening Program. J Natl Cancer Inst Monogr 1997; (22): 63-67. https://dx.doi.org/10.1093/jncimono/1997.22.63 | Malmö I+II |
| Frisell J, Glas U, Hellström L et al. Randomized mammographic screening for breast cancer in Stockholm. Design, first round results and comparisons. Breast Cancer Res Treat 1986; 8(1): 45-54. https://dx.doi.org/10.1007/bf01805924 | Stockholm |
| Frisell J, Eklund G, Hellstrom Land Somell A. Analysis of interval breast carcinomas in a randomized screening trial in Stockholm. Breast Cancer Res Treat 1987; 9 (3): 219-25. | Stockholm |
| Frisell J, Eklund G, Hellstrom L et al. Randomized study of mammography screening–preliminary report on mortality in the Stockholm trial. Breast Cancer Res Treat 1991; 18(1): 49-56. https://dx.doi.org/10.1007/BF01975443 |
Stockholm |
| Frisell J and Lidbrink E. The Stockholm Mammographic Screening Trial: Risks and benefits in age group 40-49 years. J Natl Cancer Inst Monogr 1997; (22): 49-51. https://dx.doi.org/10.1093/jncimono/1997.22.49 |
Stockholm |
| Frisell J, Lidbrink E, Hellström L et al. Followup after 11 years–update of mortality results in the Stockholm mammographic screening trial. Breast Cancer Res Treat 1997; 45(3): 263-270. https://dx.doi.org/10.1023/a:1005872617944 |
Stockholm |
| Lidbrink E, Elfving J, Frisell J and Jonsson E. Neglected aspects of false positive findings of mammography in breast cancer screening: analysis of false positive cases from the Stockholm trial. BMJ 1996; 312(7026): 273-6. | Stockholm |
| Duffy SW, Tabar L, Vitak B et al. The Swedish Two-County Trial of mammographic screening: cluster randomisation and end point evaluation. Ann Oncol 2003; 14(8): 1196-1198. https://dx.doi.org/10.1093/annonc/mdg322 |
Two-County |
| Fagerberg G, Baldetorp L, Grontoft O et al. Effects of repeated mammographic screening on breast cancer stage distribution. Results from a randomised study of 92 934 women in a Swedish county. Acta Radiol Oncol 1985; 24(6): 465-73. | Two-County |
| Tabar L, Fagerberg CJ, Gad A et al. Reduction in mortality from breast cancer after mass screening with mammography. Randomised trial from the Breast Cancer Screening Working Group of the Swedish National Board of Health and Welfare. Lancet 1985; 1(8433): 829-832. https://dx.doi.org/10.1016/s0140-6736(85)92204-4 |
Two-County |
| Tabar L, Fagerberg G, Duffy SW et al. The Swedish two county trial of mammographic screening for breast cancer: recent results and calculation of benefit. J Epidemiol Community Health 1989; 43(2): 107-114. https://dx.doi.org/10.1136/jech.43.2.107 | Two-County |
| Tabar L, Fagerberg G, Chen HH et al. Efficacy of breast cancer screening by age. New results from the Swedish Two-County Trial. Cancer 1995; 75(10): 2507-2517. https://dx.doi.org/10.1002/1097-0142(19950515)75:10<2507::aid-cncr2820751017>3.0.co;2-h |
Two-County |
| Tabar L, Fagerberg G, Chen HH et al. Screening for breast cancer in women aged under 50: mode of detection, incidence, fatality, and histology. J Med Screen 1995: 2(2): 94-8. | Two-County |
| Tabár L, Vitak B, Chen HH et al. The Swedish Two-County Trial twenty years later. Updated mortality results and new insights from long-term follow-up. Radiol Clin North Am 2000; 38(4): 625-651. https://dx.doi.org/10.1016/s0033-8389(05)70191-3 |
Two-County |
| Tabar L, Duffy SW, Yen MF et al. All-cause mortality among breast cancer patients in a screening trial: support for breast cancer mortality as an end point. J Med Screen 2002; 9(4): 159-162. https://dx.doi.org/10.1136/jms.9.4.159 |
Two-County |
| Duffy SW, Vulkan D, Cuckle H et al. Effect of mammographic screening from age 40 years on breast cancer mortality (UK Age trial): final results of a randomised, controlled trial. Lancet Oncol 2020; 21(9): 1165-1172. https://dx.doi.org/10.1016/s1470-2045(20)30398-3 | UK Age |
| Duffy S, Vulkan D, Cuckle H et al. Annual mammographic screening to reduce breast cancer mortality in women from age 40 years: long-term follow-up of the UK Age RCT. Health Technol Assess 2020; 24(55): 1-24. https://dx.doi.org/10.3310/hta24550 | UK Age |
| Johns LE, Moss SM, Age Trial Management Group. False-positive results in the randomized controlled trial of mammographic screening from age 40 („Age“ trial). Cancer Epidemiol Biomarkers Prev 2010; 19(11): 2758-2764. https://dx.doi.org/10.1158/1055-9965.EPI-10-0623 | UK Age |
| Moss S, Thomas I, Evans A et al. Randomised controlled trial of mammographic screening in women from age 40: results of screening in the first 10 years. Br J Cancer 2005; 92(5): 949-954. https://dx.doi.org/10.1038/sj.bjc.6602396 |
UK Age |
| Moss SM, Cuckle H, Evans A et al. Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years follow-up: a randomised controlled trial. Lancet 2006; 368(9552): 2053-2060. https://dx.doi.org/10.1016/s0140-6736(06)69834-6 |
UK Age |
| Moss SM, Wale C, Smith R et al. Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years follow-up: a randomised controlled trial. Lancet Oncol 2015; 16(9): 1123-1132. https://dx.doi.org/10.1016/s1470-2045(15)00128-x | UK Age |
| Nyström L, Bjurstam N, Jonsson H et al. Reduced breast cancer mortality after 20+ years of follow-up in the Swedish randomized controlled mammography trials in Malmö, Stockholm, and Göteborg. Journal of medical screening 2017; 24(1): 34‐42. | (Malmö I+II, Göteborg, Stockholm) |
A.3 Beschreibung der eingeschlossenen Studien
Canadian National Breast Screening Study 1 (CNBSS-1)
Die Canadian National Breast Screening Study (CNBSS) rekrutierte in ihrer ersten Phase von 1980 bis 1985 Frauen im Alter von 40 bis 49 Jahren, die keinen Brustkrebs in der Vorgeschichte und im vergangenen Jahr keine Mammographie erhalten hatten. In 15 Studienzentren wurden insgesamt über 25 000 Frauen in jede Studiengruppe randomisiert [61]. Nach einer körperlichen Eingangsuntersuchung inklusive Anleitung zur Selbstuntersuchung für alle Teilnehmerinnen, erhielt die Screening-Gruppe fünf Mammographien in zwei Ebenen und Tastuntersuchungen der Brust im Abstand von 12 Monaten [35]. Die Mammographien wurden einfach befundet, bei Abnormität doppelt. Die Kontrollgruppe erhielt einen jährlichen Fragebogen. Die Compliance betrug in beiden Studiengruppen etwa 90 %, die Kontamination der Kontrollgruppe durch Mammographien außerhalb der Studie lag bei über 25 %. Die Stichprobengröße war so gewählt, dass eine Reduktion der Brustkrebsmortalität von 40 % hätte nachgewiesen werden können, jedoch zeigten die Auswertungen nach unterschiedlichen Beobachtungszeiträumen keinen statistisch signifikanten Effekt des Screenings. Die maximale Follow-up-Dauer betrug 25 Jahre.
Edinburgh Randomised Trial of Breast Cancer Screening (Edinburgh)
Die Edinburgh Randomised Trial of Breast Cancer Screening startete Ende der 1970er Jahre in U.K. und schloss Frauen in drei Rekrutierungskohorten ein. In die erste Kohorte wurden von 1978 bis 1981 Frauen von 45 bis 64 Jahren eingeschlossen [65], in die beiden darauffolgenden Kohorten von 1982 bis 1985 jeweils Frauen von 45 bis 49 Jahren [50]. Es wurden nur Frauen ohne vorhergegangenen Brustkrebs eingeschlossen. In einer Cluster-Randomisierung wurden die 87 beteiligten Arztpraxen zufällig einer Studiengruppe zugewiesen, damit kamen alle teilnehmenden Frauen aus einer Praxis in dieselbe Studiengruppe. Hieraus resultierte, dass die Frauen in der Kontrollgruppe einen niedrigeren sozioökonomischen Status hatten [49]. Insgesamt wurden 21 746 Frauen im Alter von 45 bis 49 Jahren randomisiert, davon 11 479 in die Screening-Gruppe [49]. Die Teilnahme dieser Altersgruppe lag zwischen 55,9 und 63,8 % für die ersten drei Screening-Runden [65]. Der Kontrollgruppe wurde kein Screening angeboten. Die Aufnahmen der ersten Screening-Runde wurden in zwei Ebenen angefertigt (craniocaudal und oblique), in den folgenden Screening-Runden nur noch in einer Ebene (oblique). Je nach Kohorte wurden zwei bis vier Screening-Runden im Abstand von 24 Monaten durchgeführt, zusätzlich wurden die Frauen alle zwölf Monate körperlich untersucht [49]. Die Screening-Untersuchungen wurden bis Mai 1988 durchgeführt, im darauffolgenden Monat wurde ein allgemeines Screening in Edinburgh eingeführt [49]. Die Follow-up-Dauer betrug je nach Kohorte 10 bis 14 Jahre [49]. Für die Altersgruppe 45 bis 49 Jahre konnte keine statistisch signifikante Reduktion der Brustkrebsmortalität nachgewiesen werden.
Gothenburg Trial of Mammographic Screening (Göteborg)
Für die Gothenburg Trial of Mammographic Screening wurden zwischen 1982 und 1984 Frauen für die Screening- beziehungsweise zwischen 1987 und 1991 für die Kontrollgruppe rekrutiert. Eingeschlossen wurden 39- bis 59-Jährige der Geburtsjahrgänge 1923 bis 1944 [23-25, 74]; die vorliegende Auswertung berücksichtigt jedoch nur die Teilnehmerinnen unter 50 Jahren, konkret zwischen 39 und 49 Jahren. Frauen mit Brustkrebs in der Vorgeschichte durften an der Studie teilnehmen, gingen aber nicht in die Mortalitätsauswertung ein. Die Randomisierung erfolgte größtenteils individuell nach dem Geburtstag und zu einem kleinen Teil über Geburtstags-Cluster [23-25, 74]. Insgesamt befanden sich 11 792 Frauen zwischen 39 und 49 Jahren in der Screening-Gruppe [25]. In der Kontrollgruppe waren es 14 321 Frauen der gleichen Altersgruppe [25]. Die Teilnahmerate betrug beim ersten Screening 85 % für die Screening- und 66 % für die Kontrollgruppe [24]. Teilnehmerinnen der Screening-Gruppe durchliefen fünf Screening-Runden in einem Intervall von 18 Monaten [23-25]. Die Kontrollgruppe erhielt zeitähnlich mit dem fünften Screening der Screening-Gruppe ein einmaliges Screening [23-25]. Die Mammographie wurde anfangs in zwei Ebenen, später in Abhängigkeit der Brustdichte in ein oder zwei Ebenen durchgeführt [23-25]. Während der ersten drei Screening-Runden erfolgten Einzelbefundungen, ab der vierten Runde Doppelbefundungen [23-25]. Die Follow-up-Dauer betrug im Median 24 Jahre [25], davon sieben Jahre in der Screening-Phase. Die Mortalitätsanalyse für Brustkrebs zeigt eine statistisch signifikante Reduktion von 40 % [25, 74].
Trial by HIP (Health Insurance Plan) (HIP)
Die Studie des Health Insurance Plan (HIP-Studie) rekrutierte von 1963 bis 1966 Frauen zwischen 40 und 64 Jahren; in der vorliegenden Auswertung wurden jedoch nur die Frauen zwischen 40 und 49 Jahren berücksichtigt. In die Screening- und in die Kontrollgruppe wurden jeweils 13 740 Teilnehmerinnen von 40 bis 49 Jahren eingeschlossen [31]. In vier Screening-Runden erhielten die Frauen der Screening-Gruppe in jährlichem Abstand eine analoge Film-Mammographie in zwei Ebenen (craniocaudal und lateral) mit körperlicher Untersuchung und Anamnese [43, 66, 67]. Die Kontrollgruppe erhielt kein Screening [28, 31, 43, 53, 66, 67]. Die Teilnahmerate betrug bei der ersten Runde circa 66 % [31, 66]. Das letzte Mortalitäts-Follow-up erfolgte nach 18 Jahren [28, 53]. Die Analysen zur Brustkrebsmortalität wiesen eine Reduktion von 31 % für Frauen von 40 bis 44 Jahren und für Frauen von 45 bis 49 Jahren von 14 % auf [31].
Malmö Mammographic Screening Trial I und II (Malmö I und II)
Für die Malmö Mammographic Screening Trial wurden zwischen 1976 und 1978 Frauen der Geburtsjahrgänge 1908 bis 1932 eingeladen (Malmö I), die Frauen waren dementsprechend zwischen 45 und 69 Jahre alt [22]. Im Anschluss an die Rekrutierungszeit der Malmö-I-Studie sollten bis 1990 weitere Frauen im Alter von 45 Jahren zur analog konzipierten Malmö-II-Studie eingeladen werden, die in den Jahren 1933 bis 1945 geboren wurden [52]. Aufgrund mangelnder personeller Ressourcen wurden in einigen Jahren keine, dafür in anderen Jahren mehrere Geburtsjahrgänge zur Studienteilnahme eingeladen, sodass die eingeladenen Frauen zwischen 43 und 48 Jahre alt waren. Im Jahr 1990 wurde dann ein allgemeines MSP in Malmö implementiert. Auch Frauen mit Brustkrebs in der Vorgeschichte wurden in die Studie eingeschlossen [22], wobei unklar ist, inwieweit diese in die Auswertungen mit einbezogen wurden. Frauen für die Kontrollgruppe wurden erst nach Abschluss aller Screening-Runden für die Screening-Gruppe zu einem Screening eingeladen [52]. Insgesamt befanden sich 13 568 Frauen im Alter von 43 bis 49 Jahren in der Screening- und 12 279 in der Kontrollgruppe [74]. Die Teilnahme beim ersten Screening betrug zwischen 75 und 80 % [51, 74]. Mittels analoger Film-Folien-Mammographie wurden in den ersten beiden Screening-Runden der Malmö-I-Studie Aufnahmen in zwei Ebenen angefertigt (craniocaudal und oblique), danach nur noch bei dichter Brust, ansonsten nur oblique [22, 52]. Für die Malmö-II-Studie wurden alle Aufnahmen in zwei Ebenen angefertigt [74]. Wenn möglich, fand bei beiden Studien eine Doppelbefundung statt. In Abhängigkeit vom Alter bei Randomisierung fanden bis zu neun Screening-Runden im Abstand von 18 bis 24 Monaten statt [74]. Bei einer zufälligen Stichprobe von 45- bis 49-jährigen Frauen aus der Kontrollgruppe zeigte sich eine Kontamination von 35 %, diese Frauen hatten mindestens eine Mammographie während der Studiendauer erhalten [22]. Es gibt Hinweise, dass auch Frauen in der Screening-Gruppe Mammographien außerhalb des Studien-Settings erhielten [22]. Die Mortalitätsanalyse für Brustkrebs mit einer Follow-up-Dauer von 10 bis 15,5 Jahren (Malmö II und I) zeigt eine statistisch signifikante Reduktion von 36 % [52].
Stockholm Mammographic Screening Trial (Stockholm)
Für die Stockholm Mammographic Screening Trial erfolgte die Rekrutierung der Screening-Gruppe von 1981 bis 1985, die der Kontrollgruppe bis 1986. Untersucht wurden Frauen zwischen 40 bis 69 Jahren; in der vorliegenden Auswertung wurden jedoch nur Frauen zwischen 40 bis 49 Jahren berücksichtigt. Die Frauen wurden in einer Quasi-Randomisierung mit einem vorab festgelegten Schema anhand ihres Geburtstags einer der Studiengruppen zugeteilt [30, 56]. In die Screening-Gruppe wurden mehr als 14 000 Teilnehmerinnen eingeschlossen, in die Kontrollgruppe mehr als 7 000 [30, 56, 58]. Nach einer initialen Anamnese erfolgte für die Screening-Gruppe die Mammographie jeweils in einer Ebene (oblique) und wurde im Fall einer Abnormität um eine 3-Ebenen-Mammographie ergänzt [57, 58]. Es fand eine Einzelbefundung statt [29, 74]. Die Teilnehmerinnen der Screening-Gruppe durchliefen zwei Screening-Runden mit einem Abstand von 28 Monaten [30, 58, 74]. Die Kontrollgruppe erhielt erst nach Abschluss der letzten Screening-Runde der Interventionsgruppe eine Screening-Untersuchung [30, 56, 58, 74]. Die Teilnahmerate betrug 80 bis 82 % [29, 56, 58]. Die maximale Follow-up-Dauer lag bei 25 Jahren [74]. Die Mortalitätsanalysen für Brustkrebs zeigen zu keinem Zeitpunkt eine statistisch signifikante Reduktion [30, 56, 58].
Two-County Trial (Two-County)
Die Two County Trial wurde Ende der 1970er Jahre in zwei Regionen von Schweden implementiert: Kopparberg (heute Dalarna, Zentralschweden) und Östergötland (Südschweden). Rekrutiert wurden Frauen zwischen 40 und 74 Jahren. Insgesamt wurden 35 448 Frauen unter 50 Jahren ohne Brustkrebs in der Vorgeschichte randomisiert, davon 19 844 in den Screening-Arm [45-47, 54, 69]. Die Randomisierung erfolgte anhand geographischer Cluster mit vergleichbaren sozioökonomischen Strata. In Östergötland wurden zwölf Cluster-Paare für eine 1:1-Randomisierung gebildet, in Kopparberg sieben Cluster-Tripel für eine 2:1-Randomisierung. Frauen im Alter von 40 von 49 Jahren wurden im Abstand von 24 Monaten zu bis zu fünf Screening-Runden eingeladen [70]. Mittels analoger Mammographie wurden Aufnahmen in einer Ebene angefertigt (mediolateral olique). Die Aufnahmen wurden nur einfach befundet. An der ersten Screening-Runde nahmen 93 % der Frauen zwischen 40 und 49 Jahre teil [68]. Frauen in der Kontrollgruppe wurden nach dem Ende des Screenings der Screening-Gruppe (circa sieben Jahre nach der Randomisierung) zu einem einmaligen Screening eingeladen. Das letzte Mortalitäts-Follow-up fand Ende 1998 statt [45], zu diesem Zeitpunkt betrug die durchschnittliche Follow-up-Dauer für die Screening-Gruppe 13 Jahre. Auswertungen zur Brustkrebsmortalität nach dem Evaluationsmodell zeigten zu keinem Auswertungszeitpunkt eine statistisch signifikante Reduktion [46, 69].
U.K. Age Trial (UK Age)
Für die U.K. Age Trial wurden zwischen 1990 und 1996 Teilnehmerinnen im Alter von 39-41 Jahren rekrutiert [62, 63]. Insgesamt wurden 160 921 Frauen randomisiert (davon 53 914 in die Screening-Gruppe) [73, 75]. Mittels analoger Film-Mammographie wurden in der ersten Screening-Runde Aufnahmen in zwei Ebene angefertigt, anschließend in der Regel nur in einer Ebene (mediolateral olique) [75]. Die Aufnahmen wurden von zwei Personen befundet [75]. Die Frauen wurden bis zum Kalenderjahr des 48. Geburtstags im Abstand von 12 Monaten zum Screening eingeladen und erhielten im Mittel fünf Screening-Untersuchungen [39, 63]. Die durchschnittliche Teilnahme lag bei 69 % [75]. Die Kontrollgruppe erhielt kein Screening. Das letzte Mortalitäts-Follow-up fand Anfang 2017 statt, zu diesem Zeitpunkt waren die Frauen im Median 23 Jahre in der Studie eingeschlossen [73, 75]. Eine Auswertung zur Brustkrebsmortalität nach dem Evaluationsmodell zeigt eine statistisch nicht signifikante Reduktion von 12 % [75].
A.4 Im Rahmen der systematischen Literaturübersicht ausgeschlossene Volltexte mit Begründung
Die folgenden Volltext-Veröffentlichungen wurden anhand der Ausschlusskriterien in Kapitel 0 nicht berücksichtigt:
Breast-cancer screening with mammography in women aged 40-49 years. Swedish Cancer Society and the Swedish National Board of Health and Welfare. Int J Cancer, 1996. 68(6): p. 693-9. (Studie)
Ahn, S., et al., Impact of Screening Mammography on Treatment in Women Diagnosed with Breast Cancer. Ann Surg Oncol, 2018. 25(10): p. 2979-2986. (Studie)
Al-Shamsi, H.O., Mammography screening for breast cancer-the UK Age trial. Lancet Oncol, 2020. 21(11): p. e505. (Studie)
Alexander, F.E., The Edinburgh Randomized Trial of Breast Cancer Screening. J Natl Cancer Inst Monogr, 1997(22): p. 31-5. (Outcome)
Andersson, I., et al., Breast cancer screening in Sweden. The single modality approach. Radiologe, 1980. 20(12): p. 608-11. (Studie)
Baines, C.J., The Canadian National Breast Screening Study: a perspective on criticisms. Ann Intern Med, 1994. 120(4): p. 326-34. (Outcome)
Baines, C.J., D.V. McFarlane, and A.B. Miller, Sensitivity and specificity of first screen mammography in 15 NBSS centres. Can Assoc Radiol J, 1988. 39(4): p. 273-6. (Outcome)
Batur, P., In women aged 40 to 48 y, annual mammography vs. usual care reduced breast cancer mortality at 10 but not 23 y. Ann Intern Med, 2021. 174(2): p. Jc18. (VT fehlt)
Beau, A.B., et al., Limitations in the Effect of Screening on Breast Cancer Mortality. J Clin Oncol, 2018. 36(30): p. 2988-2994. (Studie)
Bell, K.J.L., et al., Mammography screening for breast cancer-the UK Age trial. Lancet Oncol, 2020. 21(11): p. e504. (Studie)
Berry, D.A., Benefits and risks of screening mammography for women in their forties: a statistical appraisal. J Natl Cancer Inst, 1998. 90(19): p. 1431-9. (Studie)
Bjurstam, N., et al., The Gothenburg Breast Cancer Screening Trial: preliminary results on breast cancer mortality for women aged 39-49. J Natl Cancer Inst Monogr, 1997(22): p. 53-5. (Update)
Bond, M., et al., Psychological consequences of false-positive screening mammograms in the UK. Evid Based Med, 2013. 18(2): p. 54-61. (Studie)
Braun, B., et al., The Mode of Detection Is Not Associated with Quality of Life in Women with Breast Cancer. Breast Care (Basel), 2020. 15(5): p. 498-505. (Studie)
Brett, J., et al., The psychological impact of mammographic screening. A systematic review. Psychooncology, 2005. 14(11): p. 917-38. (Studie)
Broeders, M.J.M., et al., The impact of mammography screening programmes on incidence of advanced breast cancer in Europe: a literature review. BMC Cancer, 2018. 18(1): p. 860. (Studie)
Bucchi, L., et al., Annual mammography at age 45-49 years and biennial mammography at age 50-69 years: comparing performance measures in an organised screening setting. Eur Radiol, 2019. 29(10): p. 5517-5527. (Studie)
Burton, R. and C. Stevenson, Assessment of Breast Cancer Mortality Trends Associated With Mammographic Screening and Adjuvant Therapy From 1986 to 2013 in the State of Victoria, Australia. JAMA Netw Open, 2020. 3(6): p. e208249. (Studie)
Chen, T.H., et al., Clarifying the debate on population-based screening for breast cancer with mammography: A systematic review of randomized controlled trials on mammography with Bayesian meta-analysis and causal model. Medicine (Baltimore), 2017. 96(3): p. e5684. (Studie)
Daoud, J., et al., A Comparative Study of Breast Cancer Screening by Age Across 10000 Tunisian Women. Rev Recent Clin Trials, 2016. 11(3): p. 273-7. (Studie)
de Munck, L., et al., Is the incidence of advanced-stage breast cancer affected by whether women attend a steady-state screening program? Int J Cancer, 2018. 143(4): p. 842-850. (Studie)
Desreux, J.A.C., Breast cancer screening in young women. Eur J Obstet Gynecol Reprod Biol, 2018. 230: p. 208-211. (Studie)
Donzelli, A., G. Giudicatti, and D. Sghedoni, Mammography screening for breast cancer-the UK Age trial. Lancet Oncol, 2020. 21(11): p. e509. (Studie)
Duffy, S.W., et al., Beneficial Effect of Consecutive Screening Mammography Examinations on Mortality from Breast Cancer: A Prospective Study. Radiology, 2021. 299(3): p. 541-547. (Studie)
Evans, A.J., et al., Radiological and pathological findings of interval cancers in a multi-centre, randomized, controlled trial of mammographic screening in women from age 40-41 years. Clin Radiol, 2007. 62(4): p. 348-52. (Outcome)
Fancher, C.E., et al., Mammographic Screening at Age 40 or 45? What Difference Does It Make? The Potential Impact of American Cancer Society Mammography Screening Guidelines. Am Surg, 2017. 83(8): p. 847-849. (Studie)
Frisell, J., et al., The Stockholm breast cancer screening trial–5-year results and stage at discovery. Breast Cancer Res Treat, 1989. 13(1): p. 79-87. (Alter)
Frisell, J., et al., Interval cancer and survival in a randomized breast cancer screening trial in Stockholm. Breast Cancer Res Treat, 1992. 24(1): p. 11-6. (Outcome)
Gera, R., M.J. Michell, and K. Mokbel, Mammography screening for breast cancer-the UK Age trial. Lancet Oncol, 2020. 21(11): p. e507. (Studie)
Harding, C., et al., Long-term relationships between screening rates, breast cancer characteristics, and overdiagnosis in US counties, 1975-2009. Int J Cancer, 2019. 144(3): p. 476-488. (Studie)
Hofvind, S., et al., False-positive results in mammographic screening for breast cancer in Europe: a literature review and survey of service screening programmes. J Med Screen, 2012. 19 Suppl 1: p. 57-66. (Studie)
Hofvind, S., S. Thoresen, and S. Tretli, The cumulative risk of a false-positive recall in the Norwegian Breast Cancer Screening Program. Cancer, 2004. 101(7): p. 1501-7. (Studie)
Hollingsworth, A., Overestimating Overdiagnosis in Breast Cancer Screening. Cureus, 2017. 9(1): p. e966. (Studie)
Holmberg, L.H., et al., Survival in Breast-Cancer Diagnosed between Mammographic Screening Examinations. Lancet, 1986. 2(8497): p. 27-30. (Alter)
Hovda, T., et al., True and Missed Interval Cancer in Organized Mammographic Screening: A Retrospective Review Study of Diagnostic and Prior Screening Mammograms. Acad Radiol, 2021. (Studie)
Huang, X., et al., A Bayesian Simulation Model for Breast Cancer Screening, Incidence, Treatment, and Mortality. Med Decis Making, 2018. 38(1_suppl): p. 78s-88s. (Studie)
Jacklyn, G., et al., Meta-analysis of breast cancer mortality benefit and overdiagnosis adjusted for adherence: improving information on the effects of attending screening mammography. Br J Cancer, 2016. 114(11): p. 1269-76. (Studie)
Jatoi, I., Mammography screening for breast cancer-the UK Age trial. Lancet Oncol, 2020. 21(11): p. e506. (Studie)
Johns, L.E., S.M. Moss, and G. Trial Management, Randomized controlled trial of mammographic screening from age 40 (‚Age‘ trial): patterns of screening attendance. J Med Screen, 2010. 17(1): p. 37-43. (Outcome)
Larsson, L.G., et al., Updated overview of the Swedish Randomized Trials on Breast Cancer Screening with Mammography: age group 40-49 at randomization. J Natl Cancer Inst Monogr, 1997(22): p. 57-61. (Studie)
Larsson, L.G., et al., The Swedish randomised mammography screening trials: analysis of their effect on the breast cancer related excess mortality. J Med Screen, 1996. 3(3): p. 129-32. (Studie)
Lidbrink, E.K., et al., The general mammography screening program in Stockholm. Organisation and first-round results. Acta Oncol, 1994. 33(4): p. 353-8. (Studie)
Mandrik, O., et al., Systematic reviews as a ‚lens of evidence‘: Determinants of benefits and harms of breast cancer screening. Int J Cancer, 2019. 145(4): p. 994-1006. (Studie)
Miller, A.B., Screening for breast cancer. Breast Cancer Res Treat, 1983. 3(2): p. 143-56. (Studie)
Miller, A.B., The costs and benefits of breast cancer screening. Am J Prev Med, 1993. 9(3): p. 175-80. (Studie)
Miller, A.B., Final results of the UK Age trial on breast cancer screening age. Lancet Oncol, 2020. 21(9): p. 1125-1126. (Studie)
Miller, A.B., C.J. Baines, and T. To, The Gothenburg breast screening trial: first results on mortality, incidence, and mode of detection for women ages 39-49 years at randomization. Cancer, 1998. 83(1): p. 186-90. (Studie)
Miller, A.B., G.R. Howe, and C. Wall, The National Study of Breast Cancer Screening Protocol for a Canadian Randomized Controlled trial of screening for breast cancer in women. Clin Invest Med, 1981. 4(3-4): p. 227-58. (Outcome)
Miller, A.B., et al., Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ, 2014. 348: p. g366. (Alter)
Møller, M.H., et al., Effect of organized mammography screening on breast cancer mortality: A population-based cohort study in Norway. Int J Cancer, 2019. 144(4): p. 697-706. (Studie)
Morrell, S., et al., Mammography service screening and breast cancer mortality in New Zealand: a National Cohort Study 1999-2011. Br J Cancer, 2017. 116(6): p. 828-839. (Studie)
Moss, S., A trial to study the effect on breast cancer mortality of annual mammographic screening in women starting at age 40. Trial Steering Group. J Med Screen, 1999. 6(3): p. 144-8. (Outcome)
Moss, S., et al., Randomised controlled trial of mammographic screening in women from age 40: predicted mortality based on surrogate outcome measures. Br J Cancer, 2005. 92(5): p. 955-60. (Outcome)
Narod, S.A., Mammography screening for breast cancer-the UK Age trial. Lancet Oncol, 2020. 21(11): p. e508. (Studie)
Nelson, H.D., et al., U.S. Preventive Services Task Force Evidence Syntheses, formerly Systematic Evidence Reviews, in Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA1/2-Related Cancer in Women: A Systematic Review for the U.S. Preventive Services Task Force. 2019, Agency for Healthcare Research and Quality (US): Rockville (MD). (Studie)
Nystrom, L., et al., Long-term effects of mammography screening: updated overview of the Swedish randomised trials. Lancet, 2002. 359(9310): p. 909-19. (Alter)
Nystrom, L., et al., Breast cancer screening with mammography: overview of Swedish randomised trials. Lancet, 1993. 341(8851): p. 973-8. (Studie)
Peairs, K.S., et al., Screening for breast cancer. Semin Oncol, 2017. 44(1): p. 60-72. (Studie)
Salas, D., et al., Effect of start age of breast cancer screening mammography on the risk of false-positive results. Prev Med, 2011. 53(1-2): p. 76-81. (Studie)
Salz, T., A.R. Richman, and N.T. Brewer, Meta-analyses of the effect of false-positive mammograms on generic and specific psychosocial outcomes. Psychooncology, 2010. 19(10): p. 1026-34. (Studie)
Sankatsing, V.D.V., et al., The effect of population-based mammography screening in Dutch municipalities on breast cancer mortality: 20 years of follow-up. Int J Cancer, 2017. 141(4): p. 671-677. (Studie)
Shaevitch, D., et al., Tumor size distribution of invasive breast cancers and the sensitivity of screening methods in the Canadian National Breast Screening Study. J Cancer Res Ther, 2017. 13(3): p. 562-569. (Outcome)
Shang, Y., et al., Intervention for reducing anxiety during screening mammography: A protocol for systematic review and meta-analysis. Medicine (Baltimore), 2020. 99(41): p. e22382. (Studie)
Shapiro, S., P. Strax, and L. Venet, Periodic breast cancer screening in reducing mortality from breast cancer. JAMA, 1971. 215(11): p. 1777-85.(Outcome)
Shapiro, S., et al., Selection, follow-up, and analysis in the Health Insurance Plan Study: a randomized trial with breast cancer screening. Natl Cancer Inst Monogr, 1985. 67: p. 65-74. (Outcome)
Shen, Y., et al., Estimating the frequency of indolent breast cancer in screening trials. Stat Methods Med Res, 2019. 28(4): p. 1261-1271. (Studie)
Shieh, Y., et al., Breast Cancer Screening in the Precision Medicine Era: risk-Based Screening in a Population-Based Trial. Journal of the National Cancer Institute, 2017. 109(5). (Studie)
Tabar, L., et al., Primary and adjuvant therapy, prognostic factors and survival in 1053 breast cancers diagnosed in a trial of mammography screening. Jpn J Clin Oncol, 1999. 29(12): p. 608-16. (Alter)
Tabar, L., et al., Recent results from the Swedish Two-County Trial: the effects of age, histologic type, and mode of detection on the efficacy of breast cancer screening. J Natl Cancer Inst Monogr, 1997(22): p. 43-7. (Outcome)
Tabar, L., et al., Effect of Mammography Screening on Mortality by Histological Grade. Cancer Epidemiol Biomarkers Prev, 2018. 27(2): p. 154-157. (Alter)
Tabar, L., et al., The incidence of fatal breast cancer measures the increased effectiveness of therapy in women participating in mammography screening. Cancer, 2019. 125(4): p. 515‐523. (Studie)
Tabar, L., S.W. Duffy, and L.W. Burhenne, New Swedish breast cancer detection results for women aged 40-49. Cancer, 1993. 72(4 Suppl): p. 1437-48. (Outcome)
Tabar, L., et al., Update of the Swedish two-county program of mammographic screening for breast cancer. Radiol Clin North Am, 1992. 30(1): p. 187-210. (VT fehlt)
Tabar, L., et al., Significant reduction in advanced breast cancer. Results of the first seven years of mammography screening in Kopparberg, Sweden. Diagn Imaging Clin Med, 1985. 54(3-4): p. 158-64. (VT fehlt)
Taghipour, S., et al., Using Simulation to Model and Validate Invasive Breast Cancer Progression in Women in the Study and Control Groups of the Canadian National Breast Screening Studies I and II. Med Decis Making, 2017. 37(2): p. 212-223. (Studie)
Tarone, R.E., The excess of patients with advanced breast cancer in young women screened with mammography in the Canadian National Breast Screening Study. Cancer, 1995. 75(4): p. 997-1003. (Outcome)
Taylor, R., et al., Breast cancer mortality and screening mammography in New Zealand: incidence-based and aggregate analyses. Journal of medical screening, 2019. 26(1): p. 35‐43. (Studie)
Tong, S., et al., Effect of mammography screening and sociodemographic factors on stage of female breast cancer at diagnosis in New South Wales. Aust Health Rev, 2020. 44(6): p. 944-951. (Studie)
Tóth, D., et al., Short- and Long-Term (10-year) Results of an Organized, Population-Based Breast Cancer Screening Program: Comparative, Observational Study from Hungary. World J Surg, 2018. 42(5): p. 1396-1402. (Studie)
Ujhelyi, M., et al., Does breast screening offer a survival benefit? A retrospective comparative study of oncological outcomes of screen detected and symptomatic early stage breast cancer cases. European journal of surgical oncology, 2016. 42(9): p. S83‐.(Studie)
Újhelyi, M., et al., Does breast screening offer a survival benefit? A retrospective comparative study of oncological outcomes of screen-detected and symptomatic early stage breast cancer cases. Eur J Surg Oncol, 2016. 42(12): p. 1814-1820. (Studie)
van Bommel, R., et al., Tumour characteristics of bilateral screen-detected cancers and bilateral interval cancers in women participating at biennial screening mammography. Eur J Radiol, 2018. 108: p. 215-221. (Studie)
van den Ende, C., et al., Benefits and harms of breast cancer screening with mammography in women aged 40-49 years: A systematic review. Int J Cancer, 2017. 141(7): p. 1295-1306. (Studie)
Večeřová, L., et al., Risk of Breast Cancer Revealed by Mammographic Screening in Czech Women Aged 40-45 Years, a Monocentric Cohort Study. Diagnostics (Basel), 2020. 10(9). (Studie)
Zackrisson, S., et al., Rate of over-diagnosis of breast cancer 15 years after end of Malmo mammographic screening trial: follow-up study. BMJ, 2006. 332(7543): p. 689-92. (Alter)
A.5 Ergebnisse zur Brustkrebsmortalität
Anhang A.5 – Tabelle 5-1: Brustkrebstodesfälle nach Altersgruppe und Follow-up-Zeitraum
| Studie | Follow-up-Dauer nach Randomisierung (nach Screening) [Jahre] |
Altersgruppe [Jahre] |
Teilnehmerinnen Screening [N] |
Brustkrebs- todesfälle Screening [N] |
Teilnehmerinnen Kontrolle [N] |
Brustkrebs- todesfälle Kontrolle [N] |
|---|---|---|---|---|---|---|
| CNBSS | 8,5 (4,5) | 40 bis 49 | 25246 | 38 | 25243 | 28 |
| 10,5 (6,5) | 40 bis 49 | 25246 | 82 | 25243 | 72 | |
| 13 (9,5) | 40 bis 49 | 25246 | 105 | 25243 | 108 | |
| 15,2 (11,2) | 40 bis 49 | 25246 | 134 | 25243 | 121 | |
| 10,5 | 40 bis 44 | k. A. | 32 | k. A. | 38 | |
| 10,5 | 45 bis 49 | k. A. | 50 | k. A. | 34 | |
| Edinburgh | 6 bis 10 (0 bis 3)* | 45 bis 49 | 11505 | 25 | 10269 | 31 |
| 10 bis 14 (4 bis 8) | 45 bis 49 | 11479 | 47 | 10267 | 53 | |
| Göteborg | 10 (4)* | 39 bis 49 | 11792 | 18 | 14321 | 40 |
| 10 bis 14 (4 bis 8) | 39 bis 49 | 11792 | 34 | 14321 | 59 | |
| 10 bis 14 (4 bis 8)* | 39 bis 49 | 11792 | 25 | 14321 | 46 | |
| 24 (18)* | 39 bis 49 | 11792 | 33 | 14321 | 68 | |
| 24 (18)* | 40 bis 49 | 10888 | 30 | 13203 | 62 | |
| 10 bis 14 | 39 bis 44 | k. A. | 17 | k. A. | 30 | |
| 10 bis 14 | 45 bis 49 | k. A. | 17 | k. A. | 29 | |
| HIP | 5 (2) | 40 bis 49 | 13740 | 19 | 13740 | 20 |
| 9 (6) | 40 bis 49 | 13740 | 39 | 13740 | 48 | |
| 14 (11) | 40 bis 49 | 13740 | 46 | 13740 | 61 | |
| 18 (≥ 15) | 40 bis 49 | 13740 | 67 | 13740 | 87 | |
| 14 (11) | 40 bis 44 | 6500 | 27 | 6500 | 39 | |
| 18 (15) | 40 bis 44 | 6500 | 18 | 6500 | 28 | |
| 14 (11) | 45 bis 49 | 7240 | 37 | 7240 | 43 | |
| 18 (15) | 45 bis 49 | 7240 | 31 | 7240 | 37 | |
| Malmö I+II | 10 bis 15,5 (≥ 1,5)* | 40 bis 49 | 13528 | 57 | 12242 | 78 |
| 29,8 (≥ 15,8)* | 40 bis 49 | 13568 | 64 | 12279 | 72 | |
| Malmö I | 29,8 (≥ 15,8)* | 45 bis 49 | 3987 | 24 | 4067 | 34 |
| Malmö II | 29,8 (≥ 15,8)* | 43 bis 44 | 3857 | 20 | 2923 | 12 |
| 29,8 (≥ 15,8)* | 45 bis 49 | 5724 | 20 | 5289 | 26 | |
| 29,8 (≥ 15,8)* | 43 bis 49 | 9581 | 40 | 8212 | 38 | |
| Stockholm | 7,4 (3,8) | 40 bis 49 | 14375 | 16 | 7103 | 8 |
| 11,4 (7,8) | 40 bis 49 | 14842 | 24 | 7103 | 12 | |
| Two-County | 5,5* | 40 bis 49 | 19844 | 16 | 15604 | 10 |
| 7,5* | 40 bis 49 | 19844 | 28 | 15604 | 24 | |
| 13* | 40 bis 49 | 19844 | 45 | 15604 | 39 | |
| 20* | 40 bis 49 | 19844 | 57 | 15604 | 48 | |
| UK Age | 10,7 (3,7) | 39 bis 41 | 53914 | 105 | 107007 | 251 |
| 17,7 (10,7)* | 39 bis 41 | 53914 | 182 | 107007 | 412 | |
| 17,7 (10,7) | 39 bis 41 | 53914 | 242 | 107007 | 515 | |
| 22,8 (15,8)* | 39 bis 41 | 53914 | 209 | 107007 | 474 | |
| 22,8 (15,8) | 39 bis 41 | 53914 | 338 | 107007 | 743 |
* Evaluationsmodell, alle anderen: Follow-up-Modell oder unklar
k. A.: keine Angabe
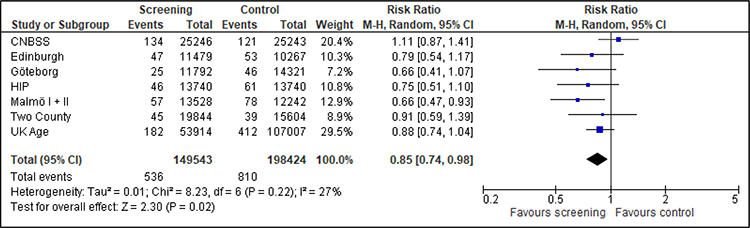
Anhang A.5 – Abbildung 9: Brustkrebsmortalität für Frauen unter 50 Jahren mit einer Follow-up-Dauer von circa 15 Jahren
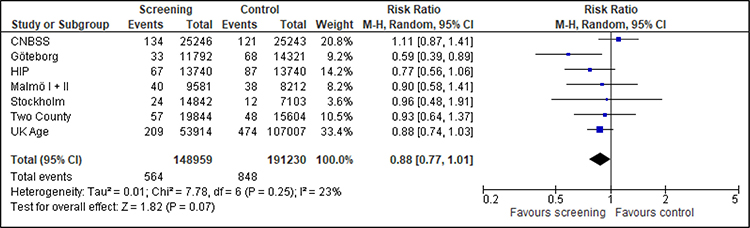
Anhang A.5 – Abbildung 10: Brustkrebsmortalität für Frauen unter 50 Jahren nach maximalem Follow-up (15 bis 30 Jahre)
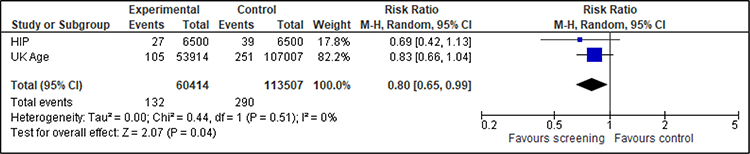
Anhang A.5 – Abbildung 11: Brustkrebsmortalität für Frauen unter 45 Jahren
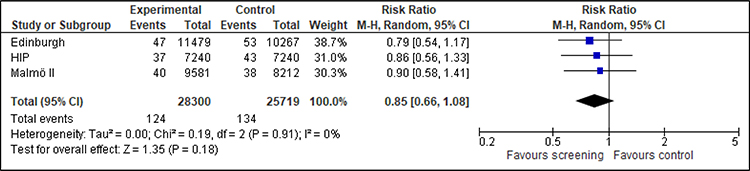
Anhang A.5 – Abbildung 12: Brustkrebsmortalität für Frauen von 45 bis 49 Jahren
Abkürzungsverzeichnis
| BEIR | Biological Effects of Ionising Radiation |
| BfS | Bundesamt für Strahlenschutz |
| BMUV | Bundesministerium für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz |
| CAD | computer-aided-diagnosis, computer-aided-decision |
| CI | confidence interval |
| CNBSS-1 | Canadian National Breast Screening Study 1 |
| DDREF | dose and dose rate effectiveness factor |
| ECIBC | European Commission Initiative on Breast Cancer |
| GDG | Guidelines Development Group |
| HIP | Health Insurance Plan |
| IARC | International Agency for Research on Cancer |
| ICRP | International Commission on Radiological Protection |
| IQWiG | Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen |
| KI | Konfidenzintervall |
| LAR | lifetime attributable risk |
| LNT | linear no threshold |
| LSS | Life Span Study der japanischen Atombombenüberlebenden (im Text ,japanische LSSʻ) |
| MSP | Mammographie-Screening-Programm |
| PICOS | Population, Intervention, Comparator, Outcome (Zielkriterien), Studientypen |
| PRISMA | Preferred Reporting Items for Systematic Reviews and Meta-Analyses |
| RCT | randomized controlled trial |
| RR | risk ratio |
| SSK | Strahlenschutzkommission |
| StrlSchG | Strahlenschutzgesetz |
| StrlSchGVwV- Früherkennung |
Allgemeine Verwaltungsvorschrift zur wissenschaftlichen Bewertung von Früherkennungsuntersuchungen zur Ermittlung nicht übertragbarer Krankheiten |
| USPSTF | U. S. Preventive Services Task Force |
| WHO | World Health Organization |
Abbildungsverzeichnis
| Abbildung 1: | PRISMA-Flussdiagramm der Literaturselektion |
| Abbildung 2: | Bewertung des Verzerrungsrisikos für den Endpunkt (Brustkrebs-)Mortalität |
| Abbildung 3: | Forest-Plot-Brustkrebsmortalität für Frauen unter 50 Jahren bei einer Follow-up-Dauer von 6 bis 14 Jahren |
| Abbildung 4: | Forest-Plot-Gesamtmortalität für Frauen unter 50 Jahren bei einer Follow-up-Dauer von 8 bis 23 Jahren |
| Abbildung 5: | Zusätzliches Lebenszeitrisiko LAR (Krebsinzidenz) in Abhängigkeit vom Alter bei Exposition nach einmaliger Exposition mit einer mittleren Brustdosis von 2,7 mSv nach dem LSS-Modell (oben; hellgrün), dem BfS-Ansatz (Mitte; blau) und dem Metaanalyse-Modell (unten; dunkelgrün) |
| Abbildung 6: | Zusätzliches Lebenszeitrisiko LAR (Krebsinzidenz) nach dem BfS-Ansatz in Abhängigkeit vom Alter bei Screening-Beginn unter Annahme eines zweijährlichen Mammographie-Screenings (mittlere Brustdosis = 2,7 mSv pro Runde) |
| Abbildung 7: | Nutzen-Risiko-Verhältnis nach dem BfS-Ansatz in Abhängigkeit vom Alter bei Screening-Beginn unter Annahme einer Reduktion der Brustkrebsmortalität von 18 % für ein zweijährliches Mammographie-Screening zwischen 40 und 49 Jahren und von 25 % für ein zweijährliches Screening zwischen 50 und 69 Jahren (mittlere Brustdosis = 2,7 mSv pro Runde) |
| Abbildung 8: | Nutzen-Risiko-Verhältnis nach dem BfS-Ansatz in Abhängigkeit vom Alter bei Screening-Beginn unter Annahme einer Reduktion der Brustkrebsmortalität von 18 % für ein zweijährliches Mammographie-Screening zwischen 40 und 49 Jahren und von 25 % für ein zweijährlich Screening zwischen 50 und 69 Jahren für verschiedene Screening-Szenarien (mittlere Brustdosis = 2,7 mSv pro Runde) |
| Anhang A.5 – Abbildung 9: | Brustkrebsmortalität für Frauen unter 50 Jahren mit einer Follow-up-Dauer von circa 15 Jahren |
| Anhang A.5 – Abbildung 10: | Brustkrebsmortalität für Frauen unter 50 Jahren nach maximalem Follow-up (15 bis 30 Jahre) |
| Anhang A.5 – Abbildung 11: | Brustkrebsmortalität für Frauen unter 45 Jahren |
| Anhang A.5 – Abbildung 12: | Brustkrebsmortalität für Frauen von 45 bis 49 Jahren |
Tabellenverzeichnis
| Tabelle 2.2-1: | Forschungsfrage im PICOS-Schema |
| Tabelle 2.2-2: | Ein- und Ausschlusskriterien der Literaturselektion |
| Tabelle 2.2-3: | Studiendesign und Einschlusskriterien |
| Tabelle 2.2-4: | Intervention |
| Tabelle 2.2-5: | Charakteristika der Studienpopulation |
| Tabelle 2.2-6: | Brustkrebsinzidenz und -raten (berechnet pro 1 000 Teilnehmerinnen) |
| Tabelle 2.2-7: | Stadienverteilung und Raten (berechnet pro 1 000 Teilnehmerinnen) |
| Tabelle 2.2-8: | Stadienverteilung als Anzahl (Anteil) der diagnostizierten Tumoren je Studiengruppe in der HIP-Studie |
| Tabelle 2.2-9: | Überdiagnose |
| Tabelle 2.2-10: | Abklärungsdiagnostik |
| Tabelle 2.2-11: | Konsequenzen falsch-positiver Screening-Ergebnisse |
| Tabelle 3.2-1: | Unterschiede zwischen dem BEIR-VII-Ansatz und dem BfS-Ansatz |
| Anhang A.1 – Tabelle 1-1: | Recherchesyntax in PubMed für systematische Übersichtsarbeiten |
| Anhang A.1 – Tabelle 1-2: | Recherchesyntax in PubMed für RCT mit RCT-Filter nach Cochrane-Handbuch |
| Anhang A.2 – Tabelle 2-1: | In die systematische Literaturübersicht eingeschlossene Publikationen |
| Anhang A.5 – Tabelle 5-1: | Brustkrebstodesfälle nach Altersgruppe und Follow-up-Zeitraum |
Literaturverzeichnis
- 1.
-
Bundesministerium für Umwelt, Naturschutz und nukleare Sicherheit (2018): Allgemeine Verwaltungsvorschrift zur wissenschaftlichen Bewertung von Früherkennungsuntersuchungen zur Ermittlung nicht übertragbarer Krankheiten (StrlSchGVwV-Früherkennung) vom 12. Dezember 2018.
- 2.
-
RKI (2021): Krebs in Deutschland für 2017/2018.
- 3.
-
Checka, C.M., Chun, J.E., Schnabel, F.R., et al. (2012): The relationship of mammographic density and age: implications for breast cancer screening. AJR Am J Roentgenol 198 (3): W292-295.
- 4.
-
Sprague, B.L., Conant, E.F., Onega, T., et al. (2016): Variation in Mammographic Breast Density Assessments Among Radiologists in Clinical Practice: A Multicenter Observational Study. Ann Intern Med 165 (7): 457-464.
- 5.
-
Pisano, E.D., Gatsonis, C., Hendrick, E., et al. (2005): Diagnostic performance of digital versus film mammography for breast-cancer screening. N Engl J Med 353 (17): 1773-1783.
- 6.
-
Patnick, J. (2004): NHS breast screening: the progression from one to two views. J Med Screen 11 (2): 55-56.
- 7.
-
van Breest Smallenburg, V., Duijm, L.E., den Heeten, G.J., et al. (2012): Two-view versus single-view mammography at subsequent screening in a region of the Dutch breast screening programme. Eur J Radiol 81 (9): 2189-2194.
- 8.
-
Wald, N.J., Murphy, P., Major, P., et al. (1995): UKCCCR multicentre randomised controlled trial of one and two view mammography in breast cancer screening. BMJ 311 (7014): 1189-1193.
- 9.
-
International Agency for Research on Cancer (IARC) (2016): IARC Handbooks of Cancer Prevention. Volume 15: Breast Cancer Screening.
- 10.
-
G-BA (2020): Richtlinie des Gemeinsamen Bundesausschusses über die Früherkennung von Krebserkrankungen.
- 11.
-
WHO (2014): WHO Position Paper on Mammography Screening.
- 12.
-
ECIBC (2023): European guidelines on breast cancer screening and diagnosis (40-49).
https://healthcare-quality.jrc.ec.europa.eu/ecibc/european-breast-cancer-guidelines/screening-ages-and-frequencies [Zugriff: 31. Oktober 2022]. - 13.
-
Science Advice for Policy by European Academies (SAPEA) (2022): Improving cancer screening in the European Union.
- 14.
-
Siu, A.L., U.S. Preventive Services Task Force (2016): Screening for Breast Cancer: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 164 (4): 279-296.
- 15.
-
Henderson, J.T., Webber, E.M., Weyrich, M., et al. (2023): DRAFT – Screening for Breast Cancer: A Comparative Effectiveness Review for the U.S. Preventive Services Task Force.
- 16.
-
AWMF (2021): Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms.
- 17.
-
Basu, P., Ponti, A., Anttila, A., et al. (2018): Status of implementation and organization of cancer screening in The European Union Member States-Summary results from the second European screening report. Int J Cancer 142 (1): 44-56.
- 18.
-
Moher, D., Liberati, A., Tetzlaff, J., et al. (2009): Preferred reporting items for systematic reviews and meta-analyses: the PRISMA statement. BMJ 339: b2535.
- 19.
-
Higgins, J., Thomas, J., Chandler, J., et al. Cochrane Handbook for Systematic Reviews of Interventions version 6.0 (2019). https://training.cochrane.org/handbook [Zugriff: 11. Oktober 2022].
- 20.
-
Sterne, J.A.C., Savovic, J., Page, M.J., et al. (2019): RoB 2: a revised tool for assessing risk of bias in randomised trials. BMJ 366: l4898.
- 21.
-
Canelo-Aybar, C., Ferreira, D.S., Ballesteros, M., et al. (2021): Benefits and harms of breast cancer mammography screening for women at average risk of breast cancer: A systematic review for the European Commission Initiative on Breast Cancer. J Med Screen: 969141321993866.
- 22.
-
Andersson, I., Aspegren, K., Janzon, L., et al. (1988): Mammographic screening and mortality from breast cancer: the Malmo mammographic screening trial. BMJ 297 (6654): 943-948.
- 23.
-
Bjurstam, N., Bjorneld, L., Duffy, S.W., et al. (1997): The Gothenburg breast screening trial: first results on mortality, incidence, and mode of detection for women ages 39-49 years at randomization. Cancer 80 (11): 2091-2099.
- 24.
-
Bjurstam, N., Bjorneld, L., Warwick, J., et al. (2003): The Gothenburg Breast Screening Trial. Cancer 97 (10): 2387-2396.
- 25.
-
Bjurstam, N.G., Bjorneld, L.M., Duffy, S.W. (2016): Updated results of the Gothenburg Trial of Mammographic Screening. Cancer 122 (12): 1832-1835.
- 26.
-
Bond, M., Pavey, T., Welch, K., et al. (2013): Systematic review of the psychological consequences of false-positive screening mammograms. Health Technol Assess 17 (13): 1-170, v-vi.
- 27.
-
Brett, J., Bankhead, C., Henderson, B., et al. (2005): The psychological impact of mammographic screening. A systematic review. Psychooncology 14 (11): 917-938.
- 28.
-
Chu, K.C., Smart, C.R., Tarone, R.E. (1988): Analysis of breast cancer mortality and stage distribution by age for the Health Insurance Plan clinical trial. J Natl Cancer Inst 80 (14): 1125-1132.
- 29.
-
Frisell, J., Glas, U., Hellstrom, L., et al. (1986): Randomized mammographic screening for breast cancer in Stockholm. Design, first round results and comparisons. Breast Cancer Res Treat 8 (1): 45-54.
- 30.
-
Frisell, J., Lidbrink, E., Hellstrom, L., et al. (1997): Followup after 11 years–update of mortality results in the Stockholm mammographic screening trial. Breast Cancer Res Treat 45 (3): 263-270.
- 31.
-
Habbema, J.D., van Oortmarssen, G.J., van Putten, D.J., et al. (1986): Age-specific reduction in breast cancer mortality by screening: an analysis of the results of the Health Insurance Plan of Greater New York study. J Natl Cancer Inst 77 (2): 317-320.
- 32.
-
Hofvind, S., Ponti, A., Patnick, J., et al. (2012): False-positive results in mammographic screening for breast cancer in Europe: a literature review and survey of service screening programmes. J Med Screen 19 Suppl 1: 57-66.
- 33.
-
Hofvind, S., Thoresen, S., Tretli, S. (2004): The cumulative risk of a false-positive recall in the Norwegian Breast Cancer Screening Program. Cancer 101 (7): 1501-1507.
- 34.
-
Miller, A.B. (1993): The costs and benefits of breast cancer screening. Am J Prev Med 9 (3): 175-180.
- 35.
-
Miller, A.B., Baines, C.J., To, T., et al. (1992): Canadian National Breast Screening Study: 1. Breast cancer detection and death rates among women aged 40 to 49 years. CMAJ 147 (10): 1459-1476.
- 36.
-
Miller, A.B., To, T., Baines, C.J., et al. (2002): The Canadian National Breast Screening Study-1: breast cancer mortality after 11 to 16 years of follow-up. A randomized screening trial of mammography in women age 40 to 49 years. Ann Intern Med 137 (5 Part 1): 305-312.
- 37.
-
Miller, A.B., Wall, C., Baines, C.J., et al. (2014): Twenty five year follow-up for breast cancer incidence and mortality of the Canadian National Breast Screening Study: randomised screening trial. BMJ 348: g366.
- 38.
-
Moss, S., Waller, M., Anderson, T.J., et al. (2005): Randomised controlled trial of mammographic screening in women from age 40: predicted mortality based on surrogate outcome measures. Br J Cancer 92 (5): 955-960.
- 39.
-
Moss, S.M., Wale, C., Smith, R., et al. (2015): Effect of mammographic screening from age 40 years on breast cancer mortality in the UK Age trial at 17 years‘ follow-up: a randomised controlled trial. Lancet Oncol 16 (9): 1123-1132.
- 40.
-
Nystrom, L., Andersson, I., Bjurstam, N., et al. (2002): Long-term effects of mammography screening: updated overview of the Swedish randomised trials. Lancet 359 (9310): 909-919.
- 41.
-
Salas, D., Ibanez, J., Roman, R., et al. (2011): Effect of start age of breast cancer screening mammography on the risk of false-positive results. Prev Med 53 (1-2): 76-81.
- 42.
-
Salz, T., Richman, A.R., Brewer, N.T. (2010): Meta-analyses of the effect of false-positive mammograms on generic and specific psychosocial outcomes. Psychooncology 19 (10): 1026-1034.
- 43.
-
Shapiro, S. (1997): Periodic screening for breast cancer: the HIP Randomized Controlled Trial. Health Insurance Plan. J Natl Cancer Inst Monogr (22): 27-30.
- 44.
-
Tabar, L., Chen, H.H., Duffy, S.W., et al. (1999): Primary and adjuvant therapy, prognostic factors and survival in 1053 breast cancers diagnosed in a trial of mammography screening. Jpn J Clin Oncol 29 (12): 608-616.
- 45.
-
Tabar, L., Duffy, S.W., Yen, M.F., et al. (2002): All-cause mortality among breast cancer patients in a screening trial: support for breast cancer mortality as an end point. J Med Screen 9 (4): 159-162.
- 46.
-
Tabar, L., Fagerberg, G., Chen, H.H., et al. (1995): Efficacy of breast cancer screening by age. New results from the Swedish Two-County Trial. Cancer 75 (10): 2507-2517.
- 47.
-
Tabar, L., Fagerberg, G., Duffy, S.W., et al. (1989): The Swedish two county trial of mammographic screening for breast cancer: recent results and calculation of benefit. J Epidemiol Community Health 43 (2): 107-114.
- 48.
-
Zackrisson, S., Andersson, I., Janzon, L., et al. (2006): Rate of over-diagnosis of breast cancer 15 years after end of Malmo mammographic screening trial: follow-up study. BMJ 332 (7543): 689-692.
- 49.
-
Alexander, F.E., Anderson, T.J., Brown, H.K., et al. (1999): 14 years of follow-up from the Edinburgh randomised trial of breast-cancer screening. Lancet 353 (9168): 1903-1908.
- 50.
-
Alexander, F.E., Anderson, T.J., Brown, H.K., et al. (1994): The Edinburgh Randomized Trial of Breast-Cancer Screening – Results after 10 Years of Follow-Up. British Journal of Cancer 70 (3): 542-548.
- 51.
-
Andersson, I. (1981): Radiographic screening for breast carcinoma. I. Program and primary findings in 45–69 year old women. Acta Radiol Diagn (Stockh) 22 (2): 185-194.
- 52.
-
Andersson, I., Janzon, L. (1997): Reduced breast cancer mortality in women under age 50: updated results from the Malmo Mammographic Screening Program. J Natl Cancer Inst Monogr (22): 63-67.
- 53.
-
Aron, J.L., Prorok, P.C. (1986): An analysis of the mortality effect in a breast cancer screening study.Int J Epidemiol 15 (1): 36-43.
- 54.
-
Duffy, S.W., Tabar, L., Vitak, B., et al. (2003): The Swedish Two-County Trial of mammographic screening: cluster randomisation and end point evaluation. Ann Oncol 14 (8): 1196-1198.
- 55.
-
Fagerberg, G., Baldetorp, L., Grontoft, O., et al. (1985): Effects of repeated mammographic screening on breast cancer stage distribution. Results from a randomised study of 92 934 women in a Swedish county. Acta Radiol Oncol 24 (6): 465-473.
- 56.
-
Frisell, J., Eklund, G., Hellstrom, L., et al. (1991): Randomized study of mammography screening–preliminary report on mortality in the Stockholm trial. Breast Cancer Res Treat 18 (1): 49-56.
- 57.
-
Frisell, J., Eklund, G., Hellstrom, L., et al. (1987): Analysis of interval breast carcinomas in a randomized screening trial in Stockholm. Breast Cancer Res Treat 9 (3): 219-225.
- 58.
-
Frisell, J., Lidbrink, E. (1997): The Stockholm Mammographic Screening Trial: Risks and benefits in age group 40-49 years. J Natl Cancer Inst Monogr (22): 49-51.
- 59.
-
Johns, L.E., Moss, S.M., Age Trial Management, G. (2010): False-positive results in the randomized controlled trial of mammographic screening from age 40 („Age“ trial). Cancer Epidemiol Biomarkers Prev 19 (11): 2758-2764.
- 60.
-
Lidbrink, E., Elfving, J., Frisell, J., et al. (1996): Neglected aspects of false positive findings of mammography in breast cancer screening: analysis of false positive cases from the Stockholm trial. BMJ 312 (7026): 273-276.
- 61.
-
Miller, A.B., To, T., Baines, C.J., et al. (1997): The Canadian National Breast Screening Study: update on breast cancer mortality. J Natl Cancer Inst Monogr (22): 37-41.
- 62.
-
Moss, S., Thomas, I., Evans, A., et al. (2005): Randomised controlled trial of mammographic screening in women from age 40: results of screening in the first 10 years. Br J Cancer 92 (5): 949-954.
- 63.
-
Moss, S.M., Cuckle, H., Evans, A., et al. (2006): Effect of mammographic screening from age 40 years on breast cancer mortality at 10 years‘ follow-up: a randomised controlled trial. Lancet 368 (9552): 2053-2060.
- 64.
-
Narod, S.A., Sun, P., Wall, C., et al. (2014): Impact of screening mammography on mortality from breast cancer before age 60 in women 40 to 49 years of age. Curr Oncol 21 (5): 217-221.
- 65.
-
Roberts, M.M., Alexander, F.E., Anderson, T.J., et al. (1990): Edinburgh trial of screening for breast cancer: mortality at seven years. Lancet 335 (8684): 241-246.
- 66.
-
Shapiro, S. (1977): Evidence on screening for breast cancer from a randomized trial. Cancer 39 (6 Suppl): 2772-2782.
- 67.
-
Shapiro, S., Venet, W., Strax, P., et al. (1982): Ten- to fourteen-year effect of screening on breast cancer mortality. J Natl Cancer Inst 69 (2): 349-355.
- 68.
-
Tabar, L., Fagerberg, C.J., Gad, A., et al. (1985): Reduction in mortality from breast cancer after mass screening with mammography. Randomised trial from the Breast Cancer Screening Working Group of the Swedish National Board of Health and Welfare. Lancet 1 (8433): 829-832.
- 69.
-
Tabar, L., Fagerberg, G., Chen, H.H., et al. (1995): Screening for breast cancer in women aged under 50: mode of detection, incidence, fatality, and histology. J Med Screen 2 (2): 94-98.
- 70.
-
Tabar, L., Vitak, B., Chen, H.H., et al. (2000): The Swedish Two-County Trial twenty years later. Updated mortality results and new insights from long-term follow-up. Radiol Clin North Am 38 (4): 625-651.
- 71.
-
Baines, C.J., To, T., Miller, A.B. (2016): Revised estimates of overdiagnosis from the Canadian National Breast Screening Study. Prev Med 90: 66-71.
- 72.
-
Duffy, S.W., Tabar, L., Yen, A.M., et al. (2020): Mammography screening reduces rates of advanced and fatal breast cancers: Results in 549,091 women. Cancer 126 (13): 2971-2979.
- 73.
-
Duffy, S.W., Vulkan, D., Cuckle, H., et al. (2020): Effect of mammographic screening from age 40 years on breast cancer mortality (UK Age trial): final results of a randomised, controlled trial. Lancet Oncol 21 (9): 1165-1172.
- 74.
-
Nystrom, L., Bjurstam, N., Jonsson, H., et al. (2017): Reduced breast cancer mortality after 20+ years of follow-up in the Swedish randomized controlled mammography trials in Malmo, Stockholm, and Goteborg. J Med Screen 24 (1): 34-42.
- 75.
-
Duffy, S., Vulkan, D., Cuckle, H., et al. (2020): Annual mammographic screening to reduce breast cancer mortality in women from age 40 years: long-term follow-up of the UK Age RCT. Health technology assessment (Winchester, England) 24 (55): 1‐24.
- 76.
-
Puliti, D., Duffy, S.W., Miccinesi, G., et al. (2012): Overdiagnosis in mammographic screening for breast cancer in Europe: a literature review. J Med Screen 19 Suppl 1: 42-56.
- 77.
-
Carter, J.L., Coletti, R.J., Harris, R.P. (2015): Quantifying and monitoring overdiagnosis in cancer screening: a systematic review of methods. BMJ 350: g7773.
- 78.
-
Kääb-Sanyal, V., Hand, E. (2021): Jahresbericht Evaluation 2019 – Deutsches Mammographie-Screening-Programm.
- 79.
-
Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) (2022): Abschlussbericht – Überprüfung der Altersgrenzen im Mammographie-Screening-Programm. IQWiG-Berichte – Nr. 1383.
- 80.
-
Hand, E. (2022): Jahresbericht Evaluation 2020 – Deutsches Mammographie-Screening-Programm.
- 81.
-
Dinnes, J., Moss, S., Melia, J., et al. (2001): Effectiveness and cost-effectiveness of double reading of mammograms in breast cancer screening: findings of a systematic review. Breast 10 (6): 455-463.
- 82.
-
von Euler-Chelpin, M., Lillholm, M., Napolitano, G., et al. (2018): Screening mammography: benefit of double reading by breast density. Breast Cancer Res Treat 171 (3): 767-776.
- 83.
-
International Commission on Radiological Protection (2008): The 2007 Recommendations of the International Commission on Radiological Protection. Ann ICRP 37: 2-4.
- 84.
-
National Research Council (2006): Health Risks from Exposure to Low Levels of Ionizing Radiation: BEIR VII Phase 2. https://www.nap.edu/catalog/11340/health-risks-from-exposure-to-low-levels-of-ionizing-radiation [Zugriff: 11. Oktober 2022].
- 85.
-
Strahlenschutzkommission (2014): Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF) – Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung.
https://www.ssk.de/SharedDocs/Beratungsergebnisse_PDF/2014/DDREF.pdf [Zugriff: 5. Juni 2020]. - 86.
-
Ozasa, K., Grant, E.J., Kodama, K. (2018): Japanese Legacy Cohorts: The Life Span Study Atomic Bomb Survivor Cohort and Survivors‘ Offspring. J Epidemiol 28 (4): 162-169.
- 87.
-
Nekolla E. A., Griebel J., Brix G. (2008): Strahlenrisiko infolge von Mammographie-Screening-Untersuchungen für Frauen unter 50 Jahren. Z Med Phys 18 (3): 170-179.
- 88.
-
Strahlenschutzkommission (2008): Evaluierung von Nutzen und Risiken im qualitätsgesicherten Mammographie-Screening in Deutschland – Empfehlung der Strahlenschutzkommission.
https://www.ssk.de/SharedDocs/Beratungsergebnisse_PDF/2008/Nutzen_Mammographiescreening.pdf?__blob=publicationFile [Zugriff: 5. Juni 2020]. - 89.
-
Preston, D.L., Mattsson, A., Holmberg, E., et al. (2002): Radiation effects on breast cancer risk: a pooled analysis of eight cohorts. Radiat Res 158 (2): 220-235.
- 90.
-
Strahlenschutz, B.f. (2022): Brustkrebsfrüherkennung mittels Röntgenmammographie bei Frauen ab 70 Jahren: Wissenschaftliche Bewertung des Bundesamtes für Strahlenschutz gemäß § 84 Absatz 3 Strahlenschutzgesetz.
- 91.
-
Nekolla, E.A., Brix, G., Griebel, J. (2022): Lung Cancer Screening with Low-Dose CT: Radiation Risk and Benefit-Risk Assessment for Different Screening Scenarios. Diagnostics (Basel) 12 (2).
- 92.
-
Miglioretti, D.L., Lange, J., van den Broek, J.J., et al. (2016): Radiation-Induced Breast Cancer Incidence and Mortality From Digital Mammography Screening: A Modeling Study. Ann Intern Med 164 (4): 205-214.
- 93.
-
Canelo-Aybar, C., Posso, M., Montero, N., et al. (2021): Benefits and harms of annual, biennial, or triennial breast cancer mammography screening for women at average risk of breast cancer: a systematic review for the European Commission Initiative on Breast Cancer (ECIBC). Br J Cancer.
- 94.
-
EC IBC (2019): European guidelines on breast cancer screening and diagnosis (70-74).
https://healthcare-quality.jrc.ec.europa.eu/european-breast-cancer-guidelines/screening-ages-and-frequencies [Zugriff: 21. Februar 2022].











Kommentar hinterlassen