Bundesministerium
für Umwelt, Naturschutz, nukleare Sicherheit
und Verbraucherschutz
Bekanntmachung
einer Empfehlung der Strahlenschutzkommission
Therapeutische Verfahren in der Nuklearmedizin
Nachfolgend wird die Empfehlung der Strahlenschutzkommission (SSK), verabschiedet in der 321. Sitzung der Kommission am 22./23. September 2022, bekannt gegeben (Anlage).
S II 2 – 1702/004-2022.0004
Bundesministerium
für Umwelt, Naturschutz, nukleare Sicherheit
und Verbraucherschutz
Im Auftrag
Engelhardt
Therapeutische Verfahren in der Nuklearmedizin
Empfehlung der Strahlenschutzkommission
mit wissenschaftlicher Begründung
Verabschiedet in der 321. Sitzung der Strahlenschutzkommission
am 22./23. September 2022
Vorwort
Nicht nur in der bildgebenden Diagnostik, sondern auch in der therapeutischen Anwendung von radioaktiven Stoffen ist im medizinischen Fachgebiet der Nuklearmedizin eine starke Entwicklung zu beobachten. Es stehen neben der Radioiodtherapie der Schilddrüsenerkrankungen heute auch viele andere neuartige Optionen, z. B. zur Behandlung onkologischer Erkrankungen, zur Verfügung. Dies umfasst auch Verfahren, die dezentral in den behandelnden Kliniken durch die behandelnden Ärztinnen und Ärzte im Rahmen der sogenannten erlaubnisfreien Herstellung unter der direkten fachlichen Verantwortung der therapierenden Ärztinnen und Ärzte produziert und angewendet werden. Die Eignung von Patientinnen und Patienten für diese Therapien wird oftmals individuell über einen bildgebenden Test unter Verwendung einer identischen oder sehr ähnlichen Trägersubstanz mit diagnostischer Radiomarkierung überprüft (sogenannte Thera(g)nostik). Konzeptionell kann man bei diesen Verfahren eher von einer hochselektiven, lokal zielgerichteten internen Strahlenbehandlung als von einer pharmakologischen Therapie sprechen. Für einige dieser Therapien ist gerade bei schwerwiegenden Tumorerkrankungen Wirksamkeit auch dann dokumentiert, wenn andere therapeutische Optionen nicht mehr greifen.
Um einen Überblick über aktuell in der Nuklearmedizin gängige therapeutische Verfahren, deren Art der Durchführung und über die erforderlichen zugehörigen Voraussetzungen und klinischen Standards zu gewinnen, hat das Bundesministerium für Umwelt, Naturschutz und nukleare Sicherheit (BMU) die Strahlenschutzkommission (SSK) am 5. Februar 2019 um Erarbeitung einer Zusammenstellung aktuell gängiger Weise in der Nuklearmedizin therapeutisch angewendeter radioaktiver Stoffe gebeten. Die Arbeitsgruppe hat eine Übersicht derzeit genutzter Therapien erstellt und in tabellarischer Form alle für den Strahlenschutz relevanten Aspekte, wie z. B. gegebenenfalls auftretende Begleitnuklide und typische Bereiche der individuell zu applizierenden Aktivität, aufgelistet.
An der Erarbeitung der resultierenden Empfehlung haben folgende Mitglieder der Arbeitsgruppe „Nuklide in der Nukleartheraphie“ des Ausschusses „Strahlenschutz in der Medizin“ mitgewirkt:
- –
-
Prof. Dr. Dr. Dr. Andreas Bockisch, Universitätsklinikum Essen
- –
-
Prof. Dr. Andreas Buck, Universitätsklinikum Würzburg
- –
-
Prof. Dr. Wolfgang Burchert, Universitätsklinik der Ruhr-Universität Bochum Bad Oeynhausen
- –
-
Prof. Dr. Alexander Drzezga, Universitätsklinikum Köln
- –
-
Prof. Dr. Alexander Haug, Medizinische Universität Wien
- –
-
Prof. Dr. Ken Herrmann, Universitätsklinikum Essen
- –
-
Prof. Dr. Jörg Kotzerke, Klinikum der TU Dresden
- –
-
Dr. Jens Kurth, Universitätsmedizin Rostock
- –
-
Prof. Dr. Marianne Patt, Universitätsklinikum Leipzig
- –
-
Prof. Dr. Kambiz Rahbar, Universitätsklinikum Münster.
Unterstützt wurde die Arbeitsgruppe durch Frau Dr. Christine Klingele (als Vertretung des Bundesamts für Strahlenschutz).
| Prof. Dr. Alexander Drzezga | Prof. Dr. Günter Layer | Prof. Dr. Werner Rühm |
| Vorsitzender der Arbeitsgruppe „Nuklide in der Nukleartherapie“ |
Vorsitzender des Ausschusses „Strahlenschutz in der Medizin“ |
Vorsitzender der Strahlenschutzkommission |
Inhalt
1 Einleitung
1.1 Beratungsauftrag
1.2 Methoden
2 Empfehlungen der SSK
3 Erläuterung der Empfehlungen
3.1 Infrastrukturelle Voraussetzungen für die Durchführung nuklearmedizinischer Therapien
3.2 Erfordernis der stationären Durchführung
3.3 Qualitätssicherung der Herstellung von nuklearmedizinischen Therapeutika
3.4 Umgang mit radioaktiven Reststoffen aus der Nuklearmedizin
Literatur
Spezielle Erläuterungen zu den einzelnen Therapieverfahren – wissenschaftliche Begründung zur Empfehlung
1 Radionuklidtherapie von Schilddrüsenerkrankungen mit Iod-131 Radioiodtherapie (RIT)/(Radiojodtherapie) (RJT)
1.1 Indikationen und Therapieziele
1.2 Durchführung
1.2.1 Vorbereitung und Therapieplanung
1.2.2 Allgemeiner Therapie-Ablauf
1.2.3 Nebenwirkungen und Kontraindikationen
2 Radionuklidtherapie mit PSMA-Liganden
2.1 Indikationen und Therapieziele
2.2 Durchführung
2.2.1 Vorbereitung und Therapieplanung
2.2.2 Allgemeiner Therapie-Ablauf
2.2.3 Nebenwirkungen und Kontraindikationen
3 Radionuklidtherapie von neuroendokrinen Tumoren mit Lutetium-177- und Yttrium-90-markierten Somatostatinanaloga (PRRT)
3.1 Indikationen und Therapieziele
3.2 Durchführung
3.2.1 Vorbereitung und Therapieplanung
3.2.2 Allgemeiner Therapieablauf
3.2.3 Kontraindikationen und Nebenwirkungen
4 Radionuklidtherapie in der Behandlung von Knochenschmerzen und von Knochenmetastasen des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC) mit [153Sm]Sm-EDTMP) oder [223Ra]Radiumdichlorid
4.1 Indikationen und Therapieziele
4.2 Durchführung
4.2.1 Vorbereitung und Therapieplanung
4.2.2 Allgemeiner Therapieablauf
4.2.3 Kontraindikationen und Nebenwirkungen
5 Radionuklidtherapie von Synovialitis (Radiosynoviorthese) mit [169Er]Erbiumcitrat, [186Re]Rheniumsulfid und [90Y]Yttriumcitrat
5.1 Indikationen und Therapieziele
5.2 Durchführung
5.2.1 Nebenwirkungen und Kontraindikationen
6 Selektive Interne Radiotherapie (SIRT) von Lebertumoren mit Yttrium-90 und Holmium-166
6.1 Indikationen und Therapieziele
6.2 Durchführung
6.2.1 Vorbereitung und Therapieplanung
6.2.2 Allgemeiner Therapie-Ablauf
6.2.3 Nebenwirkungen und Kontraindikationen
7 Radionuklidtherapie von hämatologischen/onkologischen Erkrankungen mit Lutetium-177 und Yttrium-90 (CXCR4-gerichtete Endoradionuklidtherapie)
7.1 Indikationen und Therapieziele
7.2 Durchführung
7.2.1 Vorbereitung und Therapieplanung
7.2.2 Allgemeiner Therapieverlauf
7.2.3 Nebenwirkungen und Kontraindikationen
8 Radionuklidtherapie von B-Zell-Non-Hodgkin-Lymphomen mit [90Y]Y-CD20-Ibritumomab-Tiuxetan (Zevalin)
8.1 Indikationen und Therapieziele
8.2 Durchführung
8.2.1 Vorbereitung und Therapieplanung
8.2.2 Allgemeiner Therapie-Ablauf
8.2.3 Nebenwirkungen und Kontraindikationen
Literatur
Anhänge
| A-1 | Radionuklid Tabellen |
| A-1.1 | Yttrium-90 | |
| A-1.2 | Iod-131 | |
| A-1.3 | Samarium-153 | |
| A-1.4 | Holmium-166 | |
| A-1.5 | Erbium-169 | |
| A-1.6 | Lutetium-177 | |
| A-1.7 | Rhenium-186 | |
| A-1.8 | Rhenium-188 | |
| A-1.9 | Radium-223 | |
| A-1.10 | Actinium-225 | |
| Literatur | ||
| A-2 | Abkürzungen |
| A-3 | Glossar |
| Referenzen zum Glossar |
1 Einleitung
Nuklearmedizin umfasst die medizinische Anwendung offener radioaktiver Stoffe zur Diagnostik und Therapie. Die in jüngster Zeit schnell angewachsene Anzahl nuklearmedizinischer Therapieoptionen bei gleichzeitig wachsendem klinischem Bedarf definiert die Notwendigkeit einer systematischen Erfassung und Betrachtung der strahlenschutzrelevanten Fragestellungen für diese Verfahren.
Das mit großem Abstand dominierende Radiopharmakon für therapeutische Anwendungen in der Nuklearmedizin ist seit langer Zeit das Iod-131. Dieses Radionuklid wird in der Behandlung gut- und bösartiger Schilddrüsenerkrankungen verwendet. Bei der Therapie mit Iod-131 kommt das Radionuklid in Reinform zur Anwendung, d. h. ohne eine spezifische, an das Radionuklid gekoppelte Trägersubstanz, da der Effekt der spezifischen Iodidaufnahme in Schilddrüsengewebe genutzt werden kann. In den letzten Jahren hat das Feld der therapeutischen Anwendungen in der Nuklearmedizin eine sprunghafte Entwicklung erlebt und zahlreiche neue Therapieformen haben sich etabliert, teils basierend auf der Applikation isolierter Radionuklide, teils einem Konzept folgend, nach welchem bestimmte Trägerstoffe die therapeutisch wirksamen Radionuklide gezielt an den Wirkungsort tragen. Neben Therapien, bei denen die emittierte Betastrahlung für den Therapieeffekt dominierend ist, kommen mittlerweile auch Alpha-Emitter zum Einsatz.
Viele der heute angewandten Therapien basieren, wie auch die Radioiodtherapie, auf dem Prinzip der sogenannten Thera(g)nostik. Dies bedeutet, dass ein Mechanismus der Anreicherung, der für die Diagnostik genutzt wird, auch therapeutisch zur Anwendung kommt. Vor der Gabe eines therapeutischen Radiopharmakons kann dabei die zu erwartende Verteilung und Anreicherung mittels des diagnostischen Verfahrens vorhergesagt werden. Für den jeweiligen diagnostischen Test werden der gleiche Bindungsmechanismus und das gleiche oder ein strukturell ähnliches Trägermolekül, teils aber mit anderer Radionuklid-Markierung, verwendet. Dieses Konzept ermöglicht eine zuverlässige Patientenselektion und hochspezifische Therapieansätze, die gerade für onkologische Erkrankungen oftmals mit vergleichsweise geringen Nebenwirkungen verbunden sind, da durch spezifische Anreicherungseffekte die therapeutische Aktivität gezielt im erkrankten Gewebe angereichert wird. Die therapeutische Wirksamkeit wird durch die gezielte Bestrahlung der das Radiopharmakon anreichernden Zellen und ihrer Nachbarzellen erzielt, nicht durch einen pharmakologischen Effekt. Auch eventuelle Nebenwirkungen sind durch Strahleneffekte bedingt und nicht pharmakologisch.
Infolge der rapiden Entwicklungsfortschritte auf diesem Gebiet besteht für mehrere dieser theragnostischen Verfahren aktuell noch keine arzneimittelrechtliche Zulassung, oder die Verfahren kommen außerhalb der bereits zugelassenen Indikationen zur Anwendung. Dies ist durch mehrere Faktoren bedingt. Viele der neuen Entwicklungen stammen aus dem universitären Umfeld, nicht aus Initiativen der pharmazeutischen Industrie. Zulassungsprozesse inklusive der hierfür erforderlichen prospektiven randomisierten klinischen Studien sind aus dem universitären Umfeld sowohl organisatorisch als auch finanziell nicht oder kaum durchführbar. Teils sind die Verfahren nicht patentierbar, so dass sich Sponsoren seitens der Industrie für derartige Studien kaum finden lassen, da keine wirtschaftliche Verwertung zu erwarten ist. Für einige Verfahren sind Zulassungsprozesse bereits im Gange, aber noch nicht abgeschlossen, für andere bestehen Zulassungen, jedoch nur für einen Teil der möglichen Indikationen. Ohne ein industrielles Sponsoring ist eine arzneimittelrechtliche Zulassung gar nicht oder nicht in absehbarer Zeit zu erreichen.
Dem steht die für einige Anwendungen bereits dokumentierte Effektivität der neuen Therapieverfahren gegenüber, die zu einer schnellen klinischen Etablierung geführt hat. So haben sich theragnostische Ansätze z. B. beim Prostatakarzinom in Situationen fest etabliert, in denen andere Verfahren ausgeschöpft sind, da auch in diesen Fällen mit den theragnostischen Verfahren noch therapeutische Erfolge zu beobachten sind. Infolge der therapeutischen Effizienz der neuen Methoden erscheint es in Ermangelung anderer Optionen medizinethisch teils schon nicht mehr vertretbar, betroffenen Patientinnen und Patienten diese neuen Verfahren vorzuenthalten, auch wenn noch keine Zulassung besteht. Teils haben diese Verfahren auch bereits Eingang in die entsprechenden Leitlinien gefunden. Im Gegensatz zu den therapeutischen Verfahren kann bei diagnostischen Radiopharmaka die Herstellung nicht zugelassener Präparate auf Grundlage einer Herstellungserlaubnis von Radiochemikerinnen und Radiochemikern und Radiopharmazeutinnen und Radiopharmazeuten durchgeführt und verantwortet werden. Die entsprechenden Verantwortlichkeiten für Herstellung, Qualitätskontrolle und Freigabe sind dabei in der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV 2006), die auf dem Arzneimittelgesetz basiert (AMG 2005), definiert. Diese Möglichkeit ist für therapeutische Radiopharmaka derzeit (noch) nicht gegeben, da die Verordnung über radioaktive oder mit ionisierenden Strahlen behandelte Arzneimittel (AMRadV 2007) die dort in Artikel 2 definierte Ausnahme vom Verkehrsverbot auf diagnostische Radiopharmaka beschränkt. Diese Diskrepanz zwischen Stand der Etablierung/klinischer Anwendung und Stand der Zulassung hat dazu geführt, dass Nuklearmedizinerinnen und Nuklearmediziner in relevantem Umfang auf eigene Verantwortung hin Radionuklidtherapien zur Anwendung bringen (müssen), für die keine Zulassung besteht. Dabei erfolgt die Herstellung der entsprechenden Radiopharmaka oftmals in Eigenherstellung an nuklearmedizinischen Zentren unter Berücksichtigung strenger regulatorischer Vorgaben in Form der erlaubnisfreien Herstellung durch die anwendenden Ärztinnen und Ärzte gemäß § 13 Absatz 2b des Arzneimittelgesetzes (AMG 2005).
Da kurzfristig eine Veränderung dieser Situation nicht zu erwarten ist (für einige der Therapien und Indikationen womöglich niemals), soll es das Ziel dieser Empfehlung sein, eine übersichtliche Zusammenfassung des aktuellen Status quo zu erstellen, um zu dokumentieren, welche Anwendungen bereits Eingang in die klinische Praxis gefunden haben. Dies soll dazu dienen, für Behörden, Anwenderinnen und Anwender und Wissenschaftlerinnen und Wissenschaftler einen Überblick zu schaffen, welche Therapieformen in welchem Stand der Zulassung sind, welche Verfahren als klinisch bereits etabliert gelten können, welche noch als rein experimentell bzw. der Forschung zuzuordnen sind, welche Vorgehensweisen üblicherweise zu beachten sind, mit welchen Wirkungen und Nebenwirkungen zu rechnen ist und welche Konsequenzen sich für den Strahlenschutz ergeben. Die Empfehlung soll somit auch zu einer Standardisierung über die Standorte hinweg beitragen und damit die Handhabung vereinfachen und gegebenenfalls die Sicherheit optimieren.
Es muss erwähnt werden, dass die vorliegende Empfehlung in einem sich schnell entwickelnden Feld keinen Anspruch auf Vollständigkeit oder anhaltende Gültigkeit erheben kann und gegebenenfalls aktualisiert werden muss. Auch muss betont werden, dass hier nur in grob orientierender Form Wirkungen und Nebenwirkungen behandelt werden, um einen Eindruck über die jeweiligen Verfahren zu vermitteln. Diese Informationen sind zwangsläufig unvollständig und nicht als Basis für weiterführende z. B. medizinische Entscheidungen oder Zwecke wie eine Patientenaufklärung geeignet. Bei der Zusammenstellung der Informationen stand ferner nicht die Zusammenstellung aller physikalischen und radiologischen Daten zu Wirk- und Begleitnukliden (wie Halbwertszeiten, Wahrscheinlichkeiten und Energien der Übergänge und dergleichen) im Vordergrund, so dass für die Vollständigkeit/das Zutreffen entsprechender Angaben im Text keine Gewähr übernommen werden kann und diese bei Bedarf gegebenenfalls in der einschlägigen Literatur entnommen bzw. nachgeprüft werden müssten.
1.1 Beratungsauftrag
In der Nuklearmedizin werden radioaktive Stoffe nicht nur zur Diagnostik, sondern auch zu therapeutischem Zweck an Patientinnen und Patienten eingesetzt. Es ist eine rasante Entwicklung neuer medizinischer Therapieverfahren zu beobachten, z. B. hinsichtlich der vielfältigen Möglichkeiten, Radionuklide mittels spezifischer Liganden im Tumorgewebe anzureichern.
Radioaktive Stoffe werden hierbei sowohl im Rahmen etablierter, arzneimittelrechtlich zugelassener Therapieverfahren angewendet als auch in der medizinischen Forschung. Daneben erfolgt im klinischen Alltag teils auch eine Anwendung für Indikationen außerhalb der Zulassung (Off-Label-Use), und einige neuere Therapieformen, für die z. B. (noch) keine zugelassenen kommerziellen Alternativen verfügbar sind, werden dezentral durch die behandelnden Ärztinnen und Ärzte im Rahmen der erlaubnisfreien Herstellung im Geltungsbereich des Arzneimittelgesetzes (AMG 2005) unter der direkten fachlichen Verantwortung der therapierenden Ärztinnen und Ärzte durchgeführt. Als Beispiel ist die [177Lu]Lu-PSMA-(Prostata-spezifische Membran-Antigen)-Ligandentherapie beim metastasierten kastrationsresistenten Prostatakarzinom zu nennen, die bereits in vielen Kliniken etabliert ist. Es stellt sich die Frage, nach welchen speziellen Kriterien diese Therapien durchgeführt werden können.
Die SSK wurde daher im Februar 2019 vom Bundesumweltministerium um die Erarbeitung einer Zusammenstellung aller aktuell in der Nuklearmedizin in gängiger Weise therapeutisch angewendeten radioaktiven Stoffe gebeten.
Folgende Aspekte sollen insbesondere dabei berücksichtigt werden:
- –
-
Angaben zu Krankheits-/Tumorentität und Art der Behandlung,
- –
-
Angaben zum Nuklid – und gegebenenfalls auftretenden Begleitnukliden – unter Berücksichtigung physikalischer Eigenschaften des Strahlenemitters, der Spezifität der Therapie, biokinetischer Eigenschaften der Trägersubstanz bzw. des Nuklids und unter Berücksichtigung des Zielvolumens,
- –
-
typischer Bereich der individuell zu applizierenden Aktivität,
- –
-
Bewertung, inwieweit es sich um ein Therapieverfahren handelt, das im Rahmen der medizinischen Forschung erfolgt,
- –
-
Notwendigkeit, ob für Patientinnen und Patienten eine stationäre Aufnahme zu fordern ist oder unter welchen Voraussetzungen die Therapie ambulant durchgeführt werden kann.
1.2 Methoden
Folgende Indikationen/Therapieansätze werden in der hier vorliegenden Empfehlung behandelt:
- –
-
Schilddrüsenerkrankungen (Radioiodtherapie)
- –
-
Prostatakarzinom (PSMA (Prostata-spezifische Membran Antigen)-Ligandentherapie)
- –
-
Neuroendokrine Tumoren (PRRT: Peptidrezeptor-Radionuklid-Therapie)
- –
-
Knochenmetastasen (enossale Schmerztherapie/Radium-223-Dichlorid)
- –
-
Gelenkerkrankungen (Radiosynoviorthese)
- –
-
Lebertumoren (SIRT: Selektive Interne Radiotherapie)
- –
-
hämatologisch/onkologische Erkrankungen (Radioliganden und Radioimmuntherapie).
Seitens der Arbeitsgruppe wurde systematisch zusammengestellt, welche Vorgehensweisen für diese Therapien für die Durchführung etabliert sind und welche Voraussetzungen jeweils erfüllt sein müssen, insbesondere mit Blick auf den Strahlenschutz. Diese Informationen wurden in Form von Tabellen sowie ausformulierten Texten zusammengestellt, die zur Orientierung für die Nutzerinnen und Nutzer und z. B. auch für eine Einschätzung und Bewertung durch die zuständigen Behörden dienen sollen. Zudem werden auf dieser Basis konkrete Empfehlungen für die Voraussetzungen und die praktische Durchführung unter Strahlenschutzaspekten gegeben. Dies erfolgt in folgendem Aufbau:
- –
-
Empfehlung der SSK (Kapitel 2).
- –
-
Erläuterung, in welcher die Empfehlungen in größerem Detail ausgeführt werden (Kapitel 3).
- –
-
Wissenschaftliche Begründung: Zu allen gängigen Verfahren wurden jeweils kurze individuelle Begleittexte ergänzt, in denen erklärt wird, in welchen klinischen Situationen die Anwendung zu rechtfertigen ist und wie der aktuelle Stand bzw. der Ausblick auf neue Entwicklungen ist. Integriert in diese Begleittexte finden sich jeweils ausführliche Tabellen zu den jeweiligen Therapieentitäten/Radiopharmaka: Die genutzten therapeutischen Nuklide entfalten je nach Koppelung an spezifische Trägersubstanzen unterschiedliche Verteilungsverhalten. Daraus resultieren unterschiedliche therapeutische Effekte und somit unterschiedliche Anwendungsarten und Indikationen. Auch die strahlenschutzrelevanten Eigenschaften dieser Radiopharmaka basieren nicht nur auf den physikalischen Charakteristika der betreffenden Isotope, sondern auch auf dem Verteilungsverhalten (Biodistribution) sowie dem Retentions- und Ausscheidungsverhalten aus dem Körper. Angaben zu den aktuell verbreiteten Therapieverfahren sind in der Tabellenform zusammengestellt. Ebenfalls in tabellarischer Form finden sich Angaben zu Radiopharmakon/Träger- und Begleitsubstanzen, Indikationen, Wirkung und mögliche Nebenwirkungen, Bezug des Radiopharmakons/Herstellung, Zulassungsstatus, anfallender radioaktiver Abfall und Entsorgung, Applikationsart und typischerweise applizierte Aktivität, Strahlenexposition, Strahlenschutzmaßnahmen, Durchführungsart der Therapie (stationär oder ambulant), Entlassungsvoraussetzungen und Erfassung der Dosimetrie.
- –
-
Tabellen Therapienuklide (Anhang A-1): Im Anhang sind zusätzlich auch noch die Therapienuklide tabellarisch zusammengestellt, die aktuell klinisch relevant sind. Physikalische Eigenschaften dieser Nuklide (Halbwertszeit, Art der Strahlung, Energiespektren etc.) und Besonderheiten im Umgang und bei der Entsorgung sind aufgelistet, da diese Informationen für verschiedene Therapeutika Gültigkeit haben können.
Bezüglich der Bezeichnung der Radiopharmaka wurde versucht, durchgängig die Konsensus-Empfehlungen zur Nomenklatur von radioaktiv markierten Verbindungen zu befolgen (Coenen et al. 2017). Im Einzelfall, in denen der Status des zur Markierung verwendeten Radionuklids bezüglich des Vorhandenseins von stabilen Isotopen (Träger) ungewiss ist oder zumindest sein kann, wurde die Schreibweise des nicht-trägerfrei markierten Radiopharmakons verwendet.
2 Empfehlungen der SSK
Zusammenfassend wird aus Sicht des Strahlenschutzes empfohlen, für die Durchführung nuklearmedizinischer Therapien folgende wesentliche Qualitätsmerkmale zu fordern:
| Empfehlung 1 | Infrastrukturelle Voraussetzungen |
Die SSK empfiehlt sicherzustellen, dass geeignete spezialisierte Einrichtungen als Genehmigungsvoraussetzungen für die Vorbereitung und Durchführung der Therapien vorhanden sind und bleiben. Die SSK stellt klar, dass dies die Therapien mit kommerziell verfügbaren Radiotherapeutika genauso wie die dezentrale Eigenherstellung betrifft und Personal mit entsprechenden fachlichen Qualifikationen sowie bauliche Voraussetzungen beinhaltet.
| Empfehlung 2 | Erfordernis der stationären Durchführung |
Für viele der Verfahren ist eine stationäre Unterbringung auf einer nuklearmedizinischen Station erforderlich. Die ist begründet durch medizinische Aspekte, aber auch durch den Strahlenschutz. Bei Planung der Entlassung muss die verursachte Strahlenexposition in der Bevölkerung pro Kalenderjahr berücksichtigt werden (insbesondere bei mehreren Therapiezyklen). Die Beurteilung der Entlassungsfähigkeit und erforderlichen anschließenden Strahlenschutzmaßnahmen ist durch die behandelnden Ärztinnen und Ärzte in Abstimmung mit den beteiligten Medizinphysik-Expertinnen und Medizinphysik-Experten auf der Basis individueller dosimetrischer Einschätzungen zu treffen und nicht anhand pauschaler Annahmen.
| Empfehlung 3 | Qualitätssicherung bei der Herstellung von nuklearmedizinischen Therapeutika |
Die Qualitätssicherung der Radiopharmaka ist bei kommerziell verfügbaren Radiopharmaka seitens des Zulassungsinhabers und bei der dezentralen Herstellung durch die Hersteller vor Ort zu gewährleisten (pharmazeutische/chemische Qualität, Radionuklidreinheit). Klinisch ist die Anwendung einiger therapeutischer Verfahren auch außerhalb der Zulassung sowie die dezentrale Eigenherstellung therapeutischer Radiopharmaka für verschiedene Indikationen etabliert und medizinisch erforderlich. Die SSK empfiehlt, diese Möglichkeit zu bewahren. Die SSK hält es aus Sicht des Strahlenschutzes für erforderlich, für diese Form der Herstellung sowie für zugehörige Zulassungsstudien rechtlich eindeutige Grundlagen zu schaffen.
| Empfehlung 4 | Umgang mit radioaktiven Reststoffen aus der Nuklearmedizin |
Eine korrekte Entsorgung radioaktiver Reststoffe ist erforderlich und durch entsprechende gesetzliche Vorgaben und Grenzwerte reguliert. Die SSK stellt klar, dass die ordnungsgemäße Entsorgung Bestandteil der Therapie ist. Die SSK empfiehlt, dass bei kommerziell erhältlichen Radiopharmaka bezüglich der Entsorgung akkurate Angaben seitens der kommerziellen Anbieter gemacht werden sollen, insbesondere auch zu relevanten Begleitnukliden konkret für jede individuelle Lieferung (keine Pauschalangaben oder Mittelwerte). Kosten für die Entsorgung von Restprodukten sind als therapieassoziiert zu bewerten.
3 Erläuterung der Empfehlungen
3.1 Infrastrukturelle Voraussetzungen für die Durchführung nuklearmedizinischer Therapien
Geeignete spezialisierte Einrichtungen für die Durchführung der Therapien sind vorzuhalten und gegebenenfalls auszubauen. Dies betrifft im Einzelnen sowohl die Anwendung der kommerziell verfügbaren Therapeutika als auch insbesondere die dezentrale, derzeit erlaubnisfreie Herstellung (AMG 2005) und Anwendung individueller therapeutischer Radiopharmaka.
Eine Genehmigungsvoraussetzung ist dabei das Vorhandensein von Personal mit den erforderlichen fachlichen Qualifikationen (Fachärztinnen und Fachärzte für Nuklearmedizin, nuklearmedizinisch qualifiziertes medizinisches Assistenz- und Pflegepersonal, Medizinphysik-Expertinnen und Medizinphysik-Experten, Radiochemie/Radiopharmazie) sowie auch der baulichen Voraussetzungen für strahlenschutztechnisch sichere Herstellung, Umgang und Applikation, Patientenunterbringung, Abfallentsorgung und Abklinganlage. Die Voraussetzungen an nuklearmedizinischen Zentren in Deutschland müssen erfüllt und auch künftig weiter sichergestellt und gegebenenfalls den gesetzlichen Erfordernissen angepasst werden (AMG 2005, StrlSchG 2017). Bei der Berechnung der zu deckenden Kosten müssen die Aufwendungen für den Strahlenschutz berücksichtigt werden.
3.2 Erfordernis der stationären Durchführung
Für viele der Verfahren ist eine stationäre Unterbringung der Patientinnen und Patienten aus medizinischer und strahlenschutztechnischer Hinsicht erforderlich (Exposition durch Patientinnen und Patienten selbst, Ausscheidungen, Abfallbehandlung etc.). Konkrete Angaben zu den Entlassungskriterien werden in dieser Empfehlung in den Tabellen in der wissenschaftlichen Begründung zu jedem einzelnen therapeutischen Verfahren aufgeführt. Gemäß § 122 Absatz 4 der Strahlenschutzverordnung (StrlSchV) ist zu gewährleisten, dass Patientinnen und Patienten erst dann aus dem Strahlenschutzbereich einer nuklearmedizinischen Therapiestation entlassen werden, wenn für Angehörige und Dritte eine effektive Dosis von nicht mehr als 1 mSv auftreten kann. Für Patientinnen und Patienten, die offene radioaktive Stoffe zur Behandlung erhalten haben, sieht die Richtlinie Strahlenschutz in der Medizin vom 26. Mai 2011 (GMBl S. 867), zuletzt geändert durch RdSchr. des BMUB vom 11. Juli 2014 (GMBl S. 1020) (BMU 2011), Kapitel 6.7.2 Seite 26 bis 27), die noch auf dem bis zum 30. Dezember 2018 gültigen Strahlenschutzrecht beruht, nach der Verabreichung im Regelfall einen stationären Aufenthalt von mindestens 48 Stunden im Kontrollbereich einer Therapiestation vor, die auf die Notwendigkeiten des Strahlenschutzes ausgelegt ist (baulicher Strahlenschutz, Abwasserschutzanlage, eingewiesenes Personal etc.). Dieser Zeitraum beruht auf Erfahrungen mit der Radioiodtherapie, wird aber auch für andere Nuklide und Verfahren angewandt. Nach diesem Zeitraum erfolgt die Entlassung gemäß den unten folgenden Vorgaben. Bei mehrzyklischen Therapien ist dabei die insgesamt durch alle Zyklen im Kalenderjahr mögliche Exposition als Bewertungsgrundlage zu betrachten (siehe unten). Ambulante Behandlungen sind möglich, wenn unzweifelhaft belegt ist, dass für Angehörige und Dritte grundsätzlich keine effektive Dosis von mehr als 1 Millisievert pro Kalenderjahr auftreten kann (durch die Oberflächendosisleistung, aber auch durch Faktoren wie Ausscheidung, kontaminierte Verbandsmaterialien etc.) und eine ordnungsgemäße Entsorgung radioaktiver Körperflüssigkeiten sichergestellt ist. Die Richtlinie Strahlenschutz in der Medizin listet in Abschnitt 6.7.3 eine Reihe von Therapien auf, die ambulant durchgeführt werden können.
- –
-
Die stationäre Unterbringung dient dabei auch Aspekten, die über den reinen Strahlenschutz (Dosimetrie, medizinische Überwachung der Patientinnen und Patienten) hinausgehen. Gemäß Urteil des Bundessozialgerichtes (am Beispiel der Radioiodtherapie) ist dabei die stationäre Unterbringung als Teil der medizinischen Behandlung zu sehen und damit auch seitens der Versicherungsträger erstattungspflichtig (Bundessozialgericht, Urteil vom 30. Juli 2019, B 1 KR 15/18 R).
- –
-
Gemäß § 122 Absatz 4 StrlSchV (StrlSchV 2018) hat der/die Strahlenschutzverantwortliche dafür zu sorgen, dass eine Person, die mit radioaktiven Stoffen behandelt wurde, erst dann aus dem Strahlenschutzbereich entlassen wird, wenn davon ausgegangen werden kann, dass hierdurch für Angehörige und Dritte eine effektive Dosis von nicht mehr als 1 Millisievert pro Kalenderjahr auftreten kann.
- –
-
Der/die Strahlenschutzverantwortliche hat ferner dafür zu sorgen, dass Ableitungen radioaktiver Stoffe mit Abwässern von Radionuklidstationen und Ausscheidungen gemäß § 99 StrlSchV nur kontrolliert erfolgen und begrenzt sind. Weitere Anforderungen gemäß der §§ 100 bis 102 StrlSchV finden ebenfalls Anwendung.
- –
-
Bei einigen Verfahren werden standardmäßig sequenziell mehrere Therapiezyklen zur Erzielung des therapeutischen Effektes eingesetzt. Dies bedingt eine Akkumulation der durch Patientinnen und Patienten verursachten Strahlenexposition in der Bevölkerung pro Kalenderjahr. Dies muss bei jeder einzelnen Entlassung bedacht werden, und die stationären Unterbringungszeiten müssen gegebenenfalls entsprechend angepasst werden.
- –
-
Die Bewertung der Entlassungsfähigkeit im Hinblick auf den Strahlenschutz sowie die Notwendigkeit und Dauer möglicherweise erforderlicher Strahlenschutzmaßnahmen nach Entlassung erfolgt seitens der behandelnden Ärztinnen und Ärzte in Abstimmung mit den beteiligten Medizinphysik-Expertinnen und Medizinphysik-Experten auf der Basis individueller dosimetrischer Einschätzungen und nicht auf der Basis pauschaler oder durchschnittlicher Annahmen. Spezifische Angaben zu den unterschiedlichen Therapieformen finden sich folgend in den Tabellen der jeweiligen Kapitel.
- –
-
Therapien mit Radionukliden, die signifikant Gammastrahlung emittieren (anders als Therapien mit reinen Beta- und Alphastrahlern), sind bezüglich der Bevölkerungsexposition im Falle der Patientenentlassung besonders zu beachten.
3.3 Qualitätssicherung der Herstellung von nuklearmedizinischen Therapeutika
Bei kommerziell verfügbaren Radiopharmaka ist die Qualität der Radiopharmaka seitens des Zulassungsinhabers zu gewährleisten. Im klinischen Alltag ist die Anwendung einiger therapeutischer Verfahren auch außerhalb der Zulassung sowie die Eigenherstellung therapeutischer Radiopharmaka für verschiedene Indikationen etabliert, die in der wissenschaftlichen Begründung zu dieser Empfehlung gemäß dem aktuellen Stand (2022) aufgeführt werden. Für diese Therapien besteht medizinischer Bedarf, so dass diese Möglichkeiten im Sinne der Patientenversorgung für erforderliche Fälle bewahrt werden müssen, zumindest bis gegebenenfalls die Zulassung erweitert werden kann, oder die verlässliche Verfügbarkeit zugelassener Präparate gleicher Qualität und Wirksamkeit gesichert ist.
Für Patientinnen und Patienten besteht in Deutschland zu diesem Zweck die wichtige Möglichkeit einer nuklearmedizinischen Diagnostik und Behandlung auch mit Radiopharmaka, die nicht für den kommerziellen Vertrieb zugelassen sind und die dezentral in den behandelnden Kliniken bzw. durch die behandelnden Ärztinnen und Ärzte selbst hergestellt werden können. Bei dieser dezentralen Herstellung erfolgt die Qualitätssicherung durch die Hersteller vor Ort gemäß dem aktuellen Stand von gesetzlichen Vorgaben und der Wissenschaft und Technik.
Der Gesetzgeber hat hiermit der Tatsache Rechnung getragen, dass die kommerzielle Verfügbarkeit radioaktiver Arzneimittel aus unterschiedlichen Gründen limitiert ist. So ist zum Beispiel bei den diagnostischen Radiopharmaka aufgrund extrem kurzer Halbwertszeiten (im Bereich von wenigen Minuten bis Stunden) teilweise gar keine Abgabe oder kein Transport von einem Zentrum zu mehreren Abnehmern möglich. In anderen Fällen besteht keine Möglichkeit einer Patentierung und damit einer erfolgreichen Vermarktung der verwendeten Wirkstoffe, so dass allein aus wirtschaftlichen Gründen hier eine Marktverfügbarkeit gar nicht gegeben oder aber allenfalls mit erheblichem Verzug zwischen Entwicklung und der Möglichkeit der klinischen Anwendung zu erwarten ist. Im Hinblick auf die geringe Stoffmenge der zur Radiomarkierung verwendeten Trägersubstanzen bei den diagnostischen Radiopharmaka ist keine pharmakologische Wirkung der Trägersubstanz selbst zu erwarten. Auch bei den therapeutischen Radiopharmaka wird der Wirkeffekt über einen gezielten Transport von Radionukliden an den Wirkort im Sinne einer biologisch selektiven zielgerichteten Strahlenapplikation vermittelt, nicht über eine pharmakologische Wirkung. Diese Verfahren sind somit mit anderen pharmakologischen Therapieformen nicht zu vergleichen, und die etablierten Zulassungsverfahren erscheinen deswegen auch nur bedingt geeignet.
Daher wurden bereits Ausnahmen von der grundsätzlichen Zulassungspflicht (§ 21 Absatz 1 AMG (AMG 2005)) und vom Verkehrsverbot (§ 7 Absatz 1 AMG) geschaffen, deren Voraussetzungen in der Verordnung über radioaktive oder mit ionisierenden Strahlen behandelte Arzneimittel (AMRadV 2007) spezifiziert sind (§ 2 Absatz 1 Satz 3 AMRadV). Diese Ausnahmen gelten bislang allerdings im Wesentlichen nur für diagnostische Radiopharmaka, so dass radioaktive Arzneimittel für therapeutische Anwendungen nicht auf dieser Rechtsgrundlage hergestellt und angewendet werden können.
Für den Fall, dass diese Präparate nicht als zugelassene Arzneimittel verfügbar sind, gibt es die Möglichkeit der erlaubnisfreien Herstellung durch anwendende Ärztinnen und Ärzte gemäß § 13 Absatz 2b Satz 1 AMG. Die selbstherstellenden Ärztinnen und Ärzte können sich hierbei zwar von entsprechend qualifizierten Expertinnen und Experten (Radiochemikerinnen und Radiochemiker und Radiopharmazeutinnen und Radiopharmazeuten) unterstützen lassen, sind hierzu aber nicht verpflichtet. Somit werden diese Verfahren derzeit weiterhin unter dem Arzneimittelgesetz (AMG 2005) analog zu pharmakologischen Wirkstoffen bewertet, wobei unberücksichtigt bleibt, dass sowohl Wirkeffekt als auch Nebenwirkungen der Therapien nicht auf pharmakologischen Effekten beruhen, sondern auf einer zielgerichteten Strahlenapplikation.
Insgesamt besteht die Notwendigkeit, die Wirkungen und Risiken von neuen nuklearmedizinischen Therapien konkret zu bewerten. Dabei wäre es günstig, wenn auf Basis von (zentralen) Registern gesammelte ausreichend große Fallzahlen zu Wirkung und Nebenwirkungen solcher Verfahren für eine Zulassung Verwendung finden könnten, da empirisch eine geringe Frequenz von Nebenwirkungen zu beobachten ist.
Die bedarfsorientierte dezentrale Produktion und Anwendung nicht kommerziell verfügbarer Radiopharmaka erfolgt seit Jahrzehnten mit großer Zuverlässigkeit und Sicherheit. Darin sind eine große Stärke und ein internationales Alleinstellungsmerkmal des deutschen Systems zu sehen. Dies zu erhalten, ist, nicht zuletzt wegen der grundlegenden Bedeutung für eine frühe klinische Einführung innovativer Behandlungsmethoden und dem damit verbundenen Nutzen für bedürftige Patientinnen und Patienten, unabdingbar.
Hier besteht besonders auch aus Sicht des Strahlenschutzes ein gesetzlicher Nachbesserungsbedarf, insbesondere für die arzneimittelrechtlichen Regelungen, so dass die Besonderheiten der Radiopharmaka adäquat berücksichtigt werden können. Naheliegend erscheint eine Regelung der nuklearmedizinischen Therapieverfahren in der AMRadV (AMRadV 2007), ähnlich der Regelung für nuklearmedizinisch-diagnostische Verfahren. Eine Öffnung der AMRadV für etablierte Radiotherapeutika würde in angemessener Weise zu einer Regulierung der Radiopharmakaherstellung im Sinne der Arzneimittelsicherheit beitragen, gleichzeitig aber eine patientenindividualisierte Versorgung sicherstellen (Patt et al. 2021).
3.4 Umgang mit radioaktiven Reststoffen aus der Nuklearmedizin
Eine Entsorgung radioaktiver Reststoffe, die im Rahmen nuklearmedizinischer Therapien anfallen, ist zu gewährleisten. Dies ist durch entsprechende gesetzliche Vorgaben und Grenzwerte reguliert. Kosten für die Entsorgung von Restprodukten sind als therapieassoziiert zu bewerten.
Im Rahmen der Herstellung der in der Nuklearmedizin benötigten kurzlebigen Radionuklide (Hauptnuklide, Halbwertszeit Stunden bis Tage) besteht die Möglichkeit der Verunreinigung mit geringen Mengen (langlebiger) radioaktiver Isotope (Begleitnuklide); dies kann in Einzelfällen freigaberelevant sein. Bei kommerziell erhältlichen Radiopharmaka sind bezüglich der Entsorgung akkurate Angaben, insbesondere auch zu relevanten Verunreinigungen konkret für jede individuelle Lieferung zu fordern (d. h. keine pauschalen Angaben oder Mittelwerte) (Freudenberg et al. 2022, Gehr et al. 2022).
Im Rahmen der Entsorgung der nuklearmedizinisch anfallenden radioaktiven Reststoffe wird überwiegend das Verfahren der uneingeschränkten Freigabe gemäß § 35 StrlSchV (StrlSchV 2018) gewählt, wobei als wesentliches Kriterium die Unterschreitung der Werte aus Anlage 4 Tabelle 1 Spalte 3 StrlSchV gefordert ist. Voraussetzung hierfür ist gemäß § 42 Absatz 2 StrlSchV (StrlSchV 2018), dass dokumentierte Messungen der spezifischen Aktivität erfolgen (Freimessungen), die zur Feststellung der Übereinstimmung mit dem Inhalt des Freigabebescheides erforderlich sind. Bei hinreichend kurzlebigen Radionukliden kann der Nachweis der Unterschreitung von Freigabewerten auch durch eine entsprechende Abklingzeit auf Basis der bekannten Ausgangsaktivität und der Halbwertszeit geführt werden (Abklinglagerung). Als Konsequenz sind alle im Rahmen der Untersuchungs- oder Therapievorbereitung und -durchführung anfallenden kontaminierten Gegenstände getrennt von sonstigen, nicht kontaminierten Reststoffen zu sammeln und von diesen getrennt zu entsorgen. Zu den kontaminierten Gegenständen gehören neben dem Transportbehältnis alle während des jeweiligen Arbeitsprozesses anfallenden Begleitmaterialien wie Tupfer, Spritzen, Kanülen, Unterlagen und Handschuhe, da diese potenziell kontaminiert sind. Eine gesonderte Entnahme und Entsorgung möglicher Flüssigkeitsreste, z. B. aus Ampullen oder Spritzen, sollte unterbleiben, um eine zusätzliche Strahlenexposition und insbesondere eine Kontaminationsgefahr zu minimieren. Die therapieassoziierten Abfälle sind im Ganzen in einem Sammelgefäß zu sichern und zu entsorgen. Dies entspricht nicht dem sonstigen Abfall-Management im Gesundheitswesen (Krankenhaus oder im niedergelassenen Bereich), welches primär geprägt ist durch hygienische Aspekte, die Vermeidung von Verletzungen (durch Glas oder Kanülen) und die Trennung im Hinblick auf die Entsorgungsart. Für die Berechnung der spezifischen Aktivität als Kriterium für die uneingeschränkte Freigabe wird der Quotient aus der Aktivität des freizugebenden Reststoffes und dessen Masse gebildet. Die Aktivitätsbestimmung kann je nach Größe des Reststoffes zum Beispiel mittels Messungen an einem Aktivimeter, an einem Halbleiterspektrometer, einem Kontaminationsmonitor oder einem anders qualifizierten Messplatz erfolgen (Wanke und Geworski 2014). Bei bekannten Verunreinigungen durch Begleitnuklide ist die Aktivität dieser zu ermitteln und zu berücksichtigen.
Die Bestimmung der Masse erfolgt durch Wägung des befüllten und zur Freigabe vorgesehenen Sammelgefäßes der radioaktiven Reststoffe. Hierbei ist das Leergewicht des Sammelgefäßes zu subtrahieren.
Eine Freigabe kann erfolgen, wenn die jeweiligen Grenzwerte der Anlage 4 Tabelle 1 StrlSchV unter Berücksichtigung der Summenformeln aus Anlage 8 StrlSchV (StrlSchV 2018) für Gemische mehrerer Radionuklide unterschritten ist. Hierbei ist zu beachten, dass zum einen etwaige Verunreinigungen berücksichtigt werden und dass zum anderen der Anteil unberücksichtigter Nuklide maximal 10 % des Wertes der Summenformel betragen darf (Anlage 8 Teil A Nummer 1 Buchstabe e StrlSchV). Hier ist insbesondere die Relevanz von Begleitnukliden zu prüfen, deren Halbwertszeit deutlich größer als die des Nutznuklides ist, da deren relativer Anteil an der Gesamtaktivität im Laufe der Zeit steigt.
Neben einer uneingeschränkten Freigabe gemäß § 35 StrlSchV kann eine Entsorgung radioaktiver Stoffe über das Verfahren der spezifischen Freigabe gemäß § 36 StrlSchV, eine Freigabe im Einzelfall (§ 37 StrlSchV) oder eine Abgabe an Landessammelstellen (LSSt) erfolgen.
Die Entsorgung kann mit erheblichen Kosten verbunden sein, insbesondere, wenn keine Freigabe möglich ist und die Entsorgung über die Landessammelstelle erfolgen muss. Dieser Aspekt soll in der Kostenbetrachtung berücksichtigt werden. Eine kostendeckende Erstattung soll zur Sicherung des Strahlenschutzes gewährleistet werden.
Literatur
| AMG 2005 | Arzneimittelgesetz (AMG) in der Fassung der Bekanntmachung vom 12. Dezember 2005 (BGBl. I S. 3394), das zuletzt durch Artikel 3 des Gesetzes vom 27. September 2021 (BGBl. I S. 4530) geändert worden ist |
| AMRadV 2007 | Verordnung über radioaktive oder mit ionisierenden Strahlen behandelte Arzneimittel in der Fassung der Bekanntmachung vom 19. Januar 2007 (BGBl. I S. 48), die zuletzt durch Artikel 5 der Verordnung vom 29. November 2018 (BGBl. I S. 2034) geändert worden ist |
| AMWHV 2006 | Arzneimittel- und Wirkstoffherstellungsverordnung vom 3. November 2006 (BGBl. I S. 2523), die zuletzt durch Artikel 3a des Gesetzes vom 9. August 2019 (BGBl. I S. 1202) geändert worden ist |
| BMU 2011 | Bundesministerium für Umwelt, Naturschutz, Bau und Reaktorsicherheit (BMUB, früher: BMU). Richtlinie Strahlenschutz in der Medizin zur Verordnung über den Schutz vor Schäden durch ionisierende Strahlen (Strahlenschutzverordnung – StrlSchV) vom 17. Oktober 2011 (GMBl S. 867), die zuletzt mit Rundschreiben des BMUB vom 11.07.2014 (GMBl S. 1020 – RS II 4 – 11432/1 –) geändert worden ist |
| Coenen et al. 2017 | Coenen HH, Gee AD, Adam M, Antoni G, Cutler CS, Fujibayashi Y, Jeong JM, Mach RH, Mindt TL, Pike VW, Windhorst AD. Consensus nomenclature rules for radiopharmaceutical chemistry – Setting the record straight. Nucl Med Biol. 2017 Dec;55:v-xi, doi: 10.1016/j.nucmedbio.2017.09.004, Epub 2017/10/28 |
| Freudenberg et al. 2022 | Freudenberg R, Hesse L, Kotzerke J. [Evaluation of radionuclide impurities in several radiopharmaceuticals]. Nuklearmedizin. 2022 Apr 14, doi: 10.1055/a-1759-1815, Epub 20220414 |
| Patt et al. 2021 | Patt M, Kuwert T, Luster M, Krause BJ, Solbach C. Regulatorische Anforderungen an Radiopharmaka in Deutschland: die Fachgesellschaft im behördlichen Dialog. Nuklearmedizin. 2021 Feb;60(1):55-8, doi: 10.1055/a-1288-6725, Epub 2021/02/04 |
| StrlSchG 2017 | Gesetz zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzgesetz – StrlSchG) vom 27. Juni 2017 (BGBl. I S. 1966), das zuletzt durch Artikel 11 des Gesetzes vom 12. Dezember 2019 (BGBl. I S. 2510) geändert worden ist |
| StrlSchV 2018 | Verordnung zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzverordnung – StrlSchV) vom 29. November 2018. BGBl. I S. 2034, 2036, die durch Artikel 1 der Verordnung vom 27. März 2020 (BGBl. I S. 748) geändert worden ist |
| Wanke und Geworski 2014 | Wanke C, Geworski L. [Conservative calibration of a clearance monitor system for waste material from nuclear medicine]. Z Med Phys. 2014 Sep;24(3):252-60, doi: 10.1016/j.zemedi.2014.01.001, Epub 18. 02. 2014 |
Spezielle Erläuterungen zu
den einzelnen Therapieverfahren
Wissenschaftliche Begründung zur Empfehlung
1 Radionuklidtherapie von Schilddrüsenerkrankungen mit Iod-131 Radioiodtherapie (RIT)/(Radiojodtherapie) (RJT)
Im Kontext der Radioiodtherapie ist mit dem Begriff Radioiod das Isotop Iod-131 gemeint. Die Radioiodtherapie ist seit den 1950er Jahren in der Heilkunde zur Behandlung gut- und bösartiger Schilddrüsenerkrankungen fest etabliert.
1.1 Indikationen und Therapieziele
- 1.
-
Gutartige Erkrankungen der Schilddrüse (fokale oder disseminierte funktionelle Autonomie, Immunhyperthyreose vom Typ M. Basedow, behandlungsbedürftige Hypertrophie/Struma) mit dem Ziel der Elimination autonomer Schilddrüsengewebsanteile (Autonomie) oder Ablation (M. Basedow) von Schilddrüsengewebe bzw. einer Volumenreduktion.
- 2.
-
Maligne, von den Follikelzellen ausgehende Schilddrüsenerkrankungen (DTC Differentiated thyroid carcinoma (differenziertes Schilddrüsenkarzinom) und PDTC Poorly differentiated thyroid carcinoma (schlecht differenziertes Schilddrüsenkarzinom)) als adjuvante Therapie mit dem Ziel der Eradikation okkulter Metastasen bzw. verbliebenen Schilddrüsentumorgewebes und als positivem Nebeneffekt der Ablation von postoperativ verbliebenem Schilddrüsenrestgewebe. Die Radioiodtherapie wird auch erfolgreich in der primär metastasierten Situation lokaler Tumorpersistenz sowie im Rezidivfall eingesetzt.
1.2 Durchführung
1.2.1 Vorbereitung und Therapieplanung
Zu 1. Für die Durchführung der Radioiodtherapie (RIT) bei den gutartigen Erkrankungen ist eine stabile Schilddrüsenfunktion wünschenswert. Iodexzesse wie die Gabe iodhaltiger Röntgenkontrastmittel oder von Medikamenten etc. mit hohem Iodgehalt können die Radioiodtherapie für längere Zeiträume unmöglich machen. Die therapeutischen Zieldosen sind krankheitsabhängig fest etabliert (DGN-Handlungsempfehlung 2015). Um die für die erforderliche Zieldosis zu applizierende Aktivität zu ermitteln (abhängig von Zielvolumen, Iodaufnahme und Verweildauer in der Schilddrüse), erfolgt ein individueller Radioiodtest (RItest) mit einer im Vergleich zur Therapie geringen Test-Aktivität Iod-131 (Referenzaktivität). RItest und die RIT sollen in derselben Iodstoffwechselsituation erfolgen. Ist im Vorfeld eine therapeutische Thyreostase (pharmakologische Hemmung der Schilddrüsenfunktion) erforderlich, so führt eine kurze Einnahmepause vor der Therapie durch einen verbesserten Ioduptake (Iodaufnahme) meist zu einer signifikanten Reduktion der erforderlichen Iod-131-Therapieaktivität.
Da die in der RIT erzielte Herd-/Organ-Äquivalentdosis vom intrathyreoidalen (und bedingt auch allgemeinen) Stoffwechsel abhängt, kann im Einzelfall eine erhebliche Abweichung zwischen geplanter und erzielter Dosis auftreten, ohne dass ein Behandlungsfehler vorliegt. Diese Abweichung bleibt häufig ohne Konsequenzen auf den Behandlungserfolg, da die RIT eine sehr große therapeutische Breite aufweist.
Bei gutartigen Schilddrüsenerkrankungen steht die RIT teils in Konkurrenz zur operativen Intervention. Das sehr kleine Risiko eines strahleninduzierten Sekundärmalignoms – welches, falls es auftreten sollte, eine Latenz von vielen Jahren hat – ist vergleichbar mit dem der perioperativen Letalität. Der Vorteil der RIT besteht in der Vermeidung der möglichen OP-Komplikationen (Hypoparathyreoidismus (Nebenschilddrüsenunterfunktion), Recurrensparese (Lähmung des Stimmbandes), allgemeine OP-Komplikationen, seltene Komplikationen wie eine Lähmung der Schultermuskulatur durch Schädigung des N. accessorius oder die Schädigung des Ductus thoracicus mit der Konsequenz einer Lymphfistel) sowie Vermeidung von OP-Narbe und eventuell längerem Heilungsverlauf. Im Gegensatz zur Operation erfolgt der Wirkungseintritt der RIT allerdings mit einer Latenz von einigen Tagen bis wenigen Wochen. Die therapeutische Entscheidung Operation vs. Radioiodtherapie erfolgt nach individuellen klinischen und subjektiven Kriterien. Es gibt klinische Situationen, in denen medizinisch grundsätzlich beide Therapien in Frage kommen.
Zu 2. Bei der Therapie des differenzierten Schilddrüsenkarzinoms erfolgt die Radioiodtherapie vorwiegend adjuvant nach Thyreoidektomie mit dem Ziel, gegebenenfalls verbliebene geringe Tumorreste und okkulte Metastasen zu eliminieren und Rezidive zu verhindern. Die RIT zeigt in dieser Indikation nachgewiesene Wirksamkeit und weist anders als viele andere adjuvante onkologische Therapieverfahren ein sehr günstiges Nebenwirkungsprofil auf (siehe unten). Dies hat dazu geführt, dass sich die postoperative RIT in Deutschland als gut verträgliche Standard-Sicherheitsmaßnahme etabliert hat. Zudem hat die Radioiodtherapie auch ein kuratives Potenzial bei initial persistierendem Tumorrest oder Metastasen sowie im Rezidivfall (DGN 2015). Die Therapie erfolgt mit Standardaktivitäten (typisch 1 GBq bis 4 GBq, bei höherem Risikostatus bis 7 GBq und bei gezielter Metastasentherapie bis 18 GBq pro Zyklus). Bei adjuvanter Therapie ist eine prätherapeutische Dosimetrie in der Regel nicht sinnvoll, da das Ziel der Therapie potenziell vorhandene, okkulte, in der Bildgebung nicht erfassbare Metastasen sind. Die Radioiodtherapie des Schilddrüsenkarzinoms erfolgt unter TSH-Stimulation (Thyreoidea-stimulierendes Hormon), die durch eine mehrwöchige Thyroxinkarenz oder durch Applikation von rhTSH (recombinant human thyreoidea-stimulating hormone) erzielt werden kann. Für die Metastasentherapie ist rhTSH formal nicht zugelassen, kommt aber in begründeten Einzelfällen, in denen z. B. eine Thyroxinkarenz nicht/schlecht umsetzbar ist, nach entsprechender Aufklärung der Patientinnen und Patienten über den Off-Label-Use zum Einsatz. Die alimentäre Iodaufnahme sollte möglichst reduziert werden, jegliche andere Iodzufuhr vor und während Therapie soll vermieden werden, da eine Kompetition mit dem Radioiod zu einer Reduktion der Strahlendosis im Zielgewebe (Tumor) führt. Die zwingend erforderliche Therapiekontrolle nach adjuvanter Radiojodtherapie oder Rezidiv-/Metastasentherapie kann nur mit einem Nuklid erfolgen, das geeignet ist, auch gering iodspeicherndes Gewebe nachzuweisen. Damit scheiden Tc-99m grundsätzlich und Iod-123 wegen der zu kurzen Halbwertszeit aus. Diese Diagnostik erfolgt üblicherweise sechs bis zwölf Monate nach dem letzten Therapiezyklus mit Iod-131 und mit einer Aktivität von 0,4 GBq bis 1,0 GBq. Von Seiten des Strahlenschutzes gelten dieselben Regeln wie für die Therapie.
1.2.2 Allgemeiner Therapie-Ablauf
Vor der Radioiodtherapie erfolgt eine Aufklärung der Patientinnen und Patienten über die Erkrankung und das Ziel der Therapie. Dabei werden mögliche Nebenwirkungen und das Risiko der Induktion einer strahleninduzierten Neoplasie besprochen und ins Verhältnis zu den Risiken der unbehandelten Erkrankung gesetzt. Insbesondere werden auch alternative Therapien und deren Vor- und Nachteile im Verhältnis zur RIT besprochen.
Die RIT erfolgt in der Regel oral mit einer Kapsel, deren Aktivität der verordneten Aktivität mit einer Toleranz von +/- 10 % entspricht. Intravenöse Applikation oder orale Flüssigkeitsapplikation erfolgen aus Strahlenschutzgründen (u. a. Kontaminationsgefahr) nur in Ausnahmefällen. Die Radioiodtherapie erfolgt obligat stationär mit einer Mindestaufenthaltsdauer von 48 Stunden. Innerhalb dieser Zeit wird ein großer Teil der freien Aktivität renal ausgeschieden und zum Teil auch abgeatmet (bei der Therapie „benigner Erkrankungen“ typischerweise 30 % bis 70 %, bei Therapie „maligner Erkrankungen, bei der Thyroidektomie stattgefunden hat“ > 90 %). Die nach 48 Stunden im Körper verbleibende Aktivität ist überwiegend organisch gebunden. Zur Ermittlung des aus Strahlenschutzaspekten frühestmöglichen Entlasszeitpunktes und der Therapiedosis erfolgen während des stationären Aufenthalts Messungen der Dosisleistung in definiertem Abstand. Bei der Therapie gutartiger Schilddrüsenerkrankungen erfolgen zusätzliche Messungen zur Bestimmung der erzielten Therapiedosis im Zielgewebe.
Die Therapie wird stationär durchgeführt und die Entlassung erfolgt gemäß (SSK 1996) und Richtlinie Strahlenschutz in der Medizin (Abschnitt 9.1) frühestens nach 48 Stunden. Innerhalb dieser Zeit wird ein großer Teil der freien Aktivität renal ausgeschieden. Eine adäquate Behandlungsanlage für radioaktive Abwässer nach DIN 6844-2 ist daher obligat. Zum Zeitpunkt der Entlassung muss sichergestellt sein, dass die von Patientinnen und Patienten verursachte Exposition für Angehörige und Dritte nicht mehr als 1 mSv effektive Dosis verursacht (§ 80 Absatz 1 StrlSchG (StrlSchG 2017) § 122 Absatz 4 StrlSchV (StrlSchV 2018)). Dies ist sichergestellt, wenn zum Entlasszeitpunkt die in 2 m Abstand zur Patientenoberfläche gemessene Dosisleistung die Schwelle von < 3,5 µSv h-1 unterschreitet (SSK 1996).
1.2.3 Nebenwirkungen und Kontraindikationen
Nebenwirkungen der Radioiodtherapie können abhängig von der applizierten Aktivität auftreten. Dazu zählen (nur) bei der Schilddrüsenkrebsbehandlung z. B. passagere Übelkeit und vorübergehende geringe bis mäßige Schmerzsymptomatik bei Schilddrüsenrestgewebe. Funktionsminderungen der Ohrspeicheldrüsen (Parotiden) (Jentzen et al. 2006, Riachy et al. 2020) und teils der Tränendrüsen kommen vor allem bei Therapien mit hohen Aktivitäten vor (dann teils auch persistierend). Die Wahrscheinlichkeit für die Entstehung strahleninduzierter Sekundärmalignome ist von der applizierten Gesamtaktivität abhängig, die wiederum durch das individuelle Risiko bestimmt wird und insgesamt eine nachgeordnete Rolle spielt. Als Kontraindikation sind insbesondere Schwangerschaft und Stillperiode zu nennen.
Tabelle 1.1: Radionuklidtherapie mit Radioiod
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | – | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | – | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleit- substanzen in appl. Quantität |
– | – | – |
| Typischerweise applizierte Menge | – | – | – |
| Bezug/Herstellung von [131I]Iodid | |
|---|---|
| Bezeichnung | [131I]Iodid |
| Radiopharmakon kommerziell erhältlich | Ja |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | 2 116 (Kapsel)
0 281 (Lösung) 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung und Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | – |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.2 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.2 |
| Typischerweise anfallende Aktivitätsmenge im Reststoff pro Therapie (α, β, γ MBq) | – | – |
| Entsorgung von Reststoffen und Abwasser | Potenziell kontaminiertes Material wird zum Abklingen gelagert und nach Freigabe konventionell entsorgt. Die Ausscheidungen der Patientinnen und Patienten werden in einer Abwasseranlage (Abklinganlage) aufgefangen und nach Erreichen ausreichend niedriger Aktivitätskonzentrationen in die Kanalisation abgegeben. | |
| Applikation des Radiopharmakons | |||
|---|---|---|---|
| Art und Menge bei der Therapie benigner Erkrankungen |
Art und Menge im Rahmen der Diagnostik maligner Erkrankungen |
Art und Menge bei der Therapie maligner Erkrankungen |
|
| Typischerweise applizierte Aktivität pro Therapiezyklus | 200 MBq bis 1 200 MBq (in Einzelfällen bis 1 800 MBq) | 400 MBq bis 1 000 MBq | 2 GBq bis 11 GBq (in Einzelfällen 1 GBq bis 18 GBq) |
| Art der Applikation | In aller Regel oral | In aller Regel oral | In aller Regel oral |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 | 1 | 1 bis 2 |
| Typischer Zeitabstand zwischen Therapiezyklen | – | – | 3 bis 6 Monate |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Knochenmarksfunktion, Lunge
Limitierung wird nur im Ausnahmefall erreicht |
||
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [131I]Iodid | Schilddrüsenhormone |
| Wirkmechanismus des Radiopharmakons | Destruktion von funktionsaktivem Schilddrüsen(tumor)gewebe nach Internalisation über den NaI-Symporter | – |
| Bioverteilung/Spezifische Anreicherung in | Schilddrüse einschließlich differenziertem Schilddrüsenkarzinom | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Speicheldrüse, Magen, Blase (Ausscheidung); aktivierter Thymus, laktierende Mamma | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Bei der Therapie benigner Erkrankungen:
Hypothyreose, passageres Druckgefühl über wenige Stunden ohne wesentlichen Krankheitswert. Bei der Therapie maligner Erkrankungen: Funktionsreduktion der Speicheldrüsen, nicht immer subjektiv beeinträchtigend wahrnehmbar. |
– |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |||
|---|---|---|---|
| Therapie benigner Erkrankungen |
Adjuvante Therapie maligner Erkrankungen |
Therapie maligner Erkrankungen bei aktivem Tumorgeschehen |
|
| Typische effektive Dosis pro Einzeltherapie pro Patientin/Patient (pro Anwendung) | Variabel | Variabel | Variabel |
| Typische effektive Dosis (Summe aller Zyklen für Patientin/Patient) | Variabel | Variabel | Variabel |
| Dosislimitierendes Organ | – | Knochenmark wird nahezu nie erreicht | Knochenmark Lunge wird nur ausnahmsweise erreicht |
| Angestrebte Dosis Zielregion | Krankheitsabhängig 100 bis 400 Gy | Risikoabhängige Standardaktivität | Meist Standardaktivitäten; mittels Blutdosimetrie kann gegebenenfalls die maximale Therapieaktivität ermittelt werden. Bei Läsionsdosimetrie werden >> 100 Gy angestrebt |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Sondenmessung oder Szintigraphie jeweils mit Iod-131 | Szintigraphische Darstellung von Schilddrüsenrestgewebe; keine Dosimetrie | Bildgebung bei Rezidiv (lokal oder Metastasen); gegebenenfalls Bildgebung und Dosimetrie mit PET/CT mit Iod-124 |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Posttherapeutische Verteilungsszintigraphie erforderlich. Intratherapeutische Dosimetrie. Bestimmung der Dosisleistung zur Entlassung |
Bildgebung (Verteilungsszintigraphie); Dosimetrie des Zielvolumens nicht regelhaft möglich, daher nicht pauschal zu fordern. Bestimmung der Dosisleistung zur Entlassung | Bildgebung (Verteilungsszintigraphie); Dosimetrie des Zielvolumens nicht regelhaft möglich, daher nicht pauschal zu fordern. Bestimmung der Dosisleistung zur Entlassung |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientin/Patient | |
| Ausgeschiedene Nuklide | Iod-131 |
| Arten der Ausscheidung | Renal/Urin, gastrointestinal/Stuhl, pulmonal/Atemluft |
| Relevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 Tage |
| Umgang mit Ausscheidung stationär und poststationär | Abwasseranlage (Abklinganlage) (Stationär) |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | γ |
| Relevanteste Art(en) der Strahlung durch Patientin/Patient | γ |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Schilddrüse |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | Benigne: zumeist 2 bis 5 Tage
Maligne: zumeist 2 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär und poststationär | Therapiestation mit Abwasseranlage (Abklinganlage)
Poststationär: in erster Linie Hygiene, eventuell Abstand von Angehörigen |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Typische Dosis für eine(n) Haushaltsangehörige(n) pro Einzeltherapie | < 1 mSv1 |
| Über eine typische Anzahl Zyklen summierte Dosis für Haushaltsangehörige pro Einzeltherapie (</> 1 mSv) | < 1 mSv2 |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthaltsdauer erforderlich | Bei vorhersehbar wiederholten Therapien muss bei der Entlassung auf die Einhaltung des Grenzwertes für alle Therapien (in einem Kalenderjahr) geachtet werden. Eine Expositionsberechnung ist nur unter besonderen Umständen erforderlich, z. B. wenn eine möglichst frühzeitige Entlassung pflegebedürftiger Patientinnen und Patienten beabsichtigt ist |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Ja |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Auffangen der Ausscheidungen, Strahlenschutz der Bevölkerung, Durchführung der intratherapeutischen Dosimetrie |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt, stationäre Aufnahme erforderlich |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Benigne:
Therapie der (gegebenenfalls medikamentös rekompensierten oder latenten) Hyperthyreose z. B. bei Autonomie der Schilddrüse, bei oder nach Immunhyperthyreose vom Typ M. Basedow, Strumaverkleinerung, Restgewebsablation bei M. Basedow Maligne: Adjuvante Therapie („Ablationstherapie“), Rezidiv oder Metastasentherapie |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Entfällt |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | Ja |
| Erstattung | |
|---|---|
| Stationär | DRG |
| Ambulant | Entfällt, da nicht erlaubt |
| Probleme mit fehlender Erstattung | – |
2 Radionuklidtherapie mit PSMA-Liganden
PSMA (Prostata-spezifisches Membran-Antigen) ist ein Membran-gebundenes Protein, welches auch in der normalen Prostata gebildet wird und beim Prostatakarzinom bzw. in dessen Metastasen v. a. im Stadium der Kastrationsresistenz überexprimiert wird. Das nuklearmedizinische Arzneimittel lokalisiert PSMA-positives Prostatatumorgewebe und kann sowohl Knochen- als auch Weichteilmetastasen detektieren. Die Therapie wird mittels eines Radiopharmakons (PSMA-Ligand) durchgeführt, an das ein Radionuklid wie z. B. Lutetium-177 gekoppelt ist. Das Therapieziel ist eine Destruktion, zumindest aber Hemmung oder Verlangsamung des Wachstums von Tumorzellen, z. B. in Knochen- und Weichteilmetastasen.
2.1 Indikationen und Therapieziele
Die PSMA-Ligandentherapie wird derzeit bei Patientinnen und Patienten mit kastrationsresistentem Prostatakarzinom mit Weichteil- und/oder auch Knochenmetastasen eingesetzt.
Dabei müssen folgende Voraussetzungen erfüllt sein:
- 1.
-
histologisch gesichertes Prostatakarzinom
- 2.
-
PSMA-positive Metastasen (PSMA-PET oder PSMA-Szintigraphie)
- 3.
-
Progress unter Therapie.
Die Indikationsstellung erfolgt unter Berücksichtigung aller klinischer Informationen und insbesondere auch der alternativen Therapieoptionen für jede Patientin und jeden Patienten individuell. Die Fallvorstellung in einem interdisziplinären Tumorboard ist dafür ein etabliertes Mittel. Die PSMA-Ligandentherapie stellt insgesamt eine Ergänzung des bisherigen Therapiespektrums dar. Eine Zulassung für [177Lu]Lu-PSMA-617 in den USA (Handelsname PLUVICTOTM) erfolgte im März 2022 auf Basis der positiven Ergebnisse einer Phase-III-Studie (VISION) inklusive des Erreichens der primären Endpunkte (Sartor et al. 2021). Die Zulassung in Europa wird in naher Zukunft erwartet. Bei dieser Phase-III-Studie wurden Patientinnen und Patienten mit metastasiertem kastrationsresistentem Prostatakarzinom und Z. n. mindestens einer Linie der Chemotherapie (mittels Docetaxel) sowie Z. n. mindestens einer Linie der Neue-Generation-Antiandrogentherapien (Abiraterone/Enzalutamide) eingeschlossen (Rahbar et al. 2019). Darüber hinaus wird an einigen Zentren die Actinium-225-(Alphastrahler-)gebundene PSMA gerichtete Therapie bei Patientinnen und Patienten nach Therapieversagen nach [177Lu]Lu-PSMA-617 eingesetzt (Feuerecker et al. 2021). Ein alleiniger Einsatz dieser Therapie wird noch im Rahmen von prospektiven Studien evaluiert werden müssen. Die australische Phase-II-Studie (Hofman et al. 2021) hat die Effektivität von [177Lu]Lu-PSMA-617 mit der Zweitlinienchemotherapie Cabazitaxel verglichen. Dabei zeigte die Therapie mit [177Lu]Lu-PSMA-617 ein besseres biochemisches Ansprechen bei geringerer Nebenwirkungsrate (Hofman et al. 2021). Somit ist die Durchführung der Zweitlinienchemotherapie vor einer möglichen [177Lu]Lu-PSMA-617-Therapie nicht zwingend erforderlich.
2.2 Durchführung
2.2.1 Vorbereitung und Therapieplanung
Nach Indikationsstellung werden den Patientinnen und Patienten das Therapieziel, die Durchführung der Therapie, mögliche Nebenwirkungen sowie die Alternativen erläutert, bevor einvernehmlich die Therapieentscheidung getroffen wird. Vor Therapie erfolgt u. a. eine Nierenfunktionsszintigraphie zum Ausschluss einer Abflussstörung. Sollte eine Abflussstörung vorliegen, sollte gegebenenfalls von urologischer Seite der Abfluss, wenn möglich z. B. mittels Einlage von Schienen, wiederhergestellt werden.
2.2.2 Allgemeiner Therapie-Ablauf
In der Regel wird bei der Therapie mit [177Lu]Lu-PSMA-Ligand eine Serie mit bis zu sechs Zyklen im Abstand von sechs bis acht Wochen durchgeführt; im Einzelfall sind weitere Zyklen in einer Serie oder weitere Serien nach Therapiepause und jeweils erneuter Vorstellung zur Tumorbehandlung möglich.
Übliche Therapieaktivitäten sind 6,0 GBq oder 7,4 GBq [177Lu]Lu-PSMA-Ligand (PSMA-617 oder PSMA-I&T (Imaging & Therapy)). Nach je zwei Zyklen wird eine PSMA-Bildgebung zur Therapiekontrolle durchgeführt, um das Therapieansprechen oder -versagen rechtzeitig festzustellen und um gegebenenfalls die Therapie zu wechseln.
Die Therapie wird stationär durchgeführt. Innerhalb von 48 Stunden wird ein großer Teil (bis zu 80 %) der freien Aktivität renal ausgeschieden (Kurth et al. 2018). Eine Unterbringung in einer nuklearmedizinischen Therapiestation mit adäquater Rückhalte- und Abwasseranlage (Abklinganlage) nach DIN 6844-2 für radioaktive Abwässer (DIN 6844-2 2020) ist daher für mindestens 48 Stunden obligat. Im Anschluss muss zum Zeitpunkt der Entlassung sichergestellt sein, dass die von Patientinnen und Patienten ausgehende ionisierende Strahlung für Angehörige und Dritte nicht mehr als 1 mSv effektive Dosis verursacht (§ 80 Absatz 1 StrlSchG (StrlSchG 2017), § 122 Absatz 4 StrlSchV (StrlSchV 2018)). Dies wird sichergestellt, indem analog zur Radioiodtherapie die zum Entlasszeitpunkt in 2 m Abstand zur Patientenoberfläche gemessene Dosisleistung eine Schwelle unterschreitet, die bei Anwendung des Dosisintegrals einen Wert kleiner 1 mSv gewährleistet (SSK 1996). Bei der Festlegung der Schwelle muss berücksichtigt werden, dass die PSMA-gerichtete Therapie aus mehreren innerhalb eines Kalenderjahres verabreichten Zyklen besteht/bestehen kann. Daher ist der Entlassgrenzwert entsprechend der Anzahl der Therapiezyklen anzupassen. Tabelle 2.1 fasst diese verschiedenen Schwellen gemäß Stoll unter Berücksichtigung der physikalischen Halbwertszeit von Lutetium-177 zusammen (Stoll 2018).
Tabelle 2.1: Zu unterschreitende Dosisleistung in 2 m Abstand von der Körperoberfläche der Patientinnen und Patienten in Abhängigkeit der Anzahl der Therapiezyklen pro Kalenderjahr
| Anzahl der Zyklen pro Kalenderjahr | 1 | 2 | 3 | 4 |
| Dosisleistung zum Entlasszeitpunkt | 4,3 µSv h-1 | 2,2 µSv h-1 | 1,4 µSv h-1 | 1,1 µSv h-1 |
Alternativ kann durch mehrere Dosisleistungsmessungen pro Zyklus die patientenindividuelle effektive Halbwertszeit bestimmt werden, welche dann im Dosisintegral statt der physikalischen Halbwertszeit angewendet wird (Kurth et al. 2018). Allerdings muss für jeden Zyklus die zu erwartende Dosis für Angehörige und Dritte berechnet und für die folgenden Zyklen aufsummiert werden. Die Entlasszeitpunkte sind davon abhängig zu wählen.
Als Alternative oder Ergänzung zur Therapie mit [177Lu]Lu-PSMA-Ligand kann experimentell eine Therapie mit dem Alphastrahler-basierten Actinium-225-Liganden durchgeführt werden. Die Actinium-225-Therapie hat Wirksamkeit gezeigt bei Patientinnen und Patienten, in denen die [177Lu]Lu-PSMA-Ligandentherapie keine Wirkung (mehr) zeigte (Feuerecker et al. 2021). Bei der Therapie mit Actinium-225 markierten PSMA-Liganden ist keine Anpassung des Entlasszeitpunktes notwendig, da die außerhalb des Patientenkörpers messbare Strahlung keinen signifikanten Dosisbeitrag für Angehörige und Dritte liefert. Eine stationäre Behandlung der Patientinnen und Patienten für mindestens 48 Stunden ist aber aufgrund der auch hier hohen renalen Ausscheidungsraten von bis zu 80 % und des Erfordernisses des Rückhalts des kontaminierten Abwassers dringend empfohlen.
2.2.3 Nebenwirkungen und Kontraindikationen
Nebenwirkungen
Grundsätzlich wird die PSMA-Ligandentherapie von den Patientinnen und Patienten gut vertragen. Es werden jedoch PSMA-Ligandentherapie-spezifische, aber auch strahlungsbedingte Nebenwirkungen beschrieben.
- –
-
Schmerzen an der Injektionsstelle bei Injektion
- –
-
selten Unwohlsein, Übelkeit und Erbrechen nach Injektion
- –
-
Gewichtsabnahme, Abgeschlagenheit (auch durch die Grunderkrankung möglich)
- –
-
Akute (reversible) Blutbild-Veränderungen (Leukopenie, Thrombozytopenie und Erythropenie), dabei kann vor allem eine Erniedrigung der Erythrozyten auch durch eine Knochenmarkinfiltration durch den Tumor erklärbar sein
- –
-
Funktionsbeeinträchtigung der Leber und der Nieren
- –
-
Chronische Schädigung der Speicheldrüsen, selten auch der Tränendrüsen durch Induktion von Sekundärmalignomen. Hierzu liegen bisher ungenügend Daten vor und dürften sich in der Größenordnung wie bei breit etablierten Therapien wie z. B. der Radioiodtherapie bewegen.
Kontraindikationen
- –
-
Lebenserwartung < 6 Monate (ECOG (Eastern Cooperative Oncology Group) > 2), außer wenn die Therapie der Verbesserung der erkrankungsbedingten Symptome dient
- –
-
Nicht akzeptables medizinisches Risiko oder Kontraindikationen gegen eine stationäre Unterbringung auf der Therapiestation aus Gründen des Strahlenschutzes (z. B. Demenz, Kontaminationsgefahr, z. B. durch Inkontinenz).
- –
-
Nierenfunktionseinschränkung: Obstruktion oder Hydronephrose mit Funktionseinschränkung, (GFR (Glomeruläre Filtrationsrate)) < 30 ml min-1 oder Kreatinin > 2fach obere Normgrenze
- –
-
Myelosuppression:
- –
-
Leukozyten < 2,5∙109 l-1
- –
-
Thrombozyten < 75∙109 l-1
- –
-
Aktive Infektion inklusive aktiver oder symptomatischer viraler Hepatitis
Relative Kontraindikationen (zur Diskussion z. B. im Rahmen einer Tumorkonferenz)
- –
-
Myokardinfarkt oder arterielle Thromboembolie in den letzten 3 Monaten
- –
-
Herzinsuffizienz NYHA (New York Health Association) III – IV
- –
-
Hirnmetastasen (eine Vorstellung in der Strahlentherapie sollte erfolgen)
- –
-
Zweitmalignome mit schnellem Progress
- –
-
Nierenfunktion einschränkende Erkrankungen oder Medikamente
- –
-
Nicht behandelbare Harnstauungsniere (Sonographie, NSz (Nierenszintigraphie)) (relative Kontraindikation)
Tabelle 2.2: Radionuklidtherapie mit [177Lu]Lu-PSMA-Liganden
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | PSMA-Liganden (Prostataspezifisches Membranantigen) PSMA-617, PSMA I&T etc. | Keine | Antiemetika |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Typischerweise applizierte Menge | Ca. 100 µg bis 200 µg (bei Markierung mit non-carrier-added Lutetium-177) | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bezug/Herstellung genutzter Radiopharmaka | ||
|---|---|---|
| [177Lu]Lu-PSMA-617 | [177Lu]Lu-PSMA-I&T | |
| Bezeichnung | [177Lu]Lu-PSMA-617 | [177Lu]Lu-PSMA-I&T |
| Radiopharmakon kommerziell erhältlich | Nein
Phase-III-Studie beendet (Sartor et al. 2021);Zulassung in den USA 3/2022 erfolgt, in Europa erwartet |
Nein |
| Eigenherstellung mit welchen zugelassenen Komponenten | [177Lu]LuCl3 zur Radiomarkierung | [177Lu]LuCl3 zur Radiomarkierung |
| Existierende Monographien (Ph. Eur.) | 2798 [177Lu]LuCl3 zur Radiomarkierung
0125 (Radioaktive Arzneimittel) |
2798 [177Lu]LuCl3 zur Radiomarkierung
0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | PSMA-617 | PSMA I&T |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | A: Lutetium-177
B: Lutetium-177m (bei nicht trägerfreiem Lutetium-177) |
A: Lutetium-177
B: Lutetium-177m (bei nicht-trägerfreiem Lutetium-177) |
| Art der Strahlung (%α, %β, %γ) | Siehe Tabelle A-1.6 | Siehe Tabelle A-1.6 |
| Energiespektren (α, β, γ) | Siehe Tabelle A-1.6 | Siehe Tabelle A-1.6 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | Ca. 600 MBq Lutetium-177 (Rest in Flasche von Lieferung) | Ca. 200 MBq (Rest in Flasche) |
| Entsorgung von Reststoffen und Abwasser | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung.
Bei Resten von Lutetium-177m gegebenenfalls auch Entsorgung über Landessammelstelle |
Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung.
Bei Resten von Lutetium-177m gegebenenfalls auch Entsorgung über Landessammelstelle |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | 6 000 MBq bis 7 400 MBq Lutetium-177 pro Therapiezyklus |
| Art der Applikation | i. v. |
| Typische Anzahl an Applikationen/Therapiezyklen | In der Regel 6 Therapiezyklen, eine Wiederaufnahme der Therapie möglich bei erneutem Progress |
| Typischer Zeitabstand zwischen Therapiezyklen | 6 bis 8 Wochen |
| Limitierende Faktoren für Wiederholung (z. B. Dosis-limitierendes Organ) | Blutbild (Knochenmark), Nierenfunktion (Niere), Speicheldrüsen |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [177Lu]Lu-PSMA-617; [177Lu]Lu-PSMA-I&T | – |
| Wirkmechanismus des Radiopharmakons | Bindung an der extrazellulären Komponente von PSMA, gefolgt von Internalisierung | – |
| Bioverteilung/Spezifische Anreicherung in | Prostatakarzinomzellen und deren Metastasen | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Niere, Leber, Speicheldrüsen, Tränendrüsen, prox. Duodenum | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Übelkeit/Erbrechen, Hämatotoxizität, Müdigkeit | – |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientin/Patient (pro Anwendung) | 0,44 Gy bei 7,4 GBq |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | 2,64 Gy bei 6 Zyklen |
| Dosislimitierendes Organ | Knochenmark, selten Niere (beide potenziell dosislimitierend) |
| Angestrebte Dosis Zielregion | Unbekannt |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Targetnachweis erforderlich (PSMA-targeted PET/CT, PET/MRT oder SPECT/CT) |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Bestimmung der Dosisleistung zur Entlassung, Posttherapeutische Verteilungsszintigraphie erforderlich, zusätzliche Bildgebung zwischen den Therapiezyklen optional, Quantifizierung optional, Dosimetrie während 1. Zyklus für ca. sieben Tage (variable Protokolle) |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | Lutetium-177 |
| Arten der Ausscheidung | Renal/Urin, gering gastrointestinal/Stuhl |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 bis 3 Tage |
| Umgang mit Ausscheidung stationär & poststationär | Abwasseranlage (Abklinganlage) (Stationär)
Poststationär: Empfehlung an die Patienten zum Sammeln von Vorlagen oder ähnlichem für mehrere Tage; idealerweise Toilette nach Benutzung mehrfach spülen |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | Durch Patientinnen und Patienten nahezu nur γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | γ |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Metastasen, in den ersten Tagen die Nieren |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | ca. 3 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Therapiestation mit Abwasseranlage (Abklinganlage)
Poststationär: Toilettenhygiene, Abstand zu vulnerablen Personen |
| Umgebung (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | 0,07 mSv – 0,26 mSv |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv3 (Hinweis: gegebenenfalls Anpassung des Entlasszeitpunktes in Abhängigkeit von der Anzahl der Zyklen pro Kalenderjahr) |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Ja, wenn eine vorzeitige Entlassung unter Berücksichtigung des sozialen Umfelds notwendig ist: Werden mehr als vier bis sechs Zyklen im Kalenderjahr angewendet, ist eine patientenindividuelle Berechnung der zu erwartenden Dosen für Personen im Haushalt auf Basis der jeweiligen Entlassdosisleistungen gegebenenfalls notwendig |
| Hospitalisierungskonzept | |
|---|---|
| Erforderlich | Ja |
| Typischerweise empfohlene Hospitalisierungsdauer | ca. 3 Nächte |
| Mögliche Gründe für verlängerte Hospitalisierungsdauer | Dosimetrie, häusliche Umstände, Allgemeinzustand |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Dosimetrie, Strahlenschutz
Häufig eingeschränkter Allgemeinzustand, daher palliativmedizinische Versorgung erforderlich |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt, da nicht erlaubt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Nein |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Derzeit keine |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Bei Patientinnen und Patienten mit mCRPC nach Ausschöpfung aller sinnvollen leitliniengerechten Therapieoptionen |
| Neue Indikationen im Rahmen von Studien/Forschung | Im Rahmen von klinischen Studien wird der Einsatz von PSMA-gerichteter Radioligandentherapie in allen Stadien der Erkrankung erprobt |
| Therapie bereits in Leitlinien eingegangen | Ja (z. B. Deutsche S3-Leitlinie Prostatakarzinom) |
| Erstattung | |
|---|---|
| Stationär | DRG (aktuell M10B) |
| Ambulant | Entfällt, da nicht erlaubt |
| Probleme mit fehlender Erstattung | Aufwand der Dosimetrie sowie Bildgebung nicht abgebildet |
Tabelle 2.3: Radionuklidtherapie mit [225Ac]Ac-PSMA-Liganden
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | PSMA-Liganden (Prostataspezifisches Membran-Antigen) PSMA-617 |
Keine | Antiemetika |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Typischerweise applizierte Menge | 10 µg bis 20 µg pro MBq | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bezug/Herstellung von [225Ac]Ac-PSMA-617 | |
|---|---|
| Bezeichnung | [225Ac]Ac-PSMA-617 |
| Radiopharmakon kommerziell erhältlich | Nein |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | PSMA-617
[225Ac]AcCl3 zur Radiomarkierung [225Ac]Ac(NO3)3 zur Radiomarkierung |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | Actinium-225 | – |
| Art der Strahlung (%α, %β, %γ) | Siehe Tabelle A-1.10 | – |
| Energiespektren (α, β, γ) | Siehe Tabelle A-1.10 | – |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | weniger als 1 MBq Actinium-225 (Rest in Flasche von Lieferung) | – |
| Entsorgung von Reststoffen und Abwasser | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung | – |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | 100 kBq kg-1 KG |
| Art der Applikation | i. v. |
| Typische Anzahl an Applikationen/Therapiezyklen | 3 bis 4 Zyklen |
| Typischer Zeitabstand zwischen Therapiezyklen | 6 bis 8 Wochen |
| Limitierende Faktoren für Wiederholung (z. B. Dosis-limitierendes Organ) | Speicheldrüsen, Blutbild (Knochenmark), Nierenfunktion (Niere) |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [225Ac]Ac-PSMA-617 | – |
| Wirkmechanismus des Radiopharmakons | Bindung an der extrazellulären Komponente von PSMA gefolgt von Internalisation | – |
| Bioverteilung/Spezifische Anreicherung in | Prostatakarzinomzellen und deren Metastasen | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Niere, Leber, Speicheldrüsen, Tränendrüsen, prox. Duodenum | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Xerostomie; Übelkeit/Erbrechen, Hämatotoxizität, Müdigkeit, Augentrockenheit | – |
| Seltene schwere Nebenwirkungen | – | |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientin/Patient (pro Anwendung) | 329 mGy bei 7 MBq (Kratochwil et al. 2016, Kratochwil et al. 2017) |
| Typische effektive Dosis (Summe aller Zyklen für Patientin/Patient) | 1,97 Gy bei 6 Zyklen (Kratochwil et al. 2016) |
| Dosislimitierendes Organ | Knochenmark, Speicheldrüsen, selten Niere (jeweils potenziell dosislimitierend) |
| Angestrebte Dosis Zielregion | Unbekannt |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Targetnachweis erforderlich (PSMA-targeted PET/CT, PET/MRT oder SPECT/CT) |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Posttherapeutische Verteilungsszintigraphie erforderlich, zusätzliche Bildgebung zwischen den Therapiezyklen optional, Quantifizierung optional
Dosimetrie während 1. Zyklus für ca. 7 Tage (variable Protokolle) |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt durch Patientinnen und Patienten | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | Actinium-225
Bismut-213 Blei-209 |
| Arten der Ausscheidung | Renal/Urin, gering gastrointestinal/Stuhl |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 bis 3 Tage |
| Umgang mit Ausscheidung stationär & poststationär | Abwasseranlage (Abklinganlage) (Stationär)
Poststationär: Empfehlung an die Patienten zum Sammeln von Vorlagen oder ähnlichem für mehrere Tage; idealerweise Toilette nach Benutzung mehrfach spülen |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | Durch die Patientinnen und Patienten nur γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | γ |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Zielgewebe, initial Nieren |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | ca. 3 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Therapiestation mit Abwasseranlage (Abklinganlage)
Poststationär: Toilettenhygiene, Abstand von gefährdeten Populationen |
| Dosis für die Umgebung des Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | Bei stationärer Therapie ist von geringer Dosis auszugehen |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | Bei stationärer Therapie ist von geringer Dosis auszugehen |
| Hospitalisierungskonzept | |
|---|---|
| Erforderlich | Ja |
| Typischerweise empfohlene Hospitalisierungsdauer | 48 h (2 Nächte) |
| Mögliche Gründe für verlängerte Hospitalisierungs-dauer | Allgemeinzustand, Komorbiditäten |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Dosimetrie, Strahlenschutz
häufig eingeschränkter Allgemeinzustand, daher palliativmedizinische Versorgung erforderlich |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Keine |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Derzeit keine |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Bei Patientinnen und Patienten mit mCRPC nach Ausschöpfung aller sinnvollen leitliniengerechten Therapieoptionen inklusive [177Lu]Lu-PSMA-617; nach Entscheidung von interdisziplinärem Tumorboard |
| Neue Indikationen im Rahmen von Studien/Forschung | Zu erwarten, aktuell aber keine größeren laufenden klinischen Prüfungen zur Indikationsausweitung bekannt. |
| Therapie bereits in Leitlinien eingegangen | Nein |
| Erstattung | |
|---|---|
| Stationär | Keine generelle Regelung |
| Ambulant | Entfällt |
3 Radionuklidtherapie von neuroendokrinen Tumoren mit Lutetium-177- und Yttrium-90-markierten Somatostatinanaloga (PRRT)
Die Peptidrezeptor-Radionuklidtherapie (PRRT) bezeichnet die Therapie von neuroendokrinen Tumoren mit meist Lutetium-177-, seltener Ytterium-90-markierten Somatostatinanaloga.
3.1 Indikationen und Therapieziele
Die PRRT mit [177Lu]Lu-DOTATATE (LutatheraTM) ist eine zugelassene und in der Routine eingesetzte Therapie für die Behandlung von nicht resezierbaren oder metastatischen, progressiven, gut differenzierten (G1 und G2) Somatostatinrezeptor-positiven gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NETs Gastro-Entero-Pankreatische Neuroendokrine Tumoren) bei Erwachsenen. Nicht zugelassene Einsatzgebiete betreffen NEN (Neuroendokrine Neoplasien) der Lunge, G3 NET, NEK (Neuroendokrine Karzinome) Meningeome, MINEN (mixed neuroendocrine non-neuroendocrine neoplasms) G1/G2 NET CUP (d. h. mit unbekannter Lokalisation des Primärtumors) und andere. In aktuellen nationalen wie internationalen Leitlinien wird die PRRT bei Ileum-NET in der zweiten Linie nach einer Therapie mit Somatostatinanaloga empfohlen, bei pankreatischen NET teils ebenfalls in der zweiten Linie nach Somatostatinanaloga, teils auch erst nach Durchführung einer Chemotherapie empfohlen. Die PRRT hat im Vergleich zu den anderen möglichen Therapien (Chemotherapie, Everolimus, Sunitinib, Ausnahme: Somatostatinanaloga) vergleichsweise geringe Nebenwirkungsraten, ist gut verträglich und führt zu einer besseren Lebensqualität der betroffenen Patientinnen und Patienten.
3.2 Durchführung
3.2.1 Vorbereitung und Therapieplanung
Voraussetzung für eine PRRT ist eine nachgewiesene Expression von Somatostatinrezeptoren möglichst aller NET-Läsionen. Üblicherweise geschieht dieser Nachweis durch eine Speicherung aller Herde in einer Positronen-Emissions-Tomografie (PET) mit Gallium-68-markierten Somatostatinanaloga (z. B. DOTATATE, DOTATOC); die Speicherung der Leber in dieser PET wird üblicherweise als Referenz für eine ausreichende Speicherung der Herde genommen. Meist wird ein Progress der Erkrankung vorausgesetzt, allerdings kommt die PRRT auch im Falle prognostisch ungünstiger Faktoren wie einer hohen hepatischen Tumorlast zum Einsatz. Eine obstruktiv bedingte Hydronephrose soll vor Therapiebeginn ausgeschlossen werden.
3.2.2 Allgemeiner Therapieablauf
Die PRRT wird als Kurzinfusion durchgeführt. Üblicherweise werden vier Therapien mit jeweils 7,4 GBq im Abstand von acht bis zwölf Wochen durchgeführt. Im Rahmen der ersten Therapie sollte wünschenswerterweise eine Dosimetrie zur Bestimmung der Dosis von relevanten Organen durchgeführt werden. Dosisbegrenzende Organe stellen die Nieren und das Knochenmark dar, wobei bislang keine Dosis-Wirkungs-Beziehung und keine reliablen Grenzwerte für Toxizitäten etabliert sind. Um die Organ-Äquivalentdosis der Nieren um 40 % bis 50 % zu senken, wird eine halbe Stunde vor Therapiebeginn mit einer Infusion einer Arginin-Lysin-Lösung (enthaltend je 25 g) begonnen. Da diese Infusion Übelkeit hervorrufen kann, wird häufig prophylaktisch mit Antiemetika wie Ondansetron therapiert. Bei einer hohen hepatischen Tumorlast, Hirnmetastasen oder Knochenmetastasen, bei denen das Risiko einer schwellungsbedingten Komplikation besteht, werden Kortikosteroide gegeben. Analog zur Lutetium-177-PSMA-Therapie muss die Dosisleistung, gemessen in 2 m Abstand, den Entlassgrenzwert in Abhängigkeit von der Zyklenanzahl pro Kalenderjahr nach Tabelle 2.1 unterschreiten. Frühestens 48 Stunden nach Therapiebeginn erfolgt eine Messung der Dosisleistung. Die Therapie wird stationär durchgeführt. Innerhalb von 48 Stunden wird ein großer Teil von [177Lu]Lu-DOTATATE renal ausgeschieden (ca. 80 %, (Esser et al. 2006)). Eine Unterbringung in einer nuklearmedizinischen Therapiestation mit adäquater Rückhalte- und Abwasseranlage (Abklinganlage) für radioaktive Abwässer ist daher für mindestens 48 Stunden obligat. Im Anschluss muss zum Zeitpunkt der Entlassung sichergestellt sein, dass die von Patientinnen und Patienten ausgehende ionisierende Strahlung für Angehörige und Dritte nicht mehr als 1 mSv effektive Dosis verursacht (§ 80 Absatz 1 StrlSchG (StrlSchG 2017), § 122 Absatz 4 StrlSchV (StrlSchV 2018)). Dies wird sichergestellt, indem die zum Entlasszeitpunkt in 2 m Abstand zur Patientenoberfläche gemessene Dosisleistung eine Schwelle unterschreitet, die bei Anwendung des Dosisintegrals einen Wert kleiner 1 mSv gewährleistet (SSK 1996). Es ist zu berücksichtigen, dass abhängig vom Nuklidproduktionsprozess teilweise metastabiles Lutetium-177m mit einer Halbwertszeit von 160,4 Tagen enthalten sein kann. Neben dem zugelassenen [177Lu]Lu-DOTATATE werden noch weitere Somatostatinanaloga wie Lutetium-177-markiertes DOTATOC und HA-DOTATATE verwendet. Des Weiteren werden auch Somatostatinrezeptorantagonisten verwendet, die aktuell in einer laufenden Arzneimittelstudie (177Lu OPS201 = Satoreotide tetraxetan) evaluiert werden. Vorteil dieser Antagonisten scheint eine höhere Bindung an die Somatostatinrezeptoren mit konsekutiv höherer Tumordosis zu sein; Nachteil könnte eine höhere Organ-Äquivalentdosis des Knochenmarks und der Nieren sein. Neben Lutetium-177 wird auch Yttrium-90 verwendet, das jedoch aufgrund seiner höheren Nephrotoxizität (Bodei et al. 2008) zunehmend selten zum Einsatz kommt.
3.2.3 Kontraindikationen und Nebenwirkungen
Eine Schwangerschaft sowie Stillen stellen absolute Kontraindikationen dar. Eine ausreichend gute Nierenfunktion sowie eine ausreichende Knochenmarkreserve sind Voraussetzungen für die Durchführung einer PRRT. Evidenzbasierte Grenzwerte hierfür existieren nicht. Die aktuelle Leitlinie der NANETS/SNMMI (Hope et al. 2020) nennt eine GFR von 30 ml min-1 als unteren Grenzwert der Nierenfunktion. Ebenso existieren keine evidenzbasierten Grenzwerte für Hämoglobin, Thrombozyten und Leukozyten. In der oben genannten Leitlinie werden folgende Werte als Orientierung genannt: Hämoglobin 8 g dl-1, Leukozyten 2 T ml-1, Thrombozyten 70 T ml-1 (Hope et al. 2019).
An akuten Nebenwirkungen können Übelkeit und Erbrechen (bedingt durch die Aminosäureinfusionen), abdominelle Schmerzen, Durchfälle, Abgeschlagenheit, milder Haarausfall und Geschmacksveränderungen auftreten.
Relevante Nebenwirkungen betreffen vor allem die Nieren und das blutbildende Knochenmark. Eine höhergradige (Grad 3/4) Thrombozytopenie tritt in 2 %, eine Lymphozytopenie in 9 %, eine Leukopenie in 1 % und eine Neutropenie in 1 % aller Patientinnen und Patienten auf (Strosberg et al. 2017). Ein myelodysplastisches Syndrom ist in ca. 2 % bis 3 % aller Patientinnen und Patienten nach ca. zwei Jahren beschrieben. Eine höhergradige Nephrotoxizität tritt in weniger als 2 % aller Patientinnen und Patienten auf.
Tabelle 3.1: Radionuklidtherapie mit 177Lu- und 90Y-markierten Somatostatinanaloga
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | DOTATATE
HA-DOTATATE DOTATOC |
– | Lösung mit je 25 g Lysin und Arginin |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | Wirkung, Nebenwirkung sowie üblicherweise applizierte Dosierungen bitte den Arzneimittelinformationen für die zusätzlich applizierten Substanzen entnehmen |
| Typischerweise applizierte Menge | 250 µg | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bezug/Herstellung genutzter Radiopharmaka | ||||
|---|---|---|---|---|
| Bezeichnung | [177Lu]Lu-DOTATATE | [177Lu]Lu-HA-DOTATATE | [177Lu]Lu-DOTATOC | [90Y]Y-DOTATOC |
| Radiopharmakon kommerziell erhältlich (ja/nein) | Ja | Nein | Nein | Nein |
| Eigenherstellung mit welchen zugelassenen Komponenten | [177Lu]LuCl3 zur Radiomarkierung | [177Lu]LuCl3 zur Radiomarkierung | [177Lu]LuCl3 zur Radiomarkierung | [90Y]YCl3 zur Radiomarkierung |
| Existierende Monographien (Ph. Eur.) | 2 798: [177Lu]LuCl3 zur Radiomarkierung 0125 (Radioaktive Arzneimittel) |
2 798: [177Lu]LuCl3 zur Radiomarkierung 0125 (Radioaktive Arzneimittel) |
2 798: [177Lu]LuCl3 zur Radiomarkierung 0125 (Radioaktive Arzneimittel) |
2803: [90Y]YCl3 zur Radiomarkierung 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | DOTATATE | HA-DOTATATE | DOTATOC | DOTATOC |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | Lutetium-177/Yttrium-90 gegebenenfalls Lutetium-177m(herstellerabhängig) | [177Lu]Lu-DOTATATE
Lutetium-177m |
| Art der Strahlung (%α, %β, %γ) | Siehe Tabellen A-1.1 und A-1.6 | Siehe Tabellen A-1.1 und A-1.6 |
| Energiespektren (α, β, γ) | Siehe Tabellen A-1.1 und A-1.6 | Siehe Tabellen A-1.1 und A-1.6 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | Ca. 800 MBq Lutetium-177 (Rest in Flasche von Lieferung) | Typischerweise gering (< 5 %, ca. 370 MBq) |
| Entsorgung von Reststoffen und Abwasser | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung
Bei Resten von Lutetium-177m gegebenenfalls auch Entsorgung über Landessammelstelle |
Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung
Bei Resten von Lutetium-177m gegebenenfalls auch Entsorgung über Landessammelstelle |
| Applikation des Radiopharmakons | |
|---|---|
| Typischerweise applizierte Aktivität pro Therapiezyklus | 7 400 MBq Lutetium-177 (3 700 MBq Yttrium-90) pro Therapiezyklus |
| Art der Applikation | i. v. |
| Typische Anzahl an Applikationen/Therapiezyklen | 4 Zyklen |
| Typischer Zeitabstand zwischen Therapiezyklen | 8 bis 12 Wochen |
| Limitierende Faktoren für Wiederholung (z. B. Dosis-limitierendes Organ) | Blutbild (Knochenmark), Nierenfunktion (Niere) |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [177Lu]Lu-DOTATATE, [177Lu]Lu-HA-DOTATATE, [177Lu]Lu-DOTATOC, [90Y]Y-DOTATOC |
– |
| Wirkmechanismus des Radiopharmakons | Bindung an den Somatostatinrezeptor 2, gefolgt von Internalisation | – |
| Bioverteilung/Spezifische Anreicherung in | Tumoren des neuroendokrinen Systems | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Niere, Leber, Milz | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Übelkeit, Erbrechen, Hämatotoxizität, Müdigkeit | – |
| Seltene schwere Nebenwirkungen | – | |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientin bzw. Patient (typische Anzahl Zyklen: 4) | 370 mGy (aus Zulassungsstudie [177Lu]Lu-DOTATATE) |
| Typische effektive Dosis (Summe aller Zyklen für Patient) | 1480 mGy |
| Dosislimitierendes Organ | Knochenmark, selten Niere (beide potenziell dosislimitierend) |
| Angestrebte Dosis Zielregion | Unbekannt |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Szintigraphischer Targetnachweis erforderlich |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Posttherapeutische Verteilungsszintigraphie erforderlich, Zusätzliche Bildgebung zwischen den Therapiezyklen optional, Quantifizierung optional
Dosimetrie während 1. Zyklus für ca. 5 Tage (variable Protokolle) |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt durch Patientinnen und Patienten | |
|---|---|
| Radioaktive Ausscheidung durch Patientin/Patient | |
| Ausgeschiedene Nuklide | Lutetium-177/Yttrium-90 |
| Arten der Ausscheidung | Renal/Urin, gering gastrointestinal/Stuhl |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 bis 3 Tage |
| Umgang mit Ausscheidung stationär & poststationär | Abwasseranlage (Abklinganlage) (stationär)
Poststationär: Empfehlung an die Patienten zum Sammeln von Vorlagen oder ähnlichem für mehrere Tage; idealerweise Toilette nach Benutzung mehrfach spülen |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | Durch Patientinnen und Patienten fast 100 % γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch die Patientinnen und Patienten | γ (Bremsstrahlung) |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Metastasen (oft Leber) |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch die Patientinnen und Patienten | ca. 2 bis 3 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Stationär:
Therapiestation mit Abwasseranlage (Abklinganlage); poststationär: Toilettenhygiene, Abstand von gefährdeten Personen |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | Max. 0,37 mSv (für Lutetium-177) |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (4) | < 1 mSv (Hinweis: gegebenenfalls Anpassung des Entlasszeitpunktes in Abhängigkeit von der Anzahl der Zyklen pro Kalenderjahr) |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Ja, falls eine vorzeitige Entlassung unter Berücksichtigung des sozialen Umfelds notwendig ist; werden 4 Zyklen im Kalenderjahr angewendet, ist eine patientenindividuelle Berechnung der zu erwartenden Dosen für Personen im Haushalt auf Basis der jeweiligen Entlassdosisleistungen gegebenenfalls notwendig |
| Hospitalisierungskonzept | |
|---|---|
| Erforderlich | Ja |
| Typischerweise empfohlene Hospitalisierungsdauer | 2 bis 5 Tage |
| Mögliche Gründe für verlängerte Hospitalisierungsdauer | Dosimetrie, Nebenwirkungen (z. B. Durchfälle), häusliche Umstände, Komorbiditäten |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Dosimetrie, Strahlenschutz |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Nicht erlaubt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Nein |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Behandlung von nicht resezierbaren oder metastatischen, progressiven, gut differenzierten (G1 und G2) Somatostatinrezeptor-positiven gastroenteropankreatischen neuroendokrinen Tumoren (GEP-NETs) bei Erwachsenen |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | NET der Lunge, G3 NET, Meningeome, Paragangliome, G1/G2 NET CUP |
| Neue Indikationen im Rahmen von Studien/Forschung | Ja (laufende Studien zu Phäochromozytomen, kleinzelliges Bronchialkarzinom, Mammakarzinom) |
| Therapie bereits in Leitlinien eingegangen | Ja (z. B. Deutsche 2k Leitlinie NET, Leitlinien der ESMO, ENETS, NCCI) |
| Erstattung | |
|---|---|
| Stationär | DRG variabel nach Tumorlokalisation plus Zusatzentgelt |
| Ambulant | Entfällt |
| Probleme mit fehlender Erstattung | Keine generelle Regelung |
4 Radionuklidtherapie in der Behandlung von Knochenschmerzen und von Knochenmetastasen des metastasierten kastrationsresistenten Prostatakarzinoms (mCRPC) mit [153Sm]Sm-EDTMP) oder [223Ra]Radiumdichlorid
Für onkologische Patientinnen und Patienten mit Knochenmetastasen bedeutet der metastasenbedingte Knochenschmerz häufig eine erhebliche Beeinträchtigung der Lebensqualität. Systemisch werden Chemo-, Bisphosphonat- und Hormontherapie eingesetzt, zur lokalen Schmerzkontrolle kann auch eine lokale Strahlentherapie indiziert sein. Die palliative Schmerztherapie mit Radionukliden wird seit über 50 Jahren erfolgreich angewendet und wird in einer systematischen Literaturrecherche nach evidenzbasierten Kriterien positiv bewertet (Bauman et al. 2005). Von zahlreichen Radiopharmaka stehen derzeit kommerziell nur noch [153Sm]Samarium-ethylen-diamintetramethylen-phosphonat ([153Sm]Sm-EDTMP) und [223Ra]Radiumdichlorid zur Verfügung. Die Therapie mit [153Sm]Sm-EDTMP ist in Deutschland seit 1998 zugelassen.
Die Therapie mit dem Alphaemitter [223Ra]Radiumdichlorid (Alpharadin, Xofigo) beim kastrationsresistenten metastasierten Prostatakarzinom (Metastatic castration-resistant prostate cancer mCRPC) ist seit 2013 in Deutschland zugelassen.
4.1 Indikationen und Therapieziele
Die Radionuklidtherapie verfolgt zwei Ziele: 1) die systemische Schmerzbehandlung ([153Sm]Sm-EDTMP, [223Ra]Radiumdichlorid (Alpharadin, Xofigo)) und 2) die antitumoröse Therapie ([223Ra]Radiumdichlorid (Alpharadin, Xofigo)). Wichtigste Indikation sind für [153Sm]Sm-EDTMP therapierefraktäre Schmerzen bei Skelettmetastasen mit dokumentierter osteoblastischer Aktivität in der Skelettszintigraphie (bei Prostata-, Lungen- oder Mammakarzinom) und deutlich eingeschränkter Lebensqualität (Fischer 1999, Handkiewicz-Junak et al. 2018).
4.2 Durchführung
4.2.1 Vorbereitung und Therapieplanung
Für die Therapie mit [153Sm]Sm-EDTMP und [223Ra]Radiumdichlorid ist jeweils zur Therapieplanung ein aktueller Nachweis ossärer Metastasen (Skelettszintigramm) Voraussetzung. Eine laufende Bisphosphonattherapie muss nicht ausgesetzt werden, sofern unter der Behandlung Mehrspeicherungen in der Skelettszintigraphie nachweisbar sind. Vorausgesetzt werden eine ausreichende Knochenmark-, Nieren- und Leberfunktion sowie eine Lebenserwartung von mindestens drei Monaten sowie ein Karnofsky-Index von > 40 %. Eine Großflächenbestrahlung sollte mindestens zwei bis drei Monate zurückliegen.
4.2.2 Allgemeiner Therapieablauf
Die Injektion einer Standardaktivitätsmenge von 37 MBq kg-1 Körpergewicht [153Sm]Sm-EDTMP erfolgt streng intravenös; die Therapie kann ambulant durchgeführt werden. Anschließend wird eine Verteilungsszintigraphie zur Dokumentation einer regelrechten Aktivitätsverteilung durchgeführt. Eine Zweittherapie kann bei fehlendem Therapieerfolg frühestens nach sechs Wochen durchgeführt werden, die Ansprechrate liegt dann immer noch bei 50 % (Fischer 1999).
Die Therapie mit [223Ra]Radiumdichlorid wird ebenfalls intravenös in sechs Einzelgaben alle vier Wochen in einer Dosierung von 55 kBq kg-1 Körpergewicht Radium-223 verabreicht. Aufgrund möglicher Hämatotoxizität (besonders Thrombozytopenie) sind vor jeder Gabe Kontrollen des Differentialblutbildes indiziert. Die Therapie kann ambulant erfolgen, es sind keine posttherapeutischen Verteilungsszintigramme vorgesehen (Pandit-Taskar et al. 2014, Poppel et al. 2016).
Um Komplikationen durch Knochenmetastasen vorzubeugen, empfiehlt die S3-Leitlinie zum Prostatakarzinom zusätzlich zur Therapie des mCRPC die Gabe des RANKL-Antikörpers (Receptor activator of nuclear factor-kappaB ligand) Denosumab oder des Bisphosphonats Zoledronsäure (Konig et al. 2020). Beide Wirkstoffe hemmen die Osteoklastenaktivität und reduzieren auch in osteoblastischen Knochenmetastasen pathologisch erhöhte Knochenresorption sowie die Ausschüttung tumorbegünstigender Wachstumsfaktoren durch die Osteoklasten.
4.2.3 Kontraindikationen und Nebenwirkungen
Kontraindikation für die palliative Schmerztherapie sind eine drohende oder bestehende Rückenmarkkompression bei Wirbelkörpermetastasen oder instabile Frakturen. Wie oben ausgeführt, ist die Therapie mit [223Ra]Radiumdichlorid insbesondere kontraindiziert in Kombination mit Abirateronacetat plus Prednison/Prednisolon, und die Therapie wird nicht empfohlen bei Patientinnen und Patienten mit einer geringen Anzahl osteoblastischer Knochenmetastasen (n < 6) oder bei Patientinnen und Patienten mit nur asymptomatischen Knochenmetastasen sowie in Kombination mit anderen systemischen Krebstherapien außer LHRH-Analoga. Als häufigere Nebenwirkungen für beide Therapieformen sind eine Reduktion der Leuko- und Thrombozyten zu nennen sowie Übelkeit, Durchfall und Erbrechen und vermehrtes Auftreten von Knochenbrüchen ([223Ra]Radiumdichlorid) und eine kurzzeitige, initiale Zunahme der Schmerzsymptomatik ([153Sm]Sm-EDTMP).
Tabelle 4.1: Radionuklidtherapie mit Samarium-153
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | EDTMP | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | – |
| Typischerweise applizierte Menge | 15,4 µg GBq-1 bis 35,7 µg GBq-1 | – | – |
| Bezug/Herstellung von Quadramet | |
|---|---|
| Bezeichnung | Quadramet (153Sm) |
| Radiopharmakon kommerziell erhältlich | Ja |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | Verunreinigung mit langlebigen Europiumnukliden möglich z. B. 154Eu (HWZ: 8,6 a) (Loebe et al. 2014), siehe hierzu Tabelle A-1.3 |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.3 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.3 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | – | 10 MBq bis 200 MBq in Vial, keine Messergebnisse von Präparations- oder Applikationszubehör vorliegend |
| Entsorgung von Reststoffen und Abwasser | – | Uneingeschränkte Freigabe nicht möglich
Ablieferung an Landessammelstelle |
| Applikation des Radiopharmakons | |
|---|---|
| Typischerweise applizierte Aktivität pro Therapiezyklus | 37 MBq kg-1 |
| Art der Applikation | i. v. |
| Typische Anzahl an Applikationen/Therapiezyklen | Einmal-Applikation |
| Typischer Zeitabstand zwischen Therapiezyklen | > 4 bis 6 Monate |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Knochenmarkfunktion |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [153Sm]Sm-EDTMP | Entfällt |
| Wirkmechanismus des Radiopharmakons | Affinität zu Bereichen mit aktivem Knochenumsatz infolge Phosphonat-Verbindung | – |
| Bioverteilung/Spezifische Anreicherung in | Wachstumszonen der Knochenmatrix | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Nicht bekannt | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Überschießende Schmerzreaktion früh nach Injektion (≤ zwei Tage), Absinken der Thrombozyten und Leukozyten. | – |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | 800 mSv |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | 800 mSv |
| Dosislimitierendes Organ | Gesunde Knochenoberfläche, rotes Knochenmark, Harnblasenwand, Nieren |
| Angestrebte Dosis Zielregion | – |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Metastasennachweis mit Skelettszintigramm, Bestimmung der applizierten Aktivität aus Körpergewicht, keine vorherige Dosisbestimmung |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Verteilungsszintigrafie erforderlich, keine Dosisbestimmung erforderlich |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt durch Patientinnen und Patienten | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | 153Sm |
| Arten der Ausscheidung | Renal/Urin (ca. 35 % der appl. Aktivität) |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 4 h bis 6 h |
| Umgang mit Ausscheidung stationär & poststationär | Ambulante Therapie, bei stationärer Aufnahme auffangen in Abwasseranlage (Abklinganlage) |
| Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | γ |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Knochen, Verteilung abhängig von Metastasierung |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | – |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Hygiene aufgrund Urinausscheidung in ersten 6 h bis 12 h, darüber hinaus Abstand halten empfohlen (mind. 1 m) |
| Dosis für die Umgebung des Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | < 0,8 mSv |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 0,8 mSv |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Nein |
| Typischerweise empfohlene Hospitalisierungsdauer | Nicht erforderlich |
| Mögliche Gründe für verlängerte Hospitalisierungsdauer | Entfällt |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Entfällt |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Entfällt |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Palliative Schmerztherapie bei osteoblastischen Skelettmetastasen |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Metastasierung beim Osteosarkom, Knochenmarksablation vor Stammzellentherapie |
| Neue Indikationen im Rahmen von Studien/Forschung | – |
| Therapie bereits in Leitlinien eingegangen | 025-005l_S1_Osteosarkome_2011043-
022OLl_S3_Prostatakarzinom_2019-06 032-054OLl_S3_Supportiv_2019-11 032-045OLl_S3_Mammakarzinom_2020-02 |
| Erstattung | |
|---|---|
| Stationär | 8 530x (Therapie mit Radionukliden, sonstige) |
| Ambulant | EBM 17372, 40562 |
| Probleme mit fehlender Erstattung | Posttherapeutische Bildgebung inkludiert, Abfallbeseitigung ebenfalls nicht gesondert erstattet |
Tabelle 4.2: Radionuklidtherapie mit Radium-223
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | Entfällt | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | – |
| Typischerweise applizierte Menge | – | – | |
| Bezug/Herstellung von Xofigo | |
|---|---|
| Bezeichnung | [223Ra]Radiumchlorid (Xofigo) |
| Radiopharmakon kommerziell erhältlich | Ja |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | Verunreinigung mit langlebigem 227Ac (HWZ: 21,8 a) und 227Th (HWZ: 18,7 Tage) möglich |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.9 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.9 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | – | 2 MBq in Vial4 |
| Entsorgung von Reststoffen und Abwasser | – | Uneingeschränkte Freigabe nicht möglich, Ablieferung an Landessammelstelle |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | 55 kBq kg-1 |
| Art der Applikation | i. v. |
| Typische Anzahl an Applikationen/Therapiezyklen | 6 |
| Typischer Zeitabstand zwischen Therapiezyklen | 4 Wochen |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Myelosuppression |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [223Ra]Radiumchlorid | – |
| Wirkmechanismus des Radiopharmakons | Affinität zu Bereichen mit aktivem Knochenumsatz infolge des ähnlichen chemischen Verhaltens von Calcium und Radium | – |
| Bioverteilung/Spezifische Anreicherung in (wo reichert es sich speziell an) | Knochenmetastasen | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Darmtrakt | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Diarrhö, Übelkeit, Erbrechen, Thrombozytopenie und Knochenfrakturen | – |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Dosis) | 30 mGy MBq-1 · 4 MBq = 120 mGy (Chittenden et al. 2015) |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | 120 mGy · 6 Zyklen = 720 mGy |
| Dosislimitierendes Organ | – |
| Angestrebte Dosis Zielregion | Keine fixe Zieldosis vorgegeben |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Skelettszintigramm mit Nachweis ossärer Metastasen |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | – |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientin/Patient | |
| Ausgeschiedene Nuklide | 223Ra
219Rn |
| Arten der Ausscheidung | Gastrointestinal/Stuhl, Pulmonal/Atemluft (219Rn) |
| Strahlenschutz relevantester Ausscheidungsweg | Gastrointestinal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 24 h |
| Umgang mit Ausscheidung stationär & poststationär | – |
| Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | – |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | – |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Knochen, Verteilung abhängig von Metastasierung |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | Keine |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Keine |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | < 80 µSv |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 0,5 mSv |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Nein |
| Typischerweise empfohlene Hospitalisierungsdauer | Nicht erforderlich |
| Mögliche Gründe für verlängerte Hospitalisierungs-dauer | Entfällt |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Entfällt |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Entfällt |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Ossär metastasiertes, kastrationsresistentes Prostatakarzinom (mCRPC) mit symptomatischen Knochenmetastasen ohne bekannte viszerale Metastasen |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Ossäre MET anderer Tumorentitäten |
| Neue Indikationen im Rahmen von Studien/Forschung | – |
| Therapie bereits in Leitlinien eingegangen | S3-LL PCA:
AWMF-Registernummer: 043/022OL |
| Erstattung | |
|---|---|
| Stationär | – |
| Ambulant | EBM 17372, 40582 |
| Probleme mit fehlender Erstattung | – |
5 Radionuklidtherapie von Synovialitis (Radiosynoviorthese) mit [169Er]Erbiumcitrat, [186Re]Rheniumsulfid und [90Y]Yttriumcitrat
Synoviorthese ist hergeleitet von den griechischen Wörtern „Synovialis“ (Schleimhaut) und „Orthese“ (Wiederherstellung). Mit Radiosynoviorthese (RSO) ist eine Wiederherstellung der Gelenkinnenhaut und damit ihrer Funktion durch lokale Strahlenwirkung nach intraartikulärer Radionuklidapplikation gemeint (Beil und Ruther 2015, Linke et al. 2011, Seidel und Kommission Pharmakotherapie der DGRh 2006). Sie ist eine lokale und minimal invasive Alternative zu chirurgischen Maßnahmen oder intraartikulärer Applikation chemischer Substanzen. Gerade für ältere Patientinnen und Patienten, bei denen ein chirurgischer Eingriff häufiger mit höheren Komplikationsraten (bezüglich der Operation selbst und der Narkoserisiken) einhergeht, ist die RSO eine geeignete Option zur Schmerzlinderung.
Obwohl es sich eigentlich um eine gutartige Erkrankung handelt, kann sich die Synovialitis bei verschiedenen rheumatischen Erkrankungen aggressiv und lokal destruierend verhalten, so dass die Behandlungskonzepte durchaus mit einer Tumortherapie vergleichbar sind. Seit über 50 Jahren wird die Radiosynoviorthese als adjuvante, lokal entzündungshemmende und schmerzlindernde Maßnahme eingesetzt (Deutsch et al. 1993). Nach intraartikulärer Injektion eines geeigneten Betastrahlers wird dieser in die hyperplastische Synovia phagozytiert und von dort aus die entzündlich veränderte Synovialis bestrahlt und die oberflächlichen, hypertrophierten Synovialisschichten zerstört. Aufgrund der geringen Eindringtiefe der Betastrahlung wird dagegen das Knorpelgewebe oder der Knochen weitgehend geschont.
5.1 Indikationen und Therapieziele
Die RSO wird in der Regel bei der rheumatoiden Arthritis (RA) und seronegativen Spondylarthritiden eingesetzt. Die primäre Indikation ist die Behandlung der chronischen (multifokalen) Synovialishyperplasie, die unter einer systemischen Therapie zwar eine Regression aufweist, bei der aber ein oder wenige Gelenke nicht ausreichend auf die Behandlung ansprechen, oder aber die lokale Therapie von Monarthritiden, mit oder ohne vorherige systemische Therapie (Beil und Ruther 2015, Gabriel et al. 2021, Linke et al. 2011, Seidel und Kommission Pharmakotherapie der DGRh 2006). Insofern ist die Indikationsstellung zur RSO interdisziplinär mit den behandelnden Rheumatologinnen und Rheumatologen bzw. Orthopädinnen und Orthopäden zu stellen. Bei der pigmentierten villonodulären Synovialitis wird die RSO adjuvant nach Synovialektomie eingesetzt und bei der Hämophilie mit Arthropathie zur Blutungsprophylaxe. Bei der aktivierten Arthrose, bei Kristallarthropathie oder nach prothetischem Gelenkersatz werden ebenfalls gute Erfolge erzielt. Therapieziele der RSO sind die Schmerzreduktion und Funktionsverbesserung der betroffenen Gelenke (Reduktion der Ergussbildung und Zunahme der Beweglichkeit). Auch wenn die RSO keinen Einfluss z. B. auf eine Arthrose hat, kann sie die Begleitentzündung wesentlich verbessern und dadurch das therapeutische Management bereichern.
5.2 Durchführung
Die Synovialitis lässt sich durch die Skelettszintigraphie in Mehrphasen-Technik mit Darstellung der Entzündung in der „Weichteilszintigraphie“ (Frühphase) und Nachweis des knöchernen Umbaus in der „Mineralisationsphase“ (Spätphase) mit Technetium-99m-markierten Phosphonaten nachweisen. Vor der RSO des Kniegelenks soll eine synoviale Poplitealzyste, sogenannte Bakerzyste, ausgeschlossen werden. Für die Indikationsstellung sind sowohl die Beschwerden der Patientinnen und Patienten als auch die Szintigraphie zu berücksichtigen.
Nach Indikationsstellung, Aufklärung und Einwilligung erfolgt die Einbringung eines mit einem geeigneten Betastrahler markierten Kolloids nach Röntgenkontrolle der intraartikulären Lage der Nadel (gegebenenfalls nach Kontrastmittelapplikation bei den mittleren und großen Gelenken) und anschließender Gabe von Kortison für eine schnelle Reduktion der Entzündung und Vermeidung eines Rückstroms der Radioaktivität in den Stichkanal. Die Betaenergie wird der Größe der Gelenke angepasst: für Finger- und Fußgelenke wird [169Er]Erbiumcitrat verwendet, für die mittelgroßen Gelenke kommt [186Re]Rheniumsulfid zum Einsatz, und für das Kniegelenk steht [90Y]Yttriumcitrat zur Verfügung. Die applizierte Aktivität des Radiopharmakons orientiert sich am Volumen des Gelenkes und der Dicke der Synovia, eine exakte Dosimetrie ist nicht möglich. Eine posttherapeutische Verteilungsszintigraphie ist bei Rhenium-186 und Yttrium-90 durch Gamma- bzw. Bremsstrahlung vorgesehen. Eine Immobilisation über 48 Stunden soll einen vermehrten Lymphabstrom verhindern – bei Immobilisation des Kniegelenkes erfolgt eine Thromboseprophylaxe z. B. mit niedermolekularem Heparin. Die Therapie wird pro Applikation auf eine Extremität begrenzt, um die Immobilisation durchsetzen zu können. Der Wirkungseintritt kann etwa nach drei bis vier Monaten endgültig abgeschätzt werden, bei nur kurzzeitiger Besserung ist dann auch eine Wiederholung der RSO möglich. Auch nach langjähriger Besserung und erneutem Rezidiv ist ebenso eine Wiederholung mit hohen Erfolgsaussichten möglich (Kresnik et al. 2002). Die RSO ist ambulant durchführbar.
5.2.1 Nebenwirkungen und Kontraindikationen
Insgesamt ist bei der RSO nur selten mit Komplikationen oder Nebenwirkungen zu rechnen. An Nebenwirkungen kann eine posttherapeutische Entzündung auftreten. Bei zu fester Bandagierung oder zunehmender Schwellung der Extremität können im Tagesverlauf Druckstellen auftreten. Bei nicht streng intraartikulärer Injektion kann sich in seltenen Fällen ein Strahlenulkus entwickeln. Ein Gelenkinfekt ist bei strenger Einhaltung der hygienischen Maßnahmen eher ein theoretisches Risiko. Dem Thromboserisiko wird bei Ruhigstellung der unteren Extremität regelhaft mit einer Antikoagulation begegnet. Es bestehen relativ wenig Kontraindikationen für die Durchführung einer RSO. Zu den absoluten Kontraindikationen zählen Schwangerschaft und Laktation, massiver Hämarthros oder akutes Trauma, lokale Infektionen und rupturierte Baker-Zyste oder Rotatorenmanschettendefekte. Relative Kontraindikationen bestehen für Gelenkinstabilität mit Knochendestruktion, und eine besonders sorgfältige Indikationsstellung ist im jüngeren Alter angebracht.
Tabelle 5.1: Radionuklidtherapie mit Erbium-169
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | Kolloidales Erbiumcitrat | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | – |
| Bekannte Nebenwirkungen unmarkierter Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | – |
| Typischerweise applizierte Menge | – | – | – |
| Bezug/Herstellung von [169Er]Erbiumcitrat | |
|---|---|
| Bezeichnung | [169Er]Erbiumcitrat |
| Radiopharmakon kommerziell erhältlich | Ja |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | Entfällt |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | 169Yb (HWZ 32 Tage), Anteil max. 1,4 % |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.5, A-1.9 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.5, A-1.9 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | – | Wenige MBq, leere Spritze, Tupfer |
| Entsorgung von Reststoffen und Abwasser | – | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | 15 MBq bis 40 MBq, je nach Gelenkgröße |
| Art der Applikation | Intraartikulär |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 |
| Typischer Zeitabstand zwischen Therapiezyklen | 6 Monate |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Keine |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [169Er]Erbiumcitrat | – |
| Wirkmechanismus des Radiopharmakons | Phagozytose des Pharmakons in oberflächlichen Synovialzellen | – |
| Bioverteilung/Spezifische Anreicherung in (wo reichert es sich speziell an) | Synovialzellen | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | – | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Nein | – |
| Seltene schwere Nebenwirkungen | Nein | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | 0,0082 mSv/MBq/% Abstrom |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | – |
| Dosislimitierendes Organ | – |
| Angestrebte Dosis Zielregion | – |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | – |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Keine Dosimetrie |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | – |
| Arten der Ausscheidung | – |
| Strahlenschutzrelevantester Ausscheidungsweg | – |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | – |
| Umgang mit Ausscheidung stationär & poststationär | – |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | – |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | – |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Therapiertes Gelenk |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | – |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | – |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | – |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Nein, außer wenn medizinisch begründet |
| Typischerweise empfohlene Hospitalisierungsdauer | – |
| Mögliche Gründe für verlängerte Hospitalisierungsdauer | – |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | – |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | – |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | – |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Aseptische Arthritis, aktivierte Arthrose, Synovialitis |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Entfällt |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | Ja („Leitlinie für die Radiosynoviorthese“) |
| Erstattung | |
|---|---|
| Stationär | Abrechnungsziffer: 8-503.3 |
| Ambulant | EBM |
| Probleme mit fehlender Erstattung | – |
Tabelle 5.2: Radionuklidtherapie mit Rhenium-186
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | Kolloidales Rheniumsulfid | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Entfällt | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Entfällt | – | – |
| Typischerweise applizierte Menge | Entfällt | – | – |
| Bezug/Herstellung von [186Re]Rheniumsulfid | |
|---|---|
| Bezeichnung | [186Re]Rheniumsulfid |
| Radiopharmakon kommerziell erhältlich | Ja |
| Eigenherstellung mit welchen zugelassenen Komponenten | Entfällt |
| Existierende Monographien (Ph. Eur.) | 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | Entfällt |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | A: 186Re
B: 184Re Anteil < 1 % C: 188Re Anteil < 1 % |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.7 und A-1.8 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.7 und A-1.8 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | – | Wenige MBq, leere Spritze, Tupfer |
| Entsorgung von Reststoffen und Abwasser | – | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung |
| Applikation des Radiopharmakons | |
|---|---|
| Typischerweise applizierte Aktivität pro Therapiezyklus | 37 MBq bis 185 MBq, je nach Gelenkgröße |
| Art der Applikation | intraartikulär |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 |
| Typischer Zeitabstand zwischen Therapiezyklen | 6 Monate |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Entfällt |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [186Re]Rheniumsulfid | – |
| Wirkmechanismus des Radiopharmakons | Phagozytose des Pharmakons in oberflächlichen Synovialzellen | – |
| Bioverteilung/Spezifische Anreicherung in | Synovialzellen | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | – | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Entfällt | – |
| Seltene schwere Nebenwirkungen | Entfällt | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | 0,0102 mSv/MBq/%Abstrom |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | – |
| Dosislimitierendes Organ | – |
| Angestrebte Dosis Zielregion | – |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | – |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Verteilungsszintigrafie |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | – |
| Arten der Ausscheidung | – |
| Strahlenschutzrelevantester Ausscheidungsweg | – |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | – |
| Umgang mit Ausscheidung stationär & poststationär | – |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch die Patientin/den Patienten | – |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Therapiertes Gelenk |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | – |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | – |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | – |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Nein |
| Typischerweise empfohlene Hospitalisierungsdauer | – |
| Mögliche Gründe für verlängerte Hospitalisierungs-dauer | – |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | – |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | – |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | – |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Aseptische Arthritis,
aktivierte Arthrose, Synovialitis |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Entfällt |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | Ja („Leitlinie für die Radiosynoviorthese“) |
| Erstattung | |
|---|---|
| Stationär | Abrechnungsziffer: 8-503.3 |
| Ambulant | EBM |
| Probleme mit fehlender Erstattung | – |
Tabelle 5.3: Radionuklidtherapie mit Yttrium-90
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | Kolloidales Yttriumcitrat | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | – | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
– | – | – |
| Typischerweise applizierte Menge | – | – | – |
| Bezug/Herstellung von [90Y]Yttriumcitrat | |
|---|---|
| Bezeichnung | [90Y]Yttriumcitrat |
| Radiopharmakon kommerziell erhältlich | Ja |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | 0125 (Radioaktive Arzneimittel) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | 90Y |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.1 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.1 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | – | Wenige MBq, leere Spritze, Tupfer |
| Entsorgung von Reststoffen und Abwasser | – | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | 185 MBq bis 222 MBq |
| Art der Applikation | intraartikulär |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 |
| Typischer Zeitabstand zwischen Therapiezyklen | 6 Monate |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | keine bekannt |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [90Y]Yttriumcitrat | – |
| Wirkmechanismus des Radiopharmakons | Phagozytose des Pharmakons in oberflächlichen Synovialzellen | – |
| Bioverteilung/Spezifische Anreicherung in | Synovialzellen | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | – | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | – | – |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | 0,038 mSv MBq-1
8,44 mSv bei 222 MBq und niedrigem Abtransport |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | – |
| Dosislimitierendes Organ | – |
| Angestrebte Dosis Zielregion | – |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | – |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Verteilungsszintigrafie zur Applikationskontrolle
Keine Dosimetrie |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | – |
| Arten der Ausscheidung | – |
| Strahlenschutzrelevantester Ausscheidungsweg | – |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | – |
| Umgang mit Ausscheidung stationär & poststationär | – |
| Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch die Patientin/den Patienten | – |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Therapiertes Gelenk |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | – |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | – |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | – |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Nein |
| Typischerweise empfohlene Hospitalisierungsdauer | – |
| Mögliche Gründe für verlängerte Hospitalisierungsdauer | – |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | – |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | – |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | – |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Aseptische Arthritis,
aktivierte Arthrose, Synovialitis |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Entfällt |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | Ja („Leitlinie für die Radiosynoviorthese“) |
| Erstattung | |
|---|---|
| Stationär | Abrechnungsziffer: 8-503.3 |
| Ambulant | EBM |
| Probleme mit fehlender Erstattung | – |
6 Selektive Interne Radiotherapie (SIRT) von Lebertumoren mit Yttrium-90 und Holmium-166
Die Selektive Interne Radiotherapie (SIRT), auch transarterielle Radioembolisation (TARE) genannt, ist eine etablierte Therapie zur Behandlung von bösartigen Tumoren in der Leber. Dabei werden als Medizinprodukt zugelassene, sehr kleine gewebeverträgliche Harz-, Glaskügelchen oder Poly-L-Milchsäure direkt in die Leberarterien appliziert, die aufgrund ihres Durchmessers in Tumorgefäßen stecken bleiben (Embolisation) und dort lokal über die Strahlung (nicht pharmakologisch) ihre Wirkung entfalten. Die therapeutische Rationale der intraarteriellen Applikation beruht auf dem Sachverhalt, dass gesundes Lebergewebe überwiegend venös (Pfortader, Vena portae) versorgt wird, während Lebertumoren vor allem über die Leberarterie (Arteria hepatica) perfundiert werden.
Aktuell sind zwei kommerzielle Yttrium-90-markierte Produkte mit unterschiedlichen Mikrosphären (SIR-Spheres®, Mikroharz; Thera-SphereTM, Glas) zur Behandlung primärer oder sekundärer maligner Tumoren CE-zertifiziert. Eine weitere mit Holmium-166-markierte Behandlungsoption (Quirem-SpheresTM, ebenfalls CE-zertifiziert) ist ebenfalls verfügbar. Eine zunehmend wichtigere Rolle nimmt die Dosimetrie in der SIRT ein. Der aktuelle Stand der klinischen Erfahrungen ist dabei in die Tabellen eingearbeitet, wobei hier kontinuierlich neue Daten publiziert werden. Hinsichtlich der aktuell inkludierten Dosimetrie-Kennzahlen verweisen wir auf die Arbeiten von Salem et al. und Konijnenberg et al. sowie der aktuellen EANM Guideline (Konijnenberg et al. 2021, Salem et al. 2019, Weber et al. 2022).
6.1 Indikationen und Therapieziele
Zu den Indikationen der SIRT gehören primäre Lebertumore wie das hepatozelluläre Karzinom und intrahepatische Gallengangskarzinome und Lebermetastasen von extrahepatischen Primärtumoren wie dem kolorektalen Karzinom, Mammakarzinom und neuroendokrinen Tumoren. Bei der Mehrheit der Patientinnen und Patienten ist das primäre Ziel die Verlängerung des Überlebens ohne kurativen Ansatz. Allerdings zeigte eine aktuelle prospektive Phase-III-Studie bei Patientinnen und Patienten mit kolorektalem Karzinom und Lebermetastasen, dass die zusätzliche SIRT bei Zweitlinien-Chemotherapie zu einer signifikanten Verlängerung des progressionsfreien Überlebens (PFS) und hepatischen PFS führte (Mulcahy et al. 2021). Damit handelt es sich um die erste prospektive randomisierte Phase-III-Studie mit SIRT, wo der primäre Endpunkt erreicht und eine PFS-Verlängerung erzielt wurde. Außerdem kann die SIRT auch vereinzelt in kurativer Intention zum sogenannten Bridging auf dem Weg zur Transplantation, d. h. zur vorübergehenden lokalen Stabilisierung, zum Einsatz kommen.
6.2 Durchführung
6.2.1 Vorbereitung und Therapieplanung
Im Vorfeld sollte die Indikation zur SIRT in einer multidisziplinären Tumorkonferenz unter Berücksichtigung der Leitlinien und Alternativtherapien gestellt werden. Außerdem ist sicherzustellen, dass die Tumorlast auf die Leber beschränkt oder die Lebertumorlast prognoseführend bei den Patientinnen und Patienten ist, da die Behandlung aufgrund des Wirkprinzips nur innerhalb der Leber therapeutische Wirkungen erzielen kann.
Damit die SIRT nebenwirkungsarm durchgeführt werden kann, müssen die Mikrosphären nach der Verabreichung sicher in der Leber verbleiben und nicht mit dem Blut über Kurzschlussverbindungen („Shunts“) in die Lunge oder über kleine Seitengefäße in andere Organe (wie Magen, Gallenblase, Duodenum, Pankreas) abfließen. Da zum Teil auch die normale Leber bestrahlt wird, muss eine weitgehend erhaltene Leberfunktion vorliegen (z. B. Bilirubin im Normbereich oder allenfalls leicht erhöht, Leberenzyme nur leicht erhöht etc.). Eine Pfortaderthrombose stellt keine Kontraindikation dar.
Zur Voraussetzung der technischen Durchführbarkeit gehört, dass die Leberarterien mit einem Katheter zugänglich und sondierbar sind, keine wesentliche Anomalie der Gefäßversorgung vorliegt, Äste, die andere Organe versorgen, vor Therapie ohne Risiko verschlossen werden.
6.2.2 Allgemeiner Therapie-Ablauf
Nach Indikationsstellung beginnt die in der Regel zwei stationäre Aufenthalte umfassende Therapiedurchführung. Bei dem ersten Aufenthalt werden die Lebergefäße dargestellt, und es erfolgt die Gabe eines nuklearmedizinischen Tracers, um einen möglichen Mikrosphärenabfluss darzustellen. Entsprechende kleine Gefäßäste werden verschlossen, und es erfolgt die Quantifizierung relevanter Shunts. Im Nachgang zur ersten Intervention wird erneut überprüft, ob die SIRT technisch durchführbar ist und die entsprechende Therapieaktivität wird berechnet. Beim zweiten Aufenthalt erfolgt nach abermaliger Gefäßdarstellung die Verabreichung der Therapiesubstanz. Nach beiden Interventionen soll die Patientin/der Patient im Anschluss ca. fünf bis sechs Stunden Bettruhe einhalten, um eventuellen Nachblutungen aus der Leiste vorzubeugen. Im weiteren Verlauf erfolgt eine Ganz- und Teilkörperbildgebung zur Therapiedokumentation.
Vor der eigentlichen Therapie erhält die Patientin/der Patientin eine Prämedikation, bestehend aus einem Glukokortikoid (meist Fortecortin) sowie einem Magenschutz. Des Weiteren ist auf eine ausreichende Hydrierung zu achten. Optional werden bei Bedarf Schmerzmittel und Medikamente gegen Übelkeit/Erbrechen verabreicht. Zusätzlich findet eine Infektionsprophylaxe mit Antibiotika statt.
In Deutschland erfolgt nach der Therapie ein stationärer Aufenthalt. Gemäß Empfehlung der SSK 2009 (SSK 2009) ist aufgrund möglicher Kontaminationen und möglicher aktiver Ausscheidungen (Drescher et al. 2020) eine Unterbringung von mindestens 48 Stunden auf einer nuklearmedizinischen Therapiestation empfohlen. Sofern z. B. aus medizinischen Gründen eine Verlegung/Unterbringung auf einer anderen Station erfolgt, müssen in den ersten 48 Stunden Strahlenschutzbeauftragte einer nuklearmedizinischen Fachabteilung in die Betreuung der Patientinnen und Patienten und die Gewährleistung des Strahlenschutzes involviert bleiben. Dies betrifft Ausscheidungen und Materialien (z. B. Verbände), die potenziell mit Körperflüssigkeiten in Kontakt waren, die auf Kontaminationsfreiheit gemessen und gegebenenfalls als radioaktive Abfälle entsorgt werden müssen (SSK 2009). Weiterhin müssen Patientinnen und Patienten hinsichtlich medizinischer Komplikationen (Gefäßzugang, Schmerzen, Fehlapplikationen) überwacht werden. Eine Verteilungsszintigraphie zur Dokumentation der korrekten Applikation ist ebenfalls erforderlich. Zum Zeitpunkt der Entlassung muss sichergestellt sein, dass die von den Patientinnen und Patienten ausgehende ionisierende Strahlung für Angehörige und Dritte nicht mehr als 1 mSv effektive Dosis verursacht (§ 80 Absatz 1 StrlSchG (StrlSchG 2017) § 122 Absatz 4 StrlSchV (StrlSchV 2018)). Dies wird realisiert, indem die zum Entlasszeitpunkt in 2 m Abstand zur Patientenoberfläche gemessene Dosisleistung eine Schwelle unterschreitet, die bei Anwendung des Dosisintegrals einen Wert kleiner 1 mSv gewährleistet (SSK 1996). Eine ambulante Durchführung der Therapie ist aufgrund der o. g. Einschränkungen nicht praktikabel.
6.2.3 Nebenwirkungen und Kontraindikationen
Insgesamt wird die Therapie bei entsprechender Vorbereitung gut vertragen. Zu den häufigsten Nebenwirkungen gehören kurzzeitige Oberbauchschmerzen (unter Umständen bereits während der Behandlung), Übelkeit und Fieber. Entsprechende Symptome sind in der Regel nach ein bis zwei Tagen abgeklungen. Sehr seltene, schwerwiegendere Nebenwirkungen können auftreten, wenn trotz adäquater Vorbereitung Mikrosphären in gesunde Organe (z. B. den Magen, die Bauchspeicheldrüse, die Lunge) gelangen. Das Abfließen von Mikrosphären in gesundes Lebergewebe kann zu einer temporären oder bleibenden Verschlechterung der Leberfunktion (Strahlenhepatitis) führen. Die Frequenz dieser Nebenwirkung kann durch zweizeitige Therapie und Cortisongabe, sofern keine Kontraindikationen vorliegen, deutlich verringert werden.
Tabelle 6.1: Radionuklidtherapie SIRT mit Yttrium-90
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | Kunstharz- und Glasmikrosphären | – | Protonenpumpenhemmer (z. B. Pantoprazol)
Antiemetika (z. B. Ondansetron, Granisetron) Steroide (z. B. 20 mg Dexemethason i. v., dann 10 mg Prednison/d oral) Gegebenenfalls Retard-Opioid |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Typischerweise applizierte Menge | Glasmikrosphären:
1,2 Mio. bis 8 Mio. Mikrosphären pro Vial in 0,6 ml Wasser (22 000-73 000 pro mg) Kunstharzmikrosphären: 40 Mio. bis 80 Mio. Mikrosphären pro Vial in 5 ml Wasser |
– | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bezug/Herstellung genutzter Radiopharmaka | |
|---|---|
| Bezeichnung | 90Y-Therasphere
90Y-SIR sphere |
| Radiopharmakon/Medizinprodukt kommerziell erhältlich | Ja (Medizinprodukt) |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | Keine, da Medizinprodukt |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | Entfällt | 90Y-Therasphere (Freudenberg et al. 2022, Metyko et al. 2012): 91Y, 88Y, 51Cr 90Y-SIR sphere keine |
| Art der Strahlung (%α, %β, %γ) | Entfällt | Siehe Tabelle A-1.1 |
| Energiespektren (α, β, γ) | Entfällt | Siehe Tabelle A-1.1 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | Entfällt | Typischerweise gering (< 5 %), größere Restmengen bei klinisch bedingter Teilentnahme |
| Entsorgung von Reststoffen und Abwasser | Entfällt | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung.
Kritisch ist die Verunreinigung mit 88Y. Diese liegt zum Kalibrierzeitpunkt ca. 3 Größenordnungen über dem Grenzwert der uneingeschränkten Freigabe bei einer Abfallmasse von 1 kg. Bei nahezu vollständiger Applikation der gelieferten Aktivität unterschreitet die Aktivität im Abfall nach etwa 1 Jahr Abklingzeit den Grenzwert. Für unverbrauchte Präparate |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte pro Therapiezyklus | 90Y-Therasphere:
3 GBq bis 20 GBq, Berechnung nach Formel oder gemäß Dosimetrie ATherapie=DPTV*mPTV/(50x(1-ShuntLunge)). 90Y-SIR sphere: Berechnung nach Formel oder gemäß Dosimetrie ATherapie=(KOF-0,2)+ mTumor/(mLeber+mTumor). Dosisreduktion bei Lungenshunt ≥ 10 % und < 15 % um 20 %, und bei Lungenshunt ≥ 15 % und < 20 % um 40 % (Weber et al. 2022) |
| Art der Applikation | i. a. via Katheter |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 bis 2 |
| Typischer Zeitabstand zwischen Therapiezyklen | 4 bis 6 Wochen |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Lungenshunt, technische Durchführbarkeit, REILD (Radioembolization Induced Liver Disease), extrahepatischer Abstrom |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | 90Y-Therasphere
90Y-SIR sphere |
– |
| Wirkmechanismus des Radiopharmakons | Destruktion von Lebertumor- oder Lebermetastasengewebe | – |
| Bioverteilung/Spezifische Anreicherung in | Im Bereich von hyperperfundierten Arealen, Abhängigkeit der Katheterlage | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Abflussgebiet, v. a. Lunge, Magen | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Fatigue, Krankheitsgefühl, Fieber (alle sehr häufig, > 10 %)
Übelkeit, Erbrechen, Postembolisationssyndrom (häufig, 1 bis 10 %) |
– |
| Seltene schwere Nebenwirkungen | REILD | – |
| Dosis/Dosimetrie (Konijnenberg et al. 2021, Salem et al. 2019, Weber et al. 2022) | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | Variabel, vernachlässigbar im vgl. zur Leberdosis |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | Ziel Leber:
100 Gy bis 120 Gy, abhängig von Berechnung nach single- oder multi-compartment model |
| Dosislimitierendes Organ | Lunge und Leber |
| Angestrebte Dosis Zielregion | Leber:
100 Gy bis 120 Gy, gegebenenfalls 150 Gy; bei Segmenttherapie > 500 Gy |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Berechnung von Lungenshunt, Therapieplanung auf das Lebergewebe |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Intratherapeutische Dosimetrie nicht regelhaft möglich, posttherapeutisch SPECT(/CT) oder PET/CT zum Verteilungsnachweis |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | 90Y |
| Arten der Ausscheidung | Gering renal/Urin (zwischen 0,01 % bis 0,20 %)
auch gastrointestinal/Stuhl (sehr gering) (Drescher et al. 2020) |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal, weniger auch gastrointestinal.
Potenziell auch kontaminierte Zugangswege/Verbandsmaterial |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 Tage |
| Umgang mit Ausscheidung stationär & poststationär | Abwasseranlage (Abklinganlage) (Stationär) |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | γ (fast 100 %) (Bremsstrahlung) |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | γ (Bremsstrahlung) |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Leber |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | 2 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Stationär:
Therapiestation mit Abwasseranlage (Abklinganlage) |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | < 1 mSv5 |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv6 |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Ja |
| Typischerweise empfohlene Hospitalisierungsdauer | Ergibt sich aus der Strahlenschutzempfehlung: mindestens 2 Tage (SSK 2009) |
| Mögliche Gründe für verlängerte Hospitalisierungs-dauer | Pflegebedürftigkeit, Begleiterkrankungen, häusliche Umstände |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Dosimetrie, Strahlenschutz, Überwachung |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Nein |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Behandlung von lebereigenen Tumoren (HCC) und Lebermetastasen |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Entfällt |
| Neue Indikationen im Rahmen von Studien/Forschung | In Kombination mit Immunotherapie |
| Therapie bereits in Leitlinien eingegangen | Ja (z. B. S3 LL HCC) |
| Erstattung | |
|---|---|
| Stationär | DRG, ZE, NUB Einzelfall |
| Ambulant | Nein |
| Probleme mit fehlender Erstattung | MD |
Tabelle 6.2: Radionuklidtherapie SIRT mit Holmium-166
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | poly(L-lactic acid) – PLLA | – | – |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Embolisation | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
– | – | – |
| Typischerweise applizierte Menge | 30 Mio. Partikel bei Therapie, 3 Mio. Partikel bei Diagnostik | – | – |
| Bezug/Herstellung genutzter Radiopharmaka | |
|---|---|
| Bezeichnung | QuiremSpheres, QuiremScout |
| Radiopharmakon/Medizinprodukt kommerziell erhältlich | Ja (Medizinprodukt) |
| Eigenherstellung mit welchen zugelassenen Komponenten | – |
| Existierende Monographien (Ph. Eur.) | Keine, da Medizinprodukt |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | – | A: 166Ho
B: 166mHo |
| Art der Strahlung (%α, %β, %γ) | – | Siehe Tabelle A-1.4 |
| Energiespektren (α, β, γ) | – | Siehe Tabelle A-1.4 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | – | ≈ 200 MBq |
| Entsorgung von Reststoffen und Abwasser | – | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | ≈ 5 GBq bis 7 GBq |
| Art der Applikation | intraarteriell |
| Typische Anzahl an Applikationen/Therapiezyklen | 2 (linker und rechter Leberlappen getrennt) |
| Typischer Zeitabstand zwischen Therapiezyklen | 4 bis 5 Wochen |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | – |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | PLLA | – |
| Wirkmechanismus des Radiopharmakons | Embolisation | – |
| Bioverteilung/Spezifische Anreicherung in | Kapillarbett des Tumors | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant | Lunge | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | – | – |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | k. A. |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | k. A. |
| Dosislimitierendes Organ | Leber |
| Angestrebte Dosis Zielregion | – |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Verteilungsszintigrafie mit [99mTc]Tc-MAA oder QuiremScout, Bestimmung Leber-Lungen-Shunt, Bestimmung Lebermasse |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Verteilungsszintigrafie |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | 166Ho |
| Arten der Ausscheidung | Gering renal/Urin,
auch gastrointestinal/Stuhl (sehr gering) (Drescher et al. 2020) |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal, weniger auch gastrointestinal.
Potenziell auch kontaminierte Zugangswege/Verbandsmaterial |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 Tage |
| Umgang mit Ausscheidung stationär & poststationär | Abwasseranlage (Abklinganlage) (stationär) |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | γ |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch die Patientin/den Patienten | γ |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Leber |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | 2 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Stationäre Aufnahme |
| Umgebung (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | < 1 mSv7 |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv8 |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Ja |
| Typischerweise empfohlene Hospitalisierungsdauer | 2 Tage |
| Mögliche Gründe für verlängerte Hospitalisierungs-dauer | Pflegebedürftigkeit, Begleiterkrankungen, häusliche Umstände |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Dosimetrie, Strahlenschutz, Überwachung |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Entfällt, da nicht erlaubt |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Nein |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Analog SIRT mit 90Y-Partikeln |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | – |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | – |
| Erstattung | |
|---|---|
| Stationär | DRG |
| Ambulant | Nein |
| Probleme mit fehlender Erstattung | MD |
7 Radionuklidtherapie von hämatologischen/onkologischen Erkrankungen mit Lutetium-177 und Yttrium-90 (CXCR4-gerichtete Endoradionuklidtherapie)
Die CXCR4-gerichtete (CXC-Motiv-Chemokinrezeptor 4) Radiorezeptortherapie ist ein neues Verfahren, das derzeit nach Ausschöpfen der etablierten Therapieverfahren eingesetzt wird. Chemokinrezeptoren spielen eine wesentliche Rolle bei der Migration von Zellen und stellen wichtige „homing“-Faktoren für hämatopoetische Stammzellen im Knochenmark und für Absiedlungen von Tumorzellen in verschiedenen Geweben dar. Mit [68Ga]Ga-CXCR4 ist ein PET-Tracer für die gezielte In-vivo-Diagnostik verfügbar, mit [90Y]Y-CXCR4 und [177Lu]Lu-CXCR4 eine Radioligandentherapie (RLT) für CXCR4-exprimierende maligne Tumoren (Buck et al. 2017, Buck et al. 2022)
7.1 Indikationen und Therapieziele
- 1.
-
Multiples Myelom: Progrediente Erkrankung nach vorheriger Behandlung mit konventionellen Chemotherapeutika, Immunmodulatoren und Glukokortikoiden. Die Therapie kann als Bestandteil von Konditionierungsregimen vor geplanter autologer oder allogener Stammzelltransplantation eingesetzt werden.
- 2.
-
Akute Leukosen (akute myeloische Leukämie, akute lymphatische Leukämie): Die Therapie kann bei Frührezidiv nach vorangegangener allogener Stammzelltransplantation oder bei primär refraktärer Erkrankung nach Standardprotokollen eingesetzt werden.
- 3.
-
Maligne Lymphome: Progrediente Erkrankung nach Ausschöpfung der konventionellen, etablierten Therapieoptionen.
- 4.
-
Solide Tumoren: Progrediente Erkrankung nach Ausschöpfung der konventionellen, etablierten Therapieoptionen.
7.2 Durchführung
7.2.1 Vorbereitung und Therapieplanung
Grundsätzlich wird die Indikation in enger Kooperation mit den Kolleginnen und Kollegen der Hämatologie/Onkologie gestellt. Für die Indikationsstellung muss eine gesicherte Histologie oder Zytologie der malignen Grunderkrankung vorliegen.
Eine ausreichende CXCR4-Expression von Tumormanifestationen wird im Rahmen einer prätherapeutischen Bildgebung mit [68Ga]Ga-CXCR4 PET/CT sichergestellt. Vor Durchführung der Therapie ist aufgrund zahlreicher individueller Parameter der Kinetik des Radiopharmakons eine prätherapeutische Dosimetrie obligat. Diese erfolgt mit einer Standardaktivität [177Lu]Lu-CXCR4 (200 MBq). Es folgen Ganzkörperszintigramme zu den Zeitpunkten fünf Minuten, eine Stunde, vier Stunden, 24 Stunden, 48 Stunden, 72 Stunden und gegebenenfalls 96 Stunden nach Verabreichung der Testdosis (Hanscheid et al. 2022).
Als Therapienuklid kommen Lutetium-177 und Yttrium-90 in Betracht. Aufgrund der kürzeren Halbwertszeit kann der Einsatz von Yttrium-90 eine Stammzelltransplantation bereits 14 Tage nach Durchführung der CXCR4-RLT ermöglichen. Bei Verwendung von Lutetium-177 als therapeutisches Radionuklid ist von einer längeren Aplasiephase von bis zu vier Wochen auszugehen. Eine höhere Komplikationsrate ist insbesondere aufgrund der hohen Infektneigung zu berücksichtigen.
Nüchternheit der Patientinnen und Patienten ist für Dosimetrie und Therapie nicht erforderlich. Die Verabreichung des Radiopharmakons erfolgt über eine periphere Verweilkanüle, eine streng intravenöse Applikation ist sicherzustellen.
Vor Beginn der Therapie ist auf eine ausreichende Hydrierung zu achten. Am Therapietag wird eine Prämedikation mit Antiemetika (5-HT3-Antagonisten) empfohlen. Ein Nierenschutz erfolgt durch Verabreichung einer Aminosäurelösung (25 g Lysin und 25 g Arginin in 2 l NaCl). Die Infusion erfolgt zunächst über 30 Minuten bis 60 Minuten und wird dann während der RLT gestoppt. Nach Verabreichung des Therapeutikums wird die Arginin-Lysin-Lösung über weitere zwei bis zweieinhalb Stunden infundiert.
7.2.2 Allgemeiner Therapieverlauf
Vor und nach der RLT ist eine engmaschige Überwachung der Vitalparameter (Puls, Blutdruck) erforderlich.
Die Therapie wird stationär durchgeführt. Innerhalb von 48 Stunden wird ein großer Teil der freien Aktivität renal ausgeschieden. Eine Unterbringung für mindestens 48 Stunden in einer nuklearmedizinischen Therapiestation mit adäquater Rückhalte- und Abwasseranlage (Abklinganlage) für radioaktive Abwässer ist daher obligat. Im Anschluss muss zum Zeitpunkt der Entlassung/Verlegung in eine weiterbehandelnde onkologische Fachabteilung sichergestellt sein, dass die von den Patientinnen und Patienten ausgehende ionisierende Strahlung für Angehörige und Dritte nicht mehr als 1 mSv effektive Dosis verursacht (§ 80 Absatz 1 StrlSchG (StrlSchG 2017) § 122 Absatz 4 StrlSchV (StrlSchV 2018)). Dies wird sichergestellt, indem die zum Entlasszeitpunkt in 2 m Abstand zur Patientenoberfläche gemessene Dosisleistung eine Schwelle unterschreitet, die bei Anwendung des Dosisintegrals einen Wert kleiner 1 mSv gewährleistet (SSK 1996). Da es sich um teils schwerkranke Patientinnen und Patienten handelt, sind regelmäßige körperliche Untersuchungen und Laborbestimmungen angezeigt.
Bei höherer Tumorlast ist das Auftreten eines Tumorlysesyndroms in Betracht zu ziehen und auf eine ausreichende Flüssigkeitszufuhr zu achten (2 l d-1 bis 3 l d-1 in den ersten Tagen nach Therapie).
7.2.3 Nebenwirkungen und Kontraindikationen
Die CXCR4-gerichtete RLT wird sehr gut toleriert (Maurer et al. 2019). Erste Erfahrungen haben keine wesentlichen Akutnebenwirkungen und -toxizitäten oder Unverträglichkeiten ergeben. Allergische Reaktionen sind bislang nicht beobachtet worden. Bei einer meist komplexen Vorgeschichte ist auf das Auftreten allgemein-internistischer Komplikationen wie Blutungen bei Thrombozytopenie und Infektionen zu achten.
Tabelle 7.1: Radionuklidtherapie mit Pentixather [90Y]Y-CXCR4
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | Pentixather9 | – | Arginin-Lysin-Präparation 2 l/2,5-4 h
Protonenpumpenhemmer (z. B. Pantoprazol) Antiemetika (z. B. Ondansetron, Granisetron) |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Keine | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Typischerweise applizierte Menge | 100 µg bis 200 µg | – | Wirkung, Nebenwirkung sowie übliche Dosierungen bitte den Arzneimittelinformationen entnehmen |
| Bezug/Herstellung genutzter Radiopharmaka | |
|---|---|
| Bezeichnung | [90Y]Y-CXCR4
[177Lu]Lu-CXCR4 |
| Radiopharmakon kommerziell erhältlich | Nein |
| Eigenherstellung mit welchen zugelassenen Komponenten | [90Y]YCl3 zur Radiomarkierung
[177Lu]LuCl3 zur Radiomarkierung |
| Existierende Monographien (Ph. Eur.) | 2803 ([90Y]YCl3 zur Radiomarkierung)
2798 ([177Lu]LuCl3 zur Radiomarkierung) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | CXCR4 |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | 90Y
177Lu |
Entfällt |
| Art der Strahlung (%α, %β, %γ) | Siehe Tabelle A-1.1 und A-1.6 | |
| Energiespektren (α, β, γ) | Siehe Tabelle A-1.1 und A-1.6 | |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | Typischerweise gering (< 5 %), größere Restmengen bei klinisch bedingter Teilentnahme | |
| Entsorgung von Reststoffen und Abwasser | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung | |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | [90Y]Y-CXCR4:
3-30 GBq, Berechnung nach individueller Dosimetrie |
| Art der Applikation | i. v. via ZVK oder peripheren venösen Katheter (über 0,5 h bis 1 h) |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 |
| Typischer Zeitabstand zwischen Therapiezyklen | Entfällt |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Knochenmarkfunktion, Verfügbarkeit hämatopoetischer Stammzellen |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | [90Y]Y-CXCR4 | – |
| Wirkmechanismus des Radiopharmakons | Myeloablation (Stammzellen)
Irradiation CXCR4-exprimierender Tumorzellen Crossfire-Effekt |
– |
| Bioverteilung/Spezifische Anreicherung in | Blutbildendes Knochenmark, CXCR4-exprimierendes Tumorzell-Kompartiment | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Renale und hepatische Exkretion | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Panzytopenie, Fatigue | – |
| Seltene schwere Nebenwirkungen | – | – |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | 90Y
177Lu |
| Arten der Ausscheidung | Renal/Urin, geringer gastrointestinal/Stuhl |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | 2 Tage |
| Umgang mit Ausscheidung stationär & poststationär | Abwasseranlage (Abklinganlage) (Stationär)
Poststationär: Empfehlung an die Patienten zum Sammeln von Vorlagen oder ähnlichem für mehrere Tage; idealerweise Toilette nach Benutzung mehrfach spülen |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | Bremsstrahlung (fast 100 %) |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch Patientinnen und Patienten | Bremsstrahlung (fast 100 %) |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Niere, Harnblase |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | 2 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Stationär:
Therapiestation mit Abwasseranlage (Abklinganlage). Im Anschluss Übernahme durch Hämatologie/Onkologie zur Durchführung der Stammzelltransplantation (auto/alloPBSCT) |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | 2 Gy |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | 2 Gy |
| Dosislimitierendes Organ | Niere und Harnblase |
| Angestrebte Dosis Zielregion | Knochenmark: 2 Gy
Tumorkompartiment: > 30 Gy Hämatologische Erkrankungen: > 30 Gy Solide Tumoren: > 20 Gy |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | [68Ga]Ga-CXCR4-PET/CT,
[177Lu]Lu-CXCR4-Szintigraphie, Berechnung der Knochenmark-Aktivität, Nieren-/Leberdosis |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | Posttherapeutisch SPECT/CT zur Abschätzung der erzielten Knochenmark- bzw. Tumor-Dosis |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | < 1 mSv10 |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv11 |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Ja |
| Typischerweise empfohlene Hospitalisierungsdauer | 48 h |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | Dosimetrie, Strahlenschutz im Hinblick auf die Ausscheidungen, Überwachung |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | Noch keine vorhanden |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Anwendung zur Myeloablation im Rahmen der Konditionierung vor auto/alloPBSCT
(Multiples Myelom, akute myeloische Leukämie, aggressive Lymphome) |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | Nein |
| Erstattung | |
|---|---|
| Stationär | NUB, Einzelfall |
| Ambulant | Entfällt |
| Probleme mit fehlender Erstattung | Nein |
8 Radionuklidtherapie von B-Zell-Non-Hodgkin-Lymphomen mit [90Y]Y-CD20-Ibritumomab-Tiuxetan (Zevalin)
Bei der Radioimmuntherapie kommt das Radiopharmakon [90Y]Y-CD20-Ibritumomab-Tiuxetan zum Einsatz. CD20 ist ein Antigen, das an der Oberfläche von B-Lymphozyten exprimiert wird.
8.1 Indikationen und Therapieziele
Die Indikation zur Radioimmuntherapie wird gemeinsam mit den Kolleginnen und Kollegen der Hämatologie/Onkologie gestellt. [90Y]Y-CD20-Ibritumomab-Tiuxetan (Zevalin) ist zugelassen für die Behandlung des CD20-positiven follikulären Non-Hodgkin-Lymphoms, das refraktär auf die Behandlung mit anderen CD20-spezifischen Immunkonjugaten (Rituximab) ist oder nach einer Induktionstherapie rezidiviert ist.
8.2 Durchführung
8.2.1 Vorbereitung und Therapieplanung
Eine prätherapeutische Dosimetrie ist nicht erforderlich, eine Ganzkörperszintigraphie mit Indium-111-markierten anti-CD20-Antikörpern kann Anhaltspunkte für erhöhte Komplikationsraten liefern. Empfehlenswert ist ferner eine prätherapeutische Ganzkörper-Bildgebung zur Erfassung sämtlicher Lymphom-Manifestationen. [18F]FDG-PET/CT oder -PET-MRT erscheinen als besonders geeignete Methoden.
Innerhalb einer Woche vor Durchführung der Radioimmuntherapie ist eine Kontrolle des Blutbildes erforderlich. Da die Therapie mit Blutbildveränderungen einhergeht, sollten vor Therapie die Messwerte für Leukozyten über 1500 µl-1 und für Thrombozyten über 100 000 µl-1 betragen. Der Infiltrationsgrad des Knochenmarks soll weniger als 25 % betragen, die Lebenserwartung mehr als drei Monate.
8.2.2 Allgemeiner Therapie-Ablauf
Zur Absättigung unspezifischer CD20-Antigene erfolgt eine Woche vor der Radioimmuntherapie die Verabreichung des nicht-radioaktiven Antikörpers (Rituximab) in einer Dosierung von 250 mg m-2 Körperoberfläche (Tag 1). Diese Infusion wird eine Woche später (Tag 8) in derselben Dosierung wiederholt. Im Anschluss kann die Verabreichung des Radioimmunkonjugats erfolgen. Die Infusion erfolgt in der Regel als Kurzinfusion (z. B. zehn Minuten). Die Patientinnen und Patienten müssen vor Durchführung der Therapie nicht nüchtern sein (Tennvall et al. 2007).
Bei Thrombozyten > 150 000 erfolgt an Tag 8 die Verabreichung von 15 MBq [90Y]Y-CD20-mAK kg-1 Körpergewicht. Bei Thrombozytopenie (100 000-149 000) erfolgt eine Dosisreduktion auf 11 MBq kg-1 Körpergewicht. Die Maximaldosis beträgt 1,2 GBq.
8.2.3 Nebenwirkungen und Kontraindikationen
Akute Nebenwirkungen nach Applikation von Yttrium-90-Zevalin sind in der Regel nicht zu erwarten.
Eine stationäre Aufnahme der Patientin/des Patienten ist nicht zwingend erforderlich.
Häufigste Nebenwirkung ist ein Absinken der Leukozyten und Thrombozyten um 30 % bis 70 %, bezogen auf den Ausgangswert. Der stärkste Abfall tritt in der Regel sieben bis neun Wochen nach Durchführung der Therapie auf. Daher werden regelmäßige Kontrollen des Blutbilds mindestens in wöchentlichen Abständen bis zur vollständigen Erholung der Knochenmarkfunktion empfohlen. Nach Radioimmuntherapie besteht ein erhöhtes Risiko für sekundäre myelodysplastische Syndrome (MDS) oder für das Auftreten einer akuten myeloischen Leukämie.
Paravasate sind zwingend zu vermeiden, da diese zu lokalen Radionekrosen im Weichgewebe führen können.
Tabelle 8.1: Radionuklidtherapie mit Zevalin®90Y-Ibritumomab-Tiuxetan
| Pharmakologische Wirkungen unmarkierter Träger-/Begleitsubstanzen | |||
|---|---|---|---|
| Mit dem Radionuklid zu markierende pharmakologische Wirk- bzw. Trägersubstanz(en), falls vorhanden |
Begleitsubstanz(en) im applizierten Präparat, falls vorhanden |
Üblicherweise bei Therapie zusätzlich applizierte Substanzen |
|
| Bezeichnung | anti-CD20 monoklonaler Antikörper (Ibritumomab-Tiuxetan) | – | HAMA-Test vor der Therapie erforderlich |
| Bekannte pharmakologische Wirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität | B-Zelldepletion | – | – |
| Bekannte Nebenwirkungen unmarkierte Träger-/Begleitsubstanzen in appl. Quantität |
Infektneigung, Übelkeit, Erbrechen, Fieber, Kopfschmerzen, Husten, Schwindel | – | – |
| Typischerweise applizierte Menge | 3 mg mAk
250 mg m-2 KOF unmarkierter Antikörper als Komedikation (Rituximab) |
– | – |
| Bezug/Herstellung von Zevalin | |
|---|---|
| Bezeichnung | [90Y]Y-CD20-Ibritumomab-Tiuxetan (Zevalin) |
| Radiopharmakon kommerziell erhältlich | Einzelkomponenten als zugelassene Arzneimittel im Sinne des Arzneimittelrechts kommerziell erhältlich |
| Eigenherstellung mit welchen zugelassenen Komponenten | [90Y]YCl3 zur Radiomarkierung und Ibritumomab-Tiuxetan (Zevalin) |
| Existierende Monographien (Ph. Eur.) | 2 803 ([90Y]YCl3 zur Radiomarkierung) |
| Eigenherstellung mit welchen nicht zugelassenen Komponenten | – |
| Aktiver Abfall bei Herstellung/Lieferung | ||
|---|---|---|
| Bei der Eigenherstellung | Bei geliefertem Präparat (Langlebige Begleitnuklide im Präparat) |
|
| Bezeichnung | Entfällt | [90Y]Y-CD20-Ibritumomab-Tiuxetan (Zevalin) |
| Art der Strahlung (%α, %β, %γ) | Entfällt | Siehe Tabelle A-1.1 |
| Energiespektren (α, β, γ) | Entfällt | Siehe Tabelle A-1.1 |
| Typischerweise anfallende Aktivitätsmenge im Abfall pro Therapie (α, β, γ MBq) | Entfällt | Gering (< 5 %) |
| Entsorgung von Reststoffen und Abwasser | Entfällt | Lagerung bis zum Abklingen, anschließend Freigabe nach § 35 StrlSchV und konventionelle Entsorgung |
| Applikation des Radiopharmakons | |
|---|---|
| Art und Menge der applizierten Therapie | |
| Typischerweise applizierte Aktivität pro Therapiezyklus | 90Y-Ibritumomab-Tiuxetan (Zevalin):
Max. 1,2 GBq 15 MBq kg-1 KG (Thrombozyten > 150 000) 11 MBq kg-1 KG (Thrombozyten 100 000 - 150 000) |
| Art der Applikation | langsame i. v. via ZVK oder peripher-venösen Katheter |
| Typische Anzahl an Applikationen/Therapiezyklen | 1 |
| Typischer Zeitabstand zwischen Therapiezyklen | Entfällt |
| Limitierende Faktoren für Wiederholung (z. B. dosislimitierendes Organ) | Knochenmarkfunktion |
| Wirkung | ||
|---|---|---|
| Radiopharmakon | Metaboliten | |
| Bezeichnung Radiopharmakon | 90Y | – |
| Wirkmechanismus des Radiopharmakons | Irradiation CD20-positiver maligner (aber auch benigner) B-Lymphozyten bzw. CD20-positiver Lymphome | – |
| Bioverteilung/Spezifische Anreicherung in | Knochenmark, CD20-positive Lymphome | – |
| Nicht-spezifische bzw. Non-Target-Anreicherung dominant in | Renale und hepatische Exkretion | – |
| Bekannte häufige Nebenwirkungen (> 10 %) | Leukopenie, Fatigue, Asthenie, Übelkeit, Erbrechen, Kopfschmerzen, Husten, Schwindel, Atemnot | – |
| Seltene schwere Nebenwirkungen | – | – |
| Dosis/Dosimetrie | |
|---|---|
| Typische effektive Dosis pro Einzeltherapie pro Patientinnen und Patienten (pro Anwendung) | 2 Gy |
| Typische effektive Dosis (Summe aller Zyklen für Patientinnen und Patienten) | 2 Gy |
| Dosislimitierendes Organ | Niere, Harnblase und Knochenmark |
| Angestrebte Dosis Zielregion | Tumorkompartiment: > 30 Gy |
| Erforderliche prätherapeutische dosimetrische und bildgebende Maßnahmen | Standardaktivitäten nach Knochenmarkfunktion |
| Posttherapeutisch erforderliche dosimetrische und bildgebende Maßnahmen | – |
| Strahlenexposition Umfeld/Mitarbeiterinnen und Mitarbeiter/Umwelt | |
|---|---|
| Radioaktive Ausscheidung durch Patientinnen und Patienten | |
| Ausgeschiedene Nuklide | 90Y |
| Arten der Ausscheidung | Renal, geringer gastrointestinal/Stuhl |
| Strahlenschutzrelevantester Ausscheidungsweg | Renal |
| Typische Dauer einer strahlenschutzrelevanten Ausscheidung | Anteil ausgeschiedener Aktivität relativ gering, Großteil erfolgt innerhalb der ersten 48 h (ca. 4 %) (Geworski et al. 2006) |
| Umgang mit Ausscheidung stationär & poststationär | Ambulante Therapie (SSK 2005), wenn stationär Abwasseranlage (Abklinganlage) |
| Emittierte Strahlung durch therapierte Patientinnen und Patienten selbst | |
| Art der abgegebenen Strahlung (%α, %β, %γ) | Bremsstrahlung (fast 100 %) |
| Strahlenschutzrelevanteste Art(en) der Strahlung durch die Patientin/den Patienten | Bremsstrahlung (fast 100 %) |
| Anatomische Strahlungsschwerpunkte (falls vorhanden) | Niere, Harnblase |
| Typische Dauer einer strahlenschutzrelevanten Strahlung durch Patientinnen und Patienten | 2 Tage |
| Erforderliche Strahlenschutzmaßnahmen stationär & poststationär | Ambulant möglich |
| Dosis für die Umgebung der Patientinnen und Patienten (Person im Haushalt) | |
|---|---|
| Mögliche Dosis Person im Haushalt pro Einzeltherapie | < 1 mSv12 |
| Mögliche Dosis Summe aller Zyklen für Person im Haushalt bei typischer Anzahl Zyklen (</> 1 mSv) | < 1 mSv13 |
| Expositionsberechnung von Personen im Haushalt/Jahr über Summe aller Zyklen, gegebenenfalls mit Anpassung stationärer Aufenthalt erforderlich | Nein |
| Hospitalisierungskonzept | |
|---|---|
| Stationäre Durchführung erforderlich | Nein |
| Typischerweise empfohlene Hospitalisierungsdauer | 48 h |
| Mögliche Gründe für verlängerte Hospitalisierungsdauer | – |
| Gründe für Sicherheit der Therapie nur stationär gewährleistet | – |
| Ambulant möglich, aber stationäre Aufnahme gegebenenfalls erforderlich, wenn | Schlechter allgemeiner Gesundheitszustand |
| Besondere Faktoren mit Einfluss auf Anzahl/Dauer der Hospitalisierung | Nein |
| Indikation(en) für die Therapie | |
|---|---|
| Zugelassene Indikationen | CD20-positives follikuläres Lymphom (Rituximab-refraktär) |
| Derzeitig gängige Indikationen für Therapie als indiv. Heilmaßnahme | Andere low-grade Lymphome; DLBCL |
| Neue Indikationen im Rahmen von Studien/Forschung | Entfällt |
| Therapie bereits in Leitlinien eingegangen | Ja (S3-Leitlinie Diagnostik, Therapie und Nachsorge für Patientinnen und Patienten mit einem follikulären Lymphom, Stand 07/2020) |
| Erstattung | |
|---|---|
| Stationär | DRG, Einzelfall |
| Ambulant | Kostenübernahme |
| Probleme mit fehlender Erstattung | Nein |
Literatur
| Bauman et al. 2005 | Bauman G, Charette M, Reid R, Sathya J. Radiopharmaceuticals for the palliation of painful bone metastasis – a systemic review. Radiother Oncol. 2005 Jun;75(3):258-70, doi: 10.1016/j.radonc.2005.03.003, Epub 2005/11/22 |
| Beil und Ruther 2015 | Beil FT, Ruther W. [Indications and contraindications for radiosynoviorthesis]. Z Rheumatol. 2015 Nov;74(9):780-5, doi: 10.1007/s00393-015-1627-9, Epub 2015/11/12 |
| Bodei et al. 2008 | Bodei L, Cremonesi M, Ferrari M, Pacifici M, Grana CM, Bartolomei M, Baio SM, Sansovini M, Paganelli G. Long-term evaluation of renal toxicity after peptide receptor radionuclide therapy with 90Y-DOTATOC and 177Lu-DOTATATE: the role of associated risk factors. Eur J Nucl Med Mol Imaging. 2008 Oct;35(10):1847-56, doi: 10.1007/s00259-008-0778-1, Epub 22. 04. 2008 |
| Buck et al. 2017 | Buck AK, Stolzenburg A, Hanscheid H, Schirbel A, Luckerath K, Schottelius M, Wester HJ, Lapa C. Chemokine receptor – Directed imaging and therapy. Methods. 2017 Nov 1;130:63-71, doi: 10.1016/j.ymeth.2017.09.002, Epub 20170912 |
| Buck et al. 2022 | Buck AK, Haug A, Dreher N, Lambertini A, Higuchi T, Lapa C, Weich A, Pomper MG, Wester HJ, Zehnder A, Schirbel A, Samnick S, Hacker M, Pichler V, Hahner S, Fassnacht M, Einsele H, Serfling S, Werner RA. Imaging of C-X-C Motif Chemokine Receptor 4 Expression in 690 Patients with Solid or Hematologic Neoplasms using (68)Ga-PentixaFor PET. J Nucl Med. 2022 Mar 3, doi: 10.2967/jnumed.121.263693, Epub 20220303 |
| Chittenden et al. 2015 | Chittenden SJ, Hindorf C, Parker CC, Lewington VJ, Pratt BE, Johnson B, Flux GD. A Phase 1, Open-Label Study of the Biodistribution, Pharmacokinetics, and Dosimetry of 223Ra-Dichloride in Patients with Hormone-Refractory Prostate Cancer and Skeletal Metastases. J Nucl Med. 2015 Sep;56(9):1304-9, doi: 10.2967/jnumed.115.157123, Epub 20150716 |
| Deutsch et al. 1993 | Deutsch E, Brodack JW, Deutsch KF. Radiation synovectomy revisited. Eur J Nucl Med. 1993 Nov;20(11):1113-27, doi: 10.1007/BF00173494, Epub 1993/11/01 |
| DGN 2015 | Deutsche Gesellschaft für Nuklearmedizin e. V. (DGN). Radioiodtherapie bei benignen Schilddrüsenerkrankungen (Version 5). DGN-Handlungsempfehlung (S1-Leitlinie). Stand: 10/2015 – AWMF-Registernummer: 031-003. |
| https://www.awmf.org/uploads/tx_szleitlinien/031-003l_S1_Radioiodtherapie_benigne_Schilddruesenerkrankungen_2015-10-abgelaufen.pdf, zuletzt aufgerufen am 14.06.2022 | |
| DIN 6844-2 2020 | Deutsches Institut für Normung (DIN). DIN 6844-2. Nuklearmedizinische Betriebe – Teil 2: Regeln für die Errichtung und Ausstattung von Einrichtungen zur therapeutischen Anwendung von offenen radioaktiven Stoffen. |
| Drescher et al. 2020 | Drescher R, Kuhnel C, Seifert P, Guhne F, Freesmeyer M. Renal and Intestinal Excretion of (90)Y and (166)Ho After Transarterial Radioembolization of Liver Tumors. AJR Am J Roentgenol. 2020 May;214(5):1158-64, doi: 10.2214/AJR.19.22049, Epub 20200304 |
| Esser et al. 2006 | Esser JP, Krenning EP, Teunissen JJ, Kooij PP, van Gameren AL, Bakker WH, Kwekkeboom DJ. Comparison of [(177)Lu-DOTA(0),Tyr(3)]octreotate and [(177)Lu-DOTA(0),Tyr(3)]octreotide: which peptide is preferable for PRRT? Eur J Nucl Med Mol Imaging. 2006 Nov;33(11):1346-51, doi: 10.1007/s00259-006-0172-9, Epub 2006/07/19 |
| Feuerecker et al. 2021 | Feuerecker B, Tauber R, Knorr K, Heck M, Beheshti A, Seidl C, Bruchertseifer F, Pickhard A, Gafita A, Kratochwil C, Retz M, Gschwend JE, Weber WA, D’Alessandria C, Morgenstern A, Eiber M. Activity and Adverse Events of Actinium-225-PSMA-617 in Advanced Metastatic Castration-resistant Prostate Cancer After Failure of Lutetium-177-PSMA. Eur Urol. 2021 Mar;79(3):343-50, doi: 10.1016/j.eururo.2020.11.013, Epub 2020/12/10 |
| Fischer 1999 | Fischer M. Guidelines for radionuclide therapy in painful bone metastasi. Nuklearmedizin. 1999 1999;38(6A):270-2 |
| Freudenberg et al. 2022 | Freudenberg R, Hesse L, Kotzerke J. [Evaluation of radionuclide impurities in several radiopharmaceuticals]. Nuklearmedizin. 2022 Apr 14, doi: 10.1055/a-1759-1815, Epub 20220414 |
| Gabriel et al. 2021 | Gabriel M, Poppel TD, Freudenberg LS, Farahati J, Krause T, Buchmann I, Panholzer PJ, Modder G, Becherer A, Kampen WU, Kurth J, Krause BJ, Wissmeyer M, Kresnik E, Weitere B, Deutsche Gesellschaft fur Rheumatologie e. V., Deutsche Schmerzgesellschaft e. V. [Joint DGN, OGNMB and SGNM S1 guideline for radiosynoviorthesis]. Nuklearmedizin. 2021 Apr;60(2):78-89, doi: 10.1055/a-1324-4745, Epub 2021/04/10 |
| Geworski et al. 2006 | Geworski L, Zöphel K, Rimpler A, Barth I, Lassmann M, Sandrock D, Zander A, Halm T, Hänscheid H, Hofmann M, Reiners C. Radiation exposure in (90)Y-Zevalin therapy: results of a prospective multicentre trial. Nuklearmedizin. 2006;45(2):82-6 |
| Handkiewicz-Junak et al. 2018 | Handkiewicz-Junak D, Poeppel TD, Bodei L, Aktolun C, Ezziddin S, Giammarile F, Delgado-Bolton RC, Gabriel M. EANM guidelines for radionuclide therapy of bone metastases with beta-emitting radionuclides. Eur J Nucl Med Mol Imaging. 2018 May;45(5):846-59, doi: 10.1007/s00259-018-3947-x, Epub 2018/02/18 |
| Hanscheid et al. 2022 | Hanscheid H, Schirbel A, Hartrampf P, Kraus S, Werner RA, Einsele H, Wester HJ, Lassmann M, Kortum M, Buck AK. Biokinetics and Dosimetry of (177)Lu-Pentixather. J Nucl Med. 2022 May;63(5):754-60, doi: 10.2967/jnumed.121.262295, Epub 20210819 |
| Hofman et al. 2021 | Hofman MS, Emmett L, Sandhu S, Iravani A, Joshua AM, Goh JC, Pattison DA, Tan TH, Kirkwood ID, Ng S, Francis RJ, Gedye C, Rutherford NK, Weickhardt A, Scott AM, Lee S-T, Kwan EM, Azad AA, Ramdave S, Redfern AD, Macdonald W, Guminski A, Hsiao E, Chua W, Lin P, Zhang AY, McJannett MM, Stockler MR, Violet JA, Williams SG, Martin AJ, Davis ID, Azad AA, Chua W, Davis ID, Dhiantravan N, Emmett L, Ford K, Hofman MS, Francis RJ, Gedye C, Goh JC, Guminski A, Hsiao E, Iravani A, Joshua AM, Kirkwood ID, Langford A, Lawrence N, Lee S-T, Lin P, Martin AJ, McDonald W, McJannett MM, Ng S, Pattison DA, Ramdave S, Rana N, Redfern AD, Rutherford NK, Sandhu S, Scott AM, Stockler MR, Subramaniam S, Tan TH, Violet JA, Weickhardt A, Williams SG, Yip S, Zhang AY. [177Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. The Lancet. 2021;397(10276):797-804, doi: 10.1016/s0140-6736(21)00237-3 |
| Hope et al. 2019 | Hope TA, Abbott A, Colucci K, Bushnell DL, Gardner L, Graham WS, Lindsay S, Metz DC, Pryma DA, Stabin MG, Strosberg JR. NANETS/SNMMI Procedure Standard for Somatostatin Receptor-Based Peptide Receptor Radionuclide Therapy with (177)Lu-DOTATATE. J Nucl Med. 2019 Jul;60(7):937-43, doi: 10.2967/jnumed.118.230607, Epub 2019/07/03 |
| Hope et al. 2020 | Hope TA, Bodei L, Chan JA, El-Haddad G, Fidelman N, Kunz PL, Mailman J, Menda Y, Metz DC, Mittra ES, Pryma DA, Reidy-Lagunes DL, Singh S, Strosberg JR. NANETS/SNMMI Consensus Statement on Patient Selection and Appropriate Use of (177)Lu-DOTATATE Peptide Receptor Radionuclide Therapy. J Nucl Med. 2020 Feb;61(2):222-7, doi: 10.2967/jnumed.119.240911, Epub 2020/02/06 |
| Jentzen et al. 2006 | Jentzen W, Schneider E, Freudenberg L, Eising EG, Gorges R, Muller SP, Brandau W, Bockisch A. Relationship between cumulative radiation dose and salivary gland uptake associated with radioiodine therapy of thyroid cancer. Nucl Med Commun. 2006 Aug;27(8):669-76, doi: 10.1097/00006231-200608000-00009, Epub 2006/07/11 |
| Konig et al. 2020 | Konig F, Strauss A, Johannsen M, Mommsen C, Fricke E, Klier J, Mehl S, Pfister D, Sahlmann CO, Werner A, Goebell PJ. [Radium-223 for the treatment of metastatic castration-resistant prostate cancer (mCRPC) : The androgen receptor-independent active agent in the therapeutic sequence]. Urologe A. 2020 Jan;59(1):53-64, doi: 10.1007/s00120-019-01052-4, Epub 2019/10/11 |
| Konijnenberg et al. 2021 | Konijnenberg M, Herrmann K, Kobe C, Verburg F, Hindorf C, Hustinx R, Lassmann M. EANM position paper on article 56 of the Council Directive 2013/59/Euratom (basic safety standards) for nuclear medicine therapy. Eur J Nucl Med Mol Imaging. 2021 Jan;48(1):67-72, doi: 10.1007/s00259-020-05038-9, Epub 2020/10/16 |
| Kratochwil et al. 2016 | Kratochwil C, Giesel FL, Stefanova M, Benesova M, Bronzel M, Afshar-Oromieh A, Mier W, Eder M, Kopka K, Haberkorn U. PSMA-Targeted Radionuclide Therapy of Metastatic Castration-Resistant Prostate Cancer with 177Lu-Labeled PSMA-617. J Nucl Med. 2016 Aug;57(8):1170-6, doi: 10.2967/jnumed.115.171397, Epub 20160316 |
| Kratochwil et al. 2017 | Kratochwil C, Bruchertseifer F, Rathke H, Bronzel M, Apostolidis C, Weichert W, Haberkorn U, Giesel FL, Morgenstern A. Targeted alpha-Therapy of Metastatic Castration-Resistant Prostate Cancer with (225)Ac-PSMA-617: Dosimetry Estimate and Empiric Dose Finding. J Nucl Med. 2017 Oct;58(10):1624-31, doi: 10.2967/jnumed.117.191395, Epub 20170413 |
| Kresnik et al. 2002 | Kresnik E, Mikosch P, Gallowitsch HJ, Jesenko R, Just H, Kogler D, Gasser J, Heinisch M, Unterweger O, Kumnig G, Gomez I, Lind P. Clinical outcome of radiosynoviorthesis: a meta-analysis including 2190 treated joints. Nucl Med Commun. 2002 Jul;23(7):683-8, doi: 10.1097/00006231-200207000-00013, Epub 2002/06/29 |
| Kurth et al. 2018 | Kurth J, Krause BJ, Schwarzenbock SM, Stegger L, Schafers M, Rahbar K. External radiation exposure, excretion, and effective half-life in (177)Lu-PSMA-targeted therapies. EJNMMI Res. 2018 Apr 12;8(1):32, doi: 10.1186/s13550-018-0386-4, Epub 2018/04/14 |
| Linke et al. 2011 | Linke R, Gelse K, Schuch F. [The indication for radiosynoviorthesis. From the perspective of the nuclear medicine expert, rheumatic orthopedist and internist]. Z Rheumatol. 2011 Jan;70(1):34-44, doi: 10.1007/s00393-010-0683-4, Epub 2011/01/27 |
| Loebe et al. 2014 | Loebe T, Hettwig B, Fischer HW. Detection of long-lived europium-152 in samarium-153-lexidronam. Appl Radiat Isot. 2014 Dec;94:40-3, doi: 10.1016/j.apradiso.2014.06.017, Epub 18. 07. 2014 |
| Maurer et al. 2019 | Maurer S, Herhaus P, Lippenmeyer R, Hanscheid H, Kircher M, Schirbel A, Maurer HC, Buck AK, Wester HJ, Einsele H, Grigoleit GU, Keller U, Lapa C. Side Effects of CXC-Chemokine Receptor 4-Directed Endoradiotherapy with Pentixather Before Hematopoietic Stem Cell Transplantation. J Nucl Med. 2019 Oct;60(10):1399-405, doi: 10.2967/jnumed.118.223420, Epub 2019/03/10 |
| Metyko et al. 2012 | Metyko J, Williford JM, Erwin W, Poston J, Jr., Jimenez S. Long-lived impurities of 90Y-labeled microspheres, TheraSphere and SIR-spheres, and the impact on patient dose and waste management. Health Phys. 2012 Nov;103(5 Suppl 3):S204-8, doi: 10.1097/HP.0b013e31826566f0 |
| Mulcahy et al. 2021 | Mulcahy MF, Mahvash A, Pracht M, Montazeri AH, Bandula S, Martin RCG, 2nd, Herrmann K, Brown E, Zuckerman D, Wilson G, Kim TY, Weaver A, Ross P, Harris WP, Graham J, Mills J, Yubero Esteban A, Johnson MS, Sofocleous CT, Padia SA, Lewandowski RJ, Garin E, Sinclair P, Salem R, Investigators E. Radioembolization With Chemotherapy for Colorectal Liver Metastases: A Randomized, Open-Label, International, Multicenter, Phase III Trial. J Clin Oncol. 2021 Dec 10;39(35):3897-907, doi: 10.1200/JCO.21.01839, Epub 20210920 |
| Pandit-Taskar et al. 2014 | Pandit-Taskar N, Larson SM, Carrasquillo JA. Bone-seeking radiopharmaceuticals for treatment of osseous metastases, Part 1: alpha therapy with 223Ra-dichloride. J Nucl Med. 2014 Feb;55(2):268-74, doi: 10.2967/jnumed.112.112482, Epub 2013/12/18 |
| Poppel et al. 2016 | Poppel TD, Andreeff M, Becherer A, Bockisch A, Fricke E, Geworski L, Heinzel A, Krause BJ, Krause T, Mitterhauser M, Scheidhauer K, Schenck M, Sonnenschein W, Gabriel M. [Therapy of bone metastases with radium-223. German guidelines]. Nuklearmedizin. 2016 Sep 26;55(5):177-86, doi: 10.3413/Nukmed-2016050001, Epub 2016/07/16 |
| Rahbar et al. 2019 | Rahbar K, Bodei L, Morris MJ. Is the Vision of Radioligand Therapy for Prostate Cancer Becoming a Reality? An Overview of the Phase III VISION Trial and Its Importance for the Future of Theranostics. J Nucl Med. 2019 Nov;60(11):1504-6, doi: 10.2967/jnumed.119.234054, Epub 2019/08/28 |
| Riachy et al. 2020 | Riachy R, Ghazal N, Haidar MB, Elamine A, Nasrallah MP. Early Sialadenitis After Radioactive Iodine Therapy for Differentiated Thyroid Cancer: Prevalence and Predictors. Int J Endocrinol. 2020;2020:8649794, doi: 10.1155/2020/8649794, Epub 2020/11/10 |
| Salem et al. 2019 | Salem R, Padia SA, Lam M, Bell J, Chiesa C, Fowers K, Hamilton B, Herman J, Kappadath SC, Leung T, Portelance L, Sze D, Garin E. Clinical and dosimetric considerations for Y90: recommendations from an international multidisciplinary working group. Eur J Nucl Med Mol Imaging. 2019 Jul;46(8):1695-704, doi: 10.1007/s00259-019-04340-5, Epub 2019/05/18 |
| Sartor et al. 2021 | Sartor O, de Bono J, Chi KN, Fizazi K, Herrmann K, Rahbar K, Tagawa ST, Nordquist LT, Vaishampayan N, El-Haddad G, Park CH, Beer TM, Armour A, Perez-Contreras WJ, DeSilvio M, Kpamegan E, Gericke G, Messmann RA, Morris MJ, Krause BJ, Investigators V. Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med. 2021 Sep 16;385(12):1091-103, doi: 10.1056/NEJMoa2107322, Epub 20210623 |
| Seidel und Kommission | Pharmakotherapie der DGRh 2006 Seidel W, Kommission Pharmakotherapie der DGRh. [Radiosynoviorthesis]. Z Rheumatol. 2006 May;65(3):239-44, doi: 10.1007/s00393-005-0011-6, Epub 2006/02/02 |
| SSK 1996 | Strahlenschutzkommission (SSK). Strahlenschutzgrundsätze für die Radioiod-Therapie. Stellungnahme der Strahlenschutzkommission, verabschiedet in der 142. Sitzung der SSK am 05./06.12.1996. Bekanntmachung im BAnz. Nr. 68 vom 11. April 1997 |
| SSK 2005 | Strahlenschutzkommission (SSK). Radioimmuntherapie mit Y-90-Ibritumomab-Tiuxetan (Y-90-Zevalin®). Empfehlung der Strahlenschutzkommission, verabschiedet in der 198. Sitzung der SSK am 17.02.2005. Bekanntmachung im BAnz. Nr. 12 vom 18. Januar 2006 |
| SSK 2009 | Strahlenschutzkommission (SSK). Radionuklidtherapie mittels selektiver intraarterieller Radiotherapie (SIRT) und intravasale Bestrahlung mit offenen Radionukliden. Empfehlung der Strahlenschutzkommission, verabschiedet in der 236. Sitzung der SSK am 17./18.09.2009. http://www.ssk.de/SharedDocs/Beratungsergebnisse_PDF/2009/Radionuklidtherapie_SIRT.html |
| Stoll 2018 | Stoll C. Landesinstitut für Arbeitsgestaltung des Landes Nordrhein-Westfalen. Entlassung von Patienten nach nuklearmedizinischer Therapie mit Lu-177. 2018 |
| StrlSchG 2017 | Gesetz zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzgesetz – StrlSchG) vom 27. Juni 2017 (BGBl. I S. 1966), das zuletzt durch Artikel 11 des Gesetzes vom 12. Dezember 2019 (BGBl. I S. 2510) geändert worden ist |
| StrlSchV 2018 | Verordnung zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzverordnung – StrlSchV) vom 29. November 2018. (BGBl. I S. 2034, 2036), die durch Artikel 1 der Verordnung vom 27. März 2020 (BGBl. I S. 748) geändert worden ist |
| Strosberg et al. 2017 | Strosberg J, El-Haddad G, Wolin E, Hendifar A, Yao J, Chasen B, Mittra E, Kunz PL, Kulke MH, Jacene H, Bushnell D, O’Dorisio TM, Baum RP, Kulkarni HR, Caplin M, Lebtahi R, Hobday T, Delpassand E, Van Cutsem E, Benson A, Srirajaskanthan R, Pavel M, Mora J, Berlin J, Grande E, Reed N, Seregni E, Oberg K, Lopera Sierra M, Santoro P, Thevenet T, Erion JL, Ruszniewski P, Kwekkeboom D, Krenning E, Investigators N-T. Phase 3 Trial of (177)Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med. 2017 Jan 12;376(2):125-35, doi: 10.1056/NEJMoa1607427, Epub 2017/01/12 |
| Tennvall et al. 2007 | Tennvall J, Fischer M, Bischof Delaloye A, Bombardieri E, Bodei L, Giammarile F, Lassmann M, Oyen W, Brans B, Therapy Committee E, Oncology Committee E, Dosimetry Committee E. EANM procedure guideline for radio-immunotherapy for B-cell lymphoma with 90Y-radiolabelled ibritumomab tiuxetan (Zevalin). Eur J Nucl Med Mol Imaging. 2007 Apr;34(4):616-22, doi: 10.1007/s00259-007-0372-y |
| Weber et al. 2022 | Weber M, Lam M, Chiesa C, Konijnenberg M, Cremonesi M, Flamen P, Gnesin S, Bodei L, Kracmerova T, Luster M, Garin E, Herrmann K. EANM procedure guideline for the treatment of liver cancer and liver metastases with intra-arterial radioactive compounds. Eur J Nucl Med Mol Imaging. 2022 Feb 11, doi: 10.1007/s00259-021-05600-z, Epub 11. 02. 2022 |
Anhänge
A-1 Radionuklid-Tabellen
Die folgenden Tabellen geben eine kompakte Übersicht zu den wichtigsten kennzeichnenden Parametern der therapeutisch eingesetzten Radionuklide (Strahlungsarten, -energien und Halbwertszeiten), zu eventuell vorhandenen Begleitnukliden sowie zu den beim Zerfall entstehenden Zerfallsnukliden. Für ergänzende Informationen zum Strahlenschutz beim Umgang mit diesen Nukliden sei unter anderem auf einschlägige Hinweise und Berichte des BfS beim Umgang mit Betastrahlern (BfS 2013), der SSK zu Berechnungsgrundlagen für die Ermittlung von Körper-Äquivalentdosen bei äußerer Strahlenexposition (SSK 2018) und auf das ‚Radionuclide and Radiation Protection Data Handbook‘ (Delacroix et al. 2002) verwiesen.
A-1.1 Yttrium-90
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | ||
|---|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Yttrium-90 | β¯ (100 %) | β¯: | 2280,1 keV (99,98 %) (90Y → 90Zr) |
64 h (2,7 d) | |
| β+: | (0,0032 %) | |||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
Keine 90Y-Therasphere: A: Yttrium-91 B: Yttrium-88 C: Chrom-51 |
A: β¯ (100 %)
B: EC β+ (100 %) C: EC (100 %) |
A: | β¯: | 1544,8 keV (100 %) (91Y → 91Zr) (stabil) |
A: 58,5 d |
| B: | γ: | 898,0 keV (93,7 %) | B: 106,7 d | |||
| γ: | 1836,1 keV (99,2 %) (88Y → 88Sr) (stabil) |
|||||
| C: | EC: | 752,7 keV (90,02 %) | C: 27,7 d | |||
| γ: | 320,1 keV (10 %) (51Cr → 51V) (stabil) |
|||||
| Zerfallsnuklide im Körper (A/B/C …) |
Zirkonium-90 (stabil) |
|||||
A-1.2 Iod-131
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Iod-131 | β¯ (100 %)
γ (100 %) |
β¯: | 606,3 keV (89,9 %) | 192,6 h (8,0 d) |
| β¯: | 333,8 keV (7,3 %) | ||||
| β¯: | 247,9 keV (2,1 %) | ||||
| γ: | 364 keV (81,7 %) | ||||
| γ: | 637 keV (7,2 %) | ||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
Keine | ||||
| Zerfallsnuklide im Körper (A/B/C …) |
A: Xenon-131 (stabil) B: Xenon-131m |
B: IT (100 %) | B: γ: | 163,9 keV (1,9 %) | B: 11,8 d |
| (131mXe → 131Xe) (stabil) | |||||
A-1.3 Samarium-153
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | ||
|---|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Samarium-153 | β¯ (100 %) | β¯: | 808,2 keV (17,5 %) | 46,3 h (1,9 d) | |
| β¯: | 705,0 keV (49,6 %) | |||||
| β¯: | 635,4 keV (32,2 %) | |||||
| γ: | 103,2 keV (30 %) | |||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
A: Europium-152
B: Europium-154 C: Europium-155 D: Europium-156 |
A: EC (72,1 %)
β+ (< 1 %) β¯ (27,9 %) B: β¯ (99,98 %) EC β+ (0,02 %) C: β¯ (100 %) D: β¯ (100 %) |
A: | EC: | 344,5 keV (24,9 %) | A: 13,5 a |
| EC | 640,5 keV (17,4 %) | B: 8,6 a | ||||
| EC | 788,4 keV (21,7 %) | C: 4,7 a | ||||
| β¯: | 695,6 keV (13,8 %) | D: 15,2 d | ||||
| B: | β¯: | 570,9 keV (36,3 %)
840,6 keV (16,8 %) 1845,3 keV (10 %) |
||||
| C: | β¯: | 146,8 keV (47 %) | ||||
| β¯ | 165,6 keV (25 %) | |||||
| β¯ | 192,1 keV (8,1 %) | |||||
| β¯ | 252,1 keV (17,6 %) (154Eu → 154Gd) (stabil) |
|||||
| D: | β¯ | 485,0 keV (29 %) | ||||
| β¯ | 2451,0 keV (32 %) | |||||
| β¯ | 264,2 keV (10,3 %) | |||||
| Zerfallsnuklide im Körper (A/B/C …) |
Europium-153 (stabil) |
|||||
A-1.4 Holmium-166
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Holmium-166 | β¯ (100 %) | β¯: | 1854,9 keV (50,0 %) | 26,8 h (1,1 d) |
| β¯: | 1774,3 keV (48,7 %) | ||||
| γ: | 80,6 keV (6,7 %) | ||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
Holmium-166m | β¯ (100 %) | β¯: | 1315,4 keV (3,0 %) | 4,38·105 d (1 200 a) |
| β¯: | 73,9 keV (76,4 %) | ||||
| β¯: | 33,3 keV (17,7 %) | ||||
| β¯: | 184,4 keV (72,6 %) 280,4 keV (29,7 %) |
||||
| Zerfallsnuklide im Körper (A/B/C …) |
Erbium-166 (stabil) |
||||
A-1.5 Erbium-169
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Erbium-169 | β¯ (92,5 %)
EC (7,5 %) |
β¯: | 351,1 keV (55,0 %) | 225,4 h (9,4 d) |
| β¯: | 342,69 keV (45,0 %) | ||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
Ytterbium-169 (1,4 %) |
EC (100 %) | β¯: | 592,8 keV (3,7 %) | 768,6 h (32,0 d) |
| β¯: | 529,7 keV (83,2 %) | ||||
| γ: | 307,7 keV (10,05 %) 198,0 keV (35,8 %) 130,5 keV (11,3 %) 109,8 keV (17,5 %) |
||||
| Zerfallsnuklide im Körper (A/B/C …) |
Thulium-169 (stabil) |
||||
A-1.6 Lutetium-177
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Lutetium-177 | β¯ (100 %) | β¯: | 498,3 keV (78,6 %) | 159,5 h (6,7 d) |
| γ: | 208,36 keV (11 %) 112,9 keV (6,4 %) |
||||
| Begleitnuklide im applizierten Präparat (Anteil %) Hinweis: entstehen nur bei Herstellung über folgenden Weg: |
Lutetium-177m (ca. 0,02 % bei nicht trägerfreiem 177Lu) |
β¯ (78,3 %)
IT (21,7 %) |
β¯: | 153,0 keV (61,3 %) | 160,4 d |
| γ: | 208,4 keV (57,7 %) 228,5 keV (37,0 %) 113,0 keV (20,4 %) 378,5 keV (29,7 %) 418 keV (21,3 %) |
||||
| Zerfallsnuklide im Körper (A/B/C …) |
Hafnium-177 (stabil) | ||||
A-1.7 Rhenium-186
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Rhenium-186 | β¯ (92,5 %)
EC (7,5 %) |
β¯: | 1069,5 keV (71,0 %) | 89,2 h (3,7 d) |
| β¯: | 932,3 keV (21,5 %) | ||||
| β¯: | 581,6 keV (5,8 %) | ||||
| γ: | 137,2 keV (9,42 %) | ||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
A: Rhenium-184
B: Rhenium-188 |
A: EC β+ (100 %)
B: Siehe |
EC: | 579,7 keV (76,1 %) 477,0 keV (17,6 %) 184Re → 184W (stabil) |
A: 38,2 d |
| B: | Siehe Tabelle A-1.8 | ||||
| Zerfallsnuklide im Körper (A/B/C …) |
A: Osmium-186 (nahezu stabil) B: Wolfram-186 |
A: 1015 a | |||
A-1.8 Rhenium-188
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Rhenium-188 | β¯ (100 %) | β¯: | 2120,4 keV (71,1 %) | 17,005 h (0,7 d) |
| β¯: | 1965,4 keV (25,6 %) | ||||
| γ: | 155,0 keV (15,1 %) | ||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
–14 | ||||
| Zerfallsnuklide im Körper (A/B/C …) |
A: Osmium-188 (stabil) |
||||
A-1.9 Radium-223
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | ||
|---|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Radium-223 | α (100 %) | α: | 5979,3 keV (100 %) 223Ra → 219Rn |
273,6 h (11,4 d) | |
| α: | 6946,1 keV (100 %) 219Rn → 215Po |
4,0 s | ||||
| α: | 7526,4 keV (100 %) 215Po → 211Pb |
1,8 ms | ||||
| α: | 6750,5 keV (99,7 %) 211Bi → 207Tl |
2,1 min | ||||
| β¯: | 1 423,0 keV (100 %) 207Tl → 207Pb |
4,8 min | ||||
| β¯: | 1 370,0 keV (100 %) 211Pb → 211Bi |
36,1 min | ||||
| γ: | 154 keV (5,6 %) | |||||
| γ: | 269 keV (13,7 %) | |||||
| Röntgen-Quanten 81,1 keV (15,2 %) 83,7 keV (25,6 %) |
||||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
A: Thorium-227
B: Actinium-227 |
A: α (100 %)
B: β¯ (98,6 %) B: α (1,4 %) |
A: | α: | 6446,4 keV (100 %) 227Th → 223Ra |
A: 449,28 h (18,7 d)
B: 21,7 a |
| B: | β¯: | 44,8 keV (98,6 %) 227Ac → 227Th |
||||
| β¯: | 44,8 keV (99,9 %) 223Fr → 223Ra |
|||||
| α: | 5042,2 keV (1,4 %) 227Ac → 223Fr |
|||||
| Zerfallsnuklide im Körper (A/B/C …) |
Blei-207 (stabil) | |||||
A-1.10 Actinium-225
| Angewandte(s) Nuklid(e) | Bezeichnung | Art der Strahlung (%α, %β, %γ) |
Wichtige Umwandlungs- energien (α, β, γ) |
Halbwertszeit(en) | |
|---|---|---|---|---|---|
| Zur Markierung bzw. pur verwendetes (Wirk-)Nuklid |
Actinium-225 | α (100 %) | α: | 5935,2 keV (100 %) 225Ac → 221Fr |
237,6 h (9,9 d) |
| α: | 6457,9 keV (100 %) 221Fr → 217At |
4,9 min | |||
| α: | 7201,9 keV (99,9 %) 217At → 213Bi |
32,3 ms | |||
| α: | 5982,0 keV (2,1 %) 213Bi → 209Tl |
45,6 min | |||
| α: | 8537,0 keV (100 %) 213Po → 209Pb |
4,3 µs | |||
| β¯: | 1427,0 keV (97,9 %) 213Bi → 213Po |
45,6 min | |||
| β¯: | 3982,0 keV (100 %) 209Tl → 209Pb |
2,2 min | |||
| β¯: | 644,2 keV (100 %) 209Pb → 209Bi |
3,3 h | |||
| γ: | 440 keV (25,9 %) → 213Bi 218 keV (11,4 %) → 221Fr |
||||
| Begleitnuklide im applizierten Präparat (Anteil %) |
–15 | ||||
| Zerfallsnuklide im Körper (A/B/C …) |
Bismut-209 (nahezu stabil) |
1,9·1019 a | |||
Alle Daten gemäß ,The Lund/LBNL Nuclear Data Search‘ (Table of Radioactive Isotopes)
(http://nucleardata.nuclear.lu.se/toi/).
Literatur
| BfS 2013 | Bundesamt für Strahlenschutz (BfS). Strahlenschutz beim Umgang mit Betastrahlern in der Nuklearmedizin. https://www.bfs.de/SharedDocs/Downloads/BfS/DE/broschueren/ion/fachinfo/strahlenschutz-umgang-mit-betastrahlern.pdf?__blob=publicationFile&v=8, zuletzt aufgerufen am 27.06.2021 |
| Delacroix et al. 2002 | Delacroix D, Guerre JP, Leblanc P, Hickman C. Radionuclide and radiation protection data handbook 2nd edition (2002). Radiat Prot Dosimetry. 2002;98(1):9-168, doi: 10.1093/oxfordjournals.rpd.a006705, Epub 2002/03/28 |
| SSK 2018 | Strahlenschutzkommission (SSK). Grundlagen zur Begründung von Grenzwerten für beruflich strahlenexponierte Personen. Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung, verabschiedet im Umlaufverfahren am 7. September 2018. Bekanntmachung im BAnz AT 14.11.2019 B5 |
A-2 Abkürzungen
| AMG | Arzneimittelgesetz |
| BfS | Bundesamt für Strahlenschutz |
| CT | Computertomografie |
| CUP | Cancer of unknown primary (unbekannter Primärtumor) |
| CXCR4 | CXC-Motiv-Chemokinrezeptor 4 |
| DGN | Deutsche Gesellschaft für Nuklearmedizin e. V. |
| DOTATATE | DOTA-(Tyr3)-octreotate |
| DOTATOC | DOTA(0)-Phe(1)-Tyr(3))octreotide, Edotreotid |
| DRG | Diagnosis Related Groups |
| DTC | Differentiated thyroid carcinoma (differenziertes Schilddrüsenkarzinom) |
| EANM | European Association of Nuclear Medicine (Europäische Vereinigung für Nuklearmedizin) |
| EBM | Einheitlicher Bewertungsmaßstab |
| ECOG | Eastern Cooperative Oncology Group |
| EDTMP | Ethylenediamine tetra(methylene phosphonic acid) (Ethylendiamintetra(methylphosphorsäure)) |
| FDG | Fluor-Desoxyglukose |
| GEP-NET | Gastro-Entero-Pankreatische Neuroendokrine Tumoren |
| GFR | Glomeruläre Filtrationsrate |
| HA-DOTATATE | DOTA-3-iodo-Tyr3-octreotate |
| HWZ | Halbwertszeit |
| LHRH | Luteinisierendes-Hormon-Releasing-Hormon |
| LSSt | Landessammelstelle |
| MAA | Markiertes makroaggregiertes Albumin |
| mCRPC | Metastatic castration-resistant prostate cancer (metastasiertes kastrationsresistentes Prostatakarzinom) |
| MD | Medizinischer Dienst der Krankenkassen |
| MDS | Myelodysplastisches Syndrom |
| MINEN | Mixed neuroendocrine non-neuroendocrine neoplasms |
| MRT | Magnetresonanztomografie |
| NANETS | North American Neuroendocrine Tumor Society |
| NET | Neuroendokriner Tumor |
| NSz | Nierenszintigraphie |
| NYHA | New York Health Association |
| PDTC | Poorly differentiated thyroid carcinoma (schlecht differenziertes Schilddrüsenkarzinom) |
| PET | Positronen-Emissions-Tomografie |
| PRRT | Peptid-Radio-Rezeptor-Therapy |
| PFS | progression-free survival (progressionsfreies Überleben) |
| PSMA | Prostata-spezifisches Membranantigen |
| PSMA-I&T | PSMA–Imaging & Therapie |
| RA | Rheumatoide Arthritis |
| RANKL | Receptor activator of nuclear factor-kappaB ligand |
| REILD | Radioembolization Induced Liver Disease |
| rhTSH | Recombinant human Thyreoidea-stimulierendes Hormon |
| RI | Radioiod |
| RIT | Radioiodtherapie |
| RJT | Radiojodtherapie |
| RLT | Radioligandentherapie |
| RSO | Radiosynoviorthese |
| SIR-spheres | Selektive Interne radio-spheres |
| SIRT | Selektive Interne Radiotherapie |
| SNMMI | Society of Nuclear Medicine and Molecular Imaging |
| SPECT | Single-Photon-Emissionscomputertomografie |
| StrlSchG | Strahlenschutzgesetz |
| StrlSchV | Strahlenschutzverordnung |
| TARE | transarterielle Radioembolisation |
| TSH | Thyreoidea-stimulierendes Hormon – Thyreotropin |
| Zevalin | Ibritumomab-Tiuxetan |
A-3 Glossar
| Abfall, radioaktiver | Radioaktive Stoffe, die beseitigt werden sollen oder aus Strahlenschutzgründen geordnet beseitigt werden müssen (Koelzer 2019http://dx.doi.org/10.5445/KSP/1000088491). |
| Aktivität | Aktivität ist die Zahl der pro Zeit in einer radioaktiven Substanz zerfallenden Atomkerne. Die Einheit für die Aktivität ist die reziproke Sekunde mit dem besonderen Einheitennamen Becquerel, Kurzzeichen: Bq. 1 Becquerel entspricht dem Zerfall eines Atomkerns pro Sekunde. Die früher übliche Einheit der Aktivität war Curie, Kurzzeichen: Ci. 1 Ci entspricht 3,7 · 1010 Bq.
Hinweis: „Aktivität“ benennt die physikalische Größe der Anzahl von Zerfällen pro Zeit, „Radioaktivität“ ist die Eigenschaft bestimmter Nuklide, sich umzuwandeln (nach: (Koelzer 2019)). |
| Becquerel | Becquerel (Bq) ist die SI-Einheit der Aktivität. Das Einheitenzeichen ist Bq.
Definition: 1 Bq = -1. Die alte Einheit der Aktivität ist das Curie (Ci). Für den Zusammenhang zwischen den Einheiten gilt: 1 Ci = 3,7∙1010 Bq. |
| CT | CT Computertomografie ist ein Verfahren, bei dem aus den Absorptionswerten von durch den Körper tretenden Röntgenstrahlen Schnittbilder berechnet werden. Durch Rekonstruktion einer Vielzahl aus verschiedenen Richtungen aufgenommenen Projektionsdaten eines Objektes werden digitale Querschnittsbilder des Körpers erzeugt. Durch schrittweise oder kontinuierliche Verschiebung des Körpers in Längsrichtung können dreidimensionale Bilddatensätze von Körperregionen erzeugt werden. Die CT ist das bildgebende Verfahren mit der höchsten kollektiven Strahlenexposition. |
| Dosimetrie | Als Dosimetrie bezeichnet man verschiedene Methoden, wie z. B. Mess- oder Berechnungsverfahren, Prozesse zur Bestimmung der durch ionisierende Strahlung erzeugten Dosis (Rühle et al. 2009). |
| Freigabe | Unter Freigabe versteht man den Verwaltungsakt, durch den geringfügig radioaktives Material sowie geringfügig radioaktive bewegliche Gegenstände, Gebäude, Bodenflächen, Anlagen oder Anlagenteile aus der atom- oder strahlenschutzrechtlichen Überwachung entlassen werden (BfS 2019). |
| Halbwertszeit, physikalische | Die Halbwertszeit tR eines Radionuklids R ist diejenige Zeitspanne, in der dessen Aktivität auf die Hälfte abnimmt. |
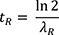 |
|
| Dabei ist λR die Zerfallskonstante des Radionuklids R. Nach Ablauf von drei Halbwertszeiten sind noch ca. 10 %, nach sieben Halbwertszeiten noch ca. 1 % und nach zehn Halbwertszeiten noch ca. 0,1 % einer Ausgangsaktivität vorhanden. Die Halbwertszeiten von Radionukliden reichen von weniger als 10-12 s bis zu mehr als 1012 a (Rühle et al. 2009). | |
| In-House-Herstellung | Als In-House-Herstellung von Radiopharmaka bezeichnet man die Herstellung von radioaktiven Arzneimitteln zur Anwendung innerhalb der eigenen Einrichtung. Diese kann z. B. in nuklearmedizinischen Abteilungen von Universitätskliniken, Forschungseinrichtungen, niedergelassenen Praxen etc. stattfinden. |
| Eigenherstellung | Synonym zu In-House-Herstellung. |
| Erlaubnisfreie Herstellung | Herstellung des Radiopharmakons durch den anwendenden Arzt oder unter seiner unmittelbaren fachlichen Verantwortung auf der Rechtsgrundlage des § 13 Absatz 2b des AMG. |
| Freigabe | Unter Freigabe versteht man den Verwaltungsakt, durch den geringfügig radioaktives Material sowie geringfügig radioaktive bewegliche Gegenstände, Gebäude, Bodenflächen, Anlagen oder Anlagenteile aus der atom- oder strahlenschutzrechtlichen Überwachung entlassen werden (BfS 2019). |
| Freimessen | Freimessen radioaktiver Klinikabfälle ist ein messtechnischer Nachweis für die behördliche Freigabe. Radioaktive Abfälle werden freigemessen, wenn ihre Radioaktivität so gering ist, dass sie den sonstigen Klinikabfällen zugerechnet und dann entsprechend behandelt bzw. deponiert werden können. Die Freimessung kann unter Umständen eine vorangegangene Zwischenlagerzeit erfordern, damit Abfälle mit kurzen Halbwertszeiten während der Zwischenlagerung – in diesem Fall auch Abklingzeit genannt – ihre Aktivität verlieren (nach (BfS n. d.)). |
| Nuklearmedizin | Das Gebiet Nuklearmedizin umfasst die Anwendung radioaktiver Substanzen, sonographischer und kernphysikalischer Verfahren zur Funktions- und Lokalisationsdiagnostik von Organen, Geweben und Systemen für die Erkennung und Verlaufsbeurteilung von Krankheiten sowie die Behandlung mit offenen Radionukliden sowie die Belange des Strahlenschutzes (Bundesärztekammer 2018). |
| Offene radioaktive Stoffe | Offene radioaktive Stoffe sind alle radioaktiven Stoffe mit Ausnahme der umschlossenen radioaktiven Stoffe (StrlSchG 2017). |
| Organ-Äquivalentdosis | Die Organ-Äquivalentdosis HT ist das Produkt aus der mittleren Energiedosis in einem Organ, Gewebe oder Körperteil und dem Strahlungs-Wichtungsfaktor wR nach ICRP. Die Werte des Strahlungs-Wichtungsfaktors wR nach ICRP richten sich nach Art und Qualität der Strahlung (Photonen, Elektronen, Neutronen, Protonen, Alpha-Teilchen). |
| PET(-Studie) | Positronen-Emissions-Tomografie (PET). Bildgebendes Verfahren der Nuklearmedizin, bei dem über die Verteilung schwach radioaktiver Substanzen biochemische und physiologische Funktionen abgebildet werden. Heute in der medizinischen Diagnostik fast ausschließlich als Kombination mit CT als PET/CT im Einsatz. |
| Radioaktiver Stoff | Radioaktive Stoffe (Kernbrennstoffe und sonstige radioaktive Stoffe) im Sinne dieses Gesetzes sind alle Stoffe, die ein Radionuklid oder mehrere Radionuklide enthalten und deren Aktivität oder spezifische Aktivität nach den Regelungen dieses Gesetzes oder einer auf Grund dieses Gesetzes von der Bundesregierung mit Zustimmung des Bundesrates erlassenen Rechtsverordnung nicht außer Acht gelassen werden kann (StrlSchG 2017, § 3 Absatz 1). |
| Radioligandentherapie | Ein Radioligand ist eine mit einem Radionuklid markierte Substanz, die als Ligand an ein Zielprotein, beispielsweise einen Rezeptor, der Zielzelle binden kann. Dies erlaubt in der Radioligandentherapie den gezielten Transport der Radioaktivität an den Zielort. |
| Radionuklid | Als Radionuklid bezeichnet man ein radioaktives Nuklid im Grundzustand oder metastabilen Zustand. Es wird durch die Angabe des Elementsymbols sowie der zugehörigen Massenzahl gekennzeichnet, z. B. 90Sr, 99mTc (Rühle et al. 2009). |
| Radionuklidtherapie | Therapie unter Anwendung von offenen Radionukliden. |
| Radiopharmakon | Radiopharmakon ist ein synonymer Begriff für „radioaktives Arzneimittel“ (von griech. pharmakon Droge, Arznei). Radioaktive Arzneimittel sind Arzneimittel, die radioaktive Stoffe sind oder enthalten und ionisierende Strahlen spontan aussenden und die dazu bestimmt sind, wegen dieser Eigenschaften angewendet zu werden.
Radiopharmaka sind von Gesetzes wegen Arzneimittel. In aller Regel haben sie keine pharmakologische Wirkung (nach (AMG 2005, § 4 Absatz 8 Satz 1)). |
| Radiopharmazie | Unter Radiopharmazie versteht man die Entwicklung, Herstellung und Qualitätsprüfung von Radiopharmaka. |
| Sievert | Das Sievert ist die SI-Einheit der Äquivalentdosis, der Organ-Äquivalentdosis und der effektiven Dosis. Das Einheitenzeichen ist Sv.
Definition: 1 Sv = 1 J kg-1. Die alte Einheit der Äquivalentdosis ist das Rem (rem). Für den Zusammenhang zwischen den Einheiten gilt: 1 Sv = 100 rem. Ebenso gilt für die Äquivalentdosisleistung: 1 Sv s-1 = 100 rem s-1 (nach: Rühle et al. 2009). |
| Sponsor (medizinische Forschung) |
Der Sponsor einer klinischen Studie ist eine natürliche oder juristische Person, die die Verantwortung für die Veranlassung, Organisation und die Finanzierung einer klinischen Prüfung bei Menschen übernimmt. Dies umfasst auch die strahlenschutzrechtlich korrekte Durchführung von Studien nach StrlSchG 2017 §§ 31 – 37. |
| Therapiezyklus | Eine nuklearmedizinische Therapie wird häufig in Intervallen, sogenannten Zyklen, durchgeführt, wobei Behandlungsphasen mit Behandlungspausen abwechseln. In einem Zyklus wird das Radiotherapeutikum verabreicht. Es schließt sich eine Behandlungspause von mehreren Tagen, Wochen oder Monaten an. In der Behandlungspause soll der Körper die Möglichkeit bekommen, angegriffenes normales Gewebe zu regenerieren, das sich meist schneller von einer nuklearmedizinischen Therapie erholen kann als Tumorgewebe (nach: Deutsche Krebsgesellschaft n.d.). |
| Theragnostik (auch: Theranostik, auch Radiotheranostik) |
Das Konzept der Theragnostik beruht darauf, dass ein spezifischer Mechanismus der Anreicherung eines Wirkstoffes/Radiopharmakons für die Diagnostik und Therapieauswahl sowie gleichermaßen auch für die Therapie selbst zur Anwendung kommt. Für den jeweiligen diagnostischen Test wird derselbe Bindungsmechanismus und gegebenenfalls Trägerstoff wie für die Therapie genutzt, teils aber mit jeweils anderer Radionuklid-Markierung. Vor der Gabe eines therapeutischen Radiopharmakons kann dabei die zu erwartende Verteilung und Anreicherung mittels des diagnostischen Verfahrens überprüft werden. |
| Tumor | Tumoren sind unkontrollierte Gewebeneubildungen und können in vielen Körpergeweben auftreten. Es gibt genetische Faktoren, die eine Tumorbildung begünstigen können. Die Wahrscheinlichkeit der Tumorentstehung kann durch ionisierende Strahlung erhöht sein. Im Falle einer Neoplasie (Neubildung von Körpergewebe) erfolgt die Einteilung nach dem biologischen Wachstumsverhalten und nach dem Ursprungsgewebe. In Abhängigkeit von der Fähigkeit Metastasen auszubilden, unterscheidet man zwischen benignen (gutartigen), malignen und semimalignen Tumoren. Maligne Tumoren werden häufig als Krebs bezeichnet. |
Referenzen zum Glossar
| AMG 2005 | Arzneimittelgesetz (AMG) in der Fassung der Bekanntmachung vom 12. Dezember 2005 (BGBl. I S. 3394), das zuletzt durch Artikel 3 des Gesetzes vom 27. September 2021 (BGBl. I S. 4530) geändert worden ist |
| BfS 2019 | Bundesamt für Strahlenschutz (BfS). Freigabe. Strahlenschutzstandpunkt. https://www.bfs.de/SharedDocs/Downloads/BfS/DE/broschueren/ion/freigabe.pdf, zuletzt aufgerufen am 25.10.2022 |
| BfS n.d. | Bundesamt für Strahlenschutz (BfS). Glossar. https://www.bfs.de/DE/service/glossar/glossar_node.html, zuletzt aufgerufen am 25.10.2022 |
| Bundesärztekammer 2018 | Bundesärztekammer. (Muster-)Weiterbildungsordnung 2018. |
| https://www.bundesaerztekammer.de/fileadmin/user_upload/BAEK/Themen/Aus-Fort-Weiterbildung/Weiterbildung/20220625_MWBO-2018.pdf, zuletzt aufgerufen am 25.10.2022 | |
| Deutsche Krebsgesellschaft n.d. |
Deutsche Krebsgesellschaft. ONKO-Internetportal. |
| https://www.krebsgesellschaft.de/onko-internetportal/onko-internetportal.html, zuletzt aufgerufen am 25.10.2022 | |
| Koelzer 2019 | Koelzer W. Lexikon zur Kernenergie. KIT Scientific Publishing, ISBN 978-3-7315-0881-6 |
| Rühle et al. 2009 | Rühle H, Kanisch H, Vogl K, Keller H, Bruchertseifer F, Schkade U-KW. Glossar zu den Messanleitungen für die Überwachung radioaktiver Stoffe in der Umwelt und externer StrahIung. https://www.bmuv.de/fileadmin/Daten_BMU/Download_PDF/Strahlenschutz/strlsch_messungen_glossar.pdf, zuletzt aufgerufen am 25.10.2022 |
| StrlSchG 2017 | Gesetz zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzgesetz – StrlSchG) vom 27. Juni 2017 (BGBl. I S. 1966), das zuletzt durch Artikel 11 des Gesetzes vom 12. Dezember 2019 (BGBl. I S. 2510) geändert worden ist |
- 1
- § 81 StrlSchG
- 2
- § 81 StrlSchG
- 3
- § 81 StrlSchG
- 4
- Annahme: Volles Vial: 6,6 MBq abzgl. 70 kg · 55 kBq kg-1
- 5
- § 80 Absatz 1 StrlSchG
- 6
- § 81 StrlSchG
- 7
- § 81 StrlSchG
- 8
- § 81 StrlSchG
- 9
- Chemische Bezeichnung: Cyclo(D-3-iodo-Tyr1-[NMe]-D-Orn2(AMBS-DOTA)-Arg3-2-Nal4-Gly5
- 10
- § 81 StrlSchG
- 11
- § 81 StrlSchG
- 12
- § 81 StrlSchG
- 13
- § 81 StrlSchG
- 14
- Eine Verunreinigung mit Wolfram-188 ist möglich, da Gewinnung aus dem 188W/188Re-Generator; entsprechende Angaben sind in der Literatur nicht verfügbar.
- 15
- Keine relevanten Angaben in Literatur; Thorium-229 möglich, aber bisher nicht nachgewiesen; siehe auch: Hesse L. Bestimmung der Radionuklidreinheit nuklearmedizinischer Präparate. [Masterarbeit]. Universität Dresden. 2020; Töchter im Gleichgewicht, da kurzlebig, Zeitpunkt bis zum Gleichgewicht: 221Fr → 21min; 213Bi → 201 min











Kommentar hinterlassen