Bundesinstitut
für Arzneimittel und Medizinprodukte
Bekanntmachung
einer Mitteilung
zum Homöopathischen Arzneibuch
(Empfehlungen der Fachausschüsse der
Deutschen Homöopathischen Arzneibuch-Kommission)
Auf Grund des § 7 Absatz 5 der Geschäftsordnung für die Deutsche Homöopathische Arzneibuch-Kommission und deren Gremien (Bekanntmachung vom 17. Juli 2009, BfArM-Homepage) sind Empfehlungen der Fachausschüsse der Deutschen Homöopathischen Arzneibuch-Kommission den betroffenen Fach- und Wirtschaftskreisen zur Kenntnis zu bringen.
Der Fachausschuss Analytik der Deutschen Homöopathischen Arzneibuch-Kommission hat die unten genannten Entwürfe für neue und revidierte Monographien für die Aufnahme in das Homöopathische Arzneibuch empfohlen. Sie werden hiermit zur Kenntnis gebracht (Anlage).
Neue Monographie
Equisetum arvense
Revidierte Monographien
- 1.
-
Croton tiglium
- 2.
-
Equisetum hiemale (Equisetum hyemale)
- 3.
-
Eutrochium purpureum (Eupatorium purpureum)
- 4.
-
Galphimia glauca (Thryallis glauca)
- 5.
-
Jacobea maritima (Senecio cineraria, Senecio bicolor, Cineraria maritima)
- 6.
-
Lytta vesicatoria (Cantharis)
- 7.
-
Packera aurea (Senecio aureus)
- 8.
-
Petasitis hybridus (Petasites)
- 9.
-
Symphytum officinale (Symphytum)
- 10.
-
Tussilago farfara (Farfara)
Neue Reagenzien
- 1.
-
Natriummethanolat-Lösung (0,1 mol · l–1) RH
- 2.
-
Phorbol-12-myristat-13-acetat RH
Revidiertes Reagenz
Cantharidin RH
Stellungnahmen zu dem oben genannten Entwurf des Homöopathischen Arzneibuches sind bis spätestens 28. Dezember 2023 einschließlich an die Geschäftsstelle der Arzneibuch-Kommissionen im Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, zu richten.
43.07-2023-
Bundesinstitut
für Arzneimittel und Medizinprodukte
In Vertretung
Knöß
Neue Monographien
Equisetum arvense
Verwendet werden die frischen, im Spätsommer gesammelten oberirdischen Pflanzenteile mit sterilen Sprossen von Equisetum arvense L.
Beschreibung
Die sterilen grünen, bäumchenförmigen Sommertriebe werden 10 bis 60 cm hoch; ihre zentrale Achse ist 1 bis 5 mm dick und deutlich 9-(seltener 6-) bis 13-(seltener 19-)rippig gefurcht. Sie endet in einer unverzweigten Sprossspitze, die die oberen Äste deutlich überragt. Beim Brechen des Hauptsprosses erscheint ein gelblichweißer Gewebestrang. Die Oberfläche der gesamten Pflanze ist rau. Die derben, aber mehr oder weniger schlaffen, scharf (seltener 3-) 4-kantigen, wirtelig angeordneten, sehr spärlich verzweigten Seitenäste sind wie die Hauptsprosse regelmäßig gegliedert. Jeder Spross trägt an den Knoten zu Scheiden verwachsene kleine Blätter (Mikrophylle), deren Anzahl der seiner Rippen entspricht. Auf den Rippen sind bereits mit der Lupe Kieselsäurehöcker zu erkennen, die an den Seitenästen in der Seitenansicht eine deutlich rechteckig-kantige Form aufweisen und dicht zusammenstehen. Die an den Spitzen schwarzbraun gefärbten und schmal weiß berandeten, lanzettlichen Zähne des Hauptsprosses sind etwa halb so lang wie der schwach bauchige, verwachsene Teil; an den Seitenästen sind die Zähne meist grün, an der Spitze häufig abstehend oder nach außen gebogen und lang zugespitzt, jedoch nicht grannig. Die untersten Scheiden der Seitenäste sind grün-gelblich bis hellbraun. Das unterste Internodium jedes Seitenastes ist mindestens so lang, in der Regel aber länger als die zugehörige Blattscheide des Hauptsprosses. Nur am Grund des Hauptsprosses ist es zuweilen etwas kürzer. Im Gegensatz zu den Seitenästen besitzt der Hauptspross Hohlräume.
Zur Abgrenzung von Equisetum palustre dürfen folgende morphologische Merkmale bei den Pflanzen nicht vorhanden sein:
Verwelkter Sporophyllstand an der Spitze des Hauptsprosses. Seitenäste 5-(bis 7-)kantig, unterste Astscheiden am Ansatz bräunlich bis schwarz. Zähne der Seitenäste bräunlich bis schwarz mit weißlich-transparentem Hautrand, anliegend und kurzdreieckig.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 2a
Eigenschaften
Die Urtinktur ist eine gelbgrüne bis braune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 2,5 mg Rutosid-Trihydrat R, 2,5 mg Hyperosid R und 1,0 mg Kaffeesäure R werden in 20 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ameisensäure R, Essigsäure 99 % R, Wasser R, Ethylacetat R (7,5:7,5:18:67 V/V/V/V)
Auftragen: 30 μl [oder 5 μl] Untersuchungslösung und 10 μl [oder 5 μl] Referenzlösung; bandförmig 20 mm [oder 8 mm]
Laufstrecke: 10 cm [oder 6 cm]
Trocknen: 5 min lang im Kaltluftstrom
Detektion: Die Platte wird 3 min lang bei 100 °C erhitzt und noch warm mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l–1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l–1) in Methanol R behandelt. Die Platte wird im Kaltluftstrom getrocknet. Die Auswertung erfolgt nach 10 Minuten im ultravioletten Licht bei 365 nm.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
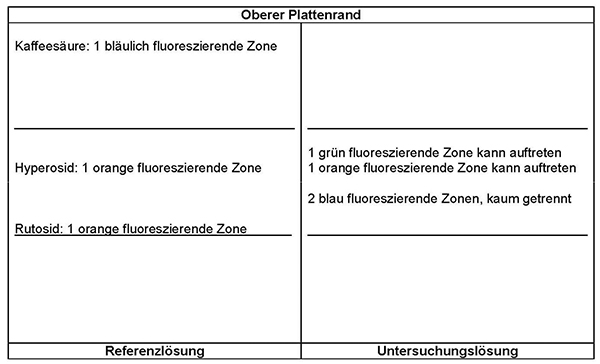
Prüfung auf Reinheit
Equisetum palustre: Dünnschichtchromatographie (2.2.27)
Untersuchungslösung:
5 g Urtinktur werden mit einer Lösung von 3 ml Schwefelsäure 0,5 mol · l–1 in 30 ml Wasser R versetzt, 10 min lang bei Raumtemperatur gerührt und anschließend durch Watte in einen 25-ml-Messzylinder filtriert.
19 ml Filtrat werden mit 1 ml konzentrierter Ammoniaklösung R alkalisiert und anschließend auf eine Chromatographiesäule von etwa 0,15 m Länge und etwa 30 mm innerem Durchmesser gegeben, die mit 15 g granulierter Kieselgur RH1 gefüllt ist.
Nach 15 min wird mit 40 ml Dichlormethan R in einen 50-ml-Rundkolben eluiert. Das Eluat wird unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Methanol R aufgenommen.
Referenzlösung: 5 mg Papaverinhydrochlorid R werden in 5 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254 R (2 bis 10 µm)
Fließmittel: Essigsäure 99 % R, Wasser R, 1-Butanol R (17:17:66 V/V/V)
Auftragen: 20 μl Untersuchungslösung und 10 μl Referenzlösung; bandförmig 10 mm
Laufstrecke: 6 cm
Detektion: Nach vollständigem Entfernen des Fließmittels im Warmluftstrom wird die Platte mit Dragendorffs Reagenz R besprüht und im Tageslicht ausgewertet.
Ergebnis: Im Chromatogramm der Untersuchungslösung darf keine orangefarbene Zone zwischen Auftragelinie und der Referenzsubstanz Papaverinhydrochlorid auftreten (Equisetum palustre).
Relative Dichte (2.2.5): 0,925 bis 0,950
Trockenrückstand (H 2.2.6): mindestens 1,2 Prozent
Lagerung
Vor Licht geschützt
Revidierte Monographien
Anmerkungen zur Monographie:
- –
-
Definitionen: Anpassung der Gehaltsspezifikationen für Droge und Urtinktur an die neue Gehaltsbestimmungsmethode mittels HPLC
- –
-
Prüfung auf Identität, DC-Methode: Ergänzung der HPTLC-Bedingungen
- –
-
Gehaltsbestimmung, Droge und Urtinktur: Ersatz der unspezifischen Gehaltsbestimmung durch eine spezifische Bestimmung auf Phorbolester
Croton tiglium
Verwendet werden die getrockneten reifen Samen von Croton tiglium L., die mindestens 3,5 Prozent Phorbolester, berechnet als Phorbol-12-myristat-13-acetat-Äquivalente, enthalten.
Beschreibung
Die Samen sind im Umriss eiförmig, beiderseits stumpf, einseitig etwas abgeplattet, 10 bis 13 mm lang und 6 bis 9 mm breit, matt rötlich braun oder mehr gelblich, stellenweise matt schwärzlich, unregelmäßig gesprenkelt oder auch im Ganzen dunkel. An den Flanken finden sich jederseits schwach hervortretende Kielbildungen, wodurch die Samen mehr oder weniger eckig erscheinen. An der abgeflachten Längsseite verläuft die Spur der Raphe als feiner Strang nach unten zum Hilum. Gegenüber, längs der stumpf-konvex vortretenden Rückseite, verläuft nicht immer deutlich im oberen Drittel eine feine Rippe, zu der sich zuweilen zwei seitliche gesellen. Im Schnittpunkt dieser Längslinien, am oberen, oft etwas dickeren Ende, ist, allerdings selten erhalten geblieben, eine kleine, helle Warzenbildung erkennbar. Die Innenseite der zerbrechlichen Samenschale zeigt eine glatte, silbergraue Haut, die oft auch auf dem Samenkern haften bleibt. Der Samenkern erscheint als gelblicher, stumpf vierkantiger Körper mit schwachem Glanz. Quer- und Längsschnitte lassen den Embryo in dem kräftig entwickelten Endosperm erkennen, dessen muldenförmige Hälften an den seitlichen Rändern lose zusammenhängen.
Mikroskopische Merkmale: Die äußere Schicht der Samenschale besteht aus kollabierten, tafelförmigen, von der Fläche gesehen polygonalen Zellen mit braunem Inhalt. Die Außenwände sind gleichmäßig verdickt. Darunter befindet sich eine kollabierte Schicht von vier bis fünf Reihen schwach ausgeprägtem Sternparenchymgewebe und eine Schicht rechteckiger, radial gestreckter, dünnwandiger, palisadenartiger Zellen, deren Wandungen kleinwellig gefaltet sind. Als vierte Schicht folgt eine Lage sehr langer, radial gestreckter, gekrümmter, stark verdickter, verholzter Palisadensklereiden mit braunem Inhalt. Die innerste Lage stellt ein kollabiertes Nährgewebe dar. Das Endosperm besteht aus polygonalen Zellen, die entweder Aleuronkörner oder Calciumoxalatdrusen enthalten.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 1 g pulverisierte Droge (710) wird mit 10 ml Ethanol 90 % R versetzt. Die Mischung wird 2 h lang gerührt und filtriert.
Referenzlösung: 10 mg Cholesterol R, 10 µl Cineol R und 10 mg Anethol R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)].
Fließmittel: Ethylacetat R, Toluol R (15:85 V/V)
Auftragen: 10 µl [oder 3 μl]; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 15 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt.
Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich.
Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
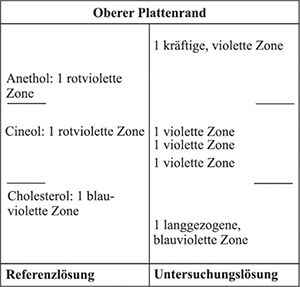
Prüfung auf Reinheit
Fremde Bestandteile (2.8.2): höchstens 1,0 Prozent
Asche (2.4.16): höchstens 3,0 Prozent
Gehaltsbestimmung
Flüssigchromatographie (2.2.29)
Untersuchungslösung:
1,000 g pulverisierte Droge (710) werden mit 50,0 ml Methanol R versetzt und 30 min unter Rückflusskühlung im siedenden Wasserbad erhitzt.
Nach dem Abkühlen wird die Mischung zentrifugiert. 1,0 ml der überstehenden Lösung wird in einem Spitzkolben unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 1800 μl Natriummethanolat-Lösung (0,1 mol · l–1) RH aufgenommen und 3 h lang im Wasserbad bei 45 °C inkubiert. Dabei muss der Spitzkolben fast vollständig ins Wasserbad eintauchen. Nach Zugabe von 200 μl einer Lösung von Essigsäure 99 % R in Methanol R (60 g · l–1) wird die Mischung nach dem Erkalten über ein Membranfilter (regenerierte Cellulose 0,45 μm) filtriert.
Referenzlösungen:
Stammlösung: 10,00 mg Phorbol-12-myristat-13-acetat RH werden in Methanol R zu 50,0 ml gelöst.
Jeweils 1,0 ml, 2,0 ml, 3,0 ml, 4,0 ml und 5,0 ml der Stammlösung werden in einem Spitzkolben unter vermindertem Druck zur Trockne eingedampft. Die Rückstände werden jeweils in 1800 μl Natriummethanolat-Lösung (0,1 mol · l–1) RH aufgenommen und 3 h lang im Wasserbad bei 45 °C inkubiert. Dabei muss der Spitzkolben fast vollständig ins Wasserbad eintauchen. Nach Zugabe von 200 μl einer Lösung von Essigsäure 99 % R in Methanol R (60 g · l–1) wird die Mischung nach dem Erkalten über ein Membranfilter (regenerierte Cellulose 0,45 μm) filtriert.
Säule
- –
-
Größe: l = 0,10 m, Ø = 4,6 mm
- –
-
Stationäre Phase:octadecylsilyliertes, nachsilanisiertes Kieselgel zur Chromatographie R mit festem Kern R (2,6 μm)2
- –
-
Temperatur: 25 °C
Mobile Phase
- –
-
Mobile Phase A: Wasser zur Chromatographie R
- –
-
Mobile Phase B: Acetonitril zur Chromatographie R
| Zeit (min) |
Mobile Phase A (% V/V) |
Mobile Phase B (% V/V) |
|---|---|---|
| 0 – 2 | 95 | 5 |
| 2 – 17 | 95 → 60 | 5 → 40 |
| 17 – 18 | 60 → 0 | 40 → 100 |
| 18 – 25 | 0 | 100 |
| 25 – 26 | 0 → 95 | 100 → 5 |
| 26 – 33 | 95 | 5 |
Durchflussrate: 1,0 ml · min–1
Detektion: Spektrometer bei 254 nm
Einspritzen: 10 μl
Bereich der relativen Retention (bezogen auf den Hauptpeak im Chromatogramm der Referenzlösung, tR etwa 9 min): etwa 0,9 bis 1,4
Eine Kalibriergerade wird erstellt, indem die Summe der Peakflächen der jeweiligen Referenzlösungen im Bereich der relativen Retention (bezogen auf den Hauptpeak im Chromatogramm der Referenzlösung, tR etwa 9 min) von etwa 0,9 bis 1,4 bestimmt und gegen die entsprechenden Konzentrationen aufgetragen werden.
Der Prozentgehalt an Phorbolestern als Phorbol-12-myristat-13-acetat-Äquivalente wird mit Hilfe der Kalibriergeraden berechnet, indem die Summe der Peakflächen im Bereich der relativen Retention (bezogen auf den Hauptpeak im Chromatogramm der Referenzlösung, tR etwa 9 min) von etwa 0,9 bis 1,4 im Chromatogramm der Untersuchungslösung bestimmt wird.
Eignungsprüfung:
Korrelationskoeffizient der Kalibriergeraden: mindestens 0,99
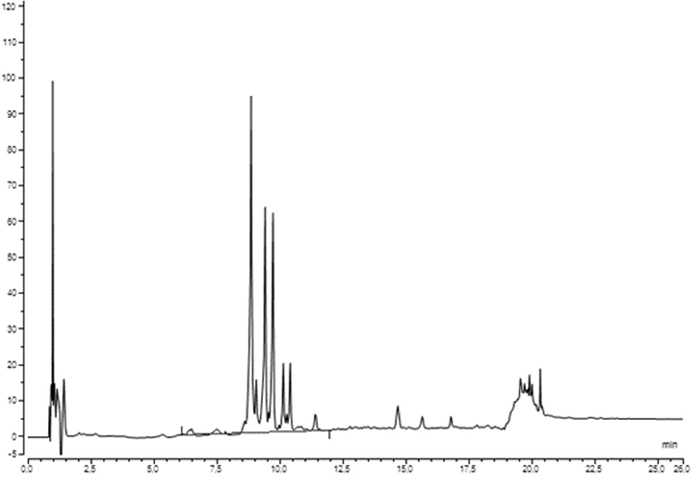
Beispielchromatogramm: für Droge und Urtinktur von Croton tiglium
Arzneiformen
Die Urtinktur enthält mindestens 0,20 Prozent und höchstens 0,75 Prozent Phorbolester, berechnet als Phorbol-12-myristat-13-acetat-Äquivalente.
Herstellung
Urtinktur aus der pulverisierten Droge (710) durch Mazeration und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 86 % (m/m)
Eigenschaften
Die Urtinktur ist eine gelbe Flüssigkeit.
Prüfung auf Identität
Die Prüfung erfolgt wie unter „Prüfung auf Identität“ bei der Droge angegeben. Untersuchungslösung ist die Urtinktur.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
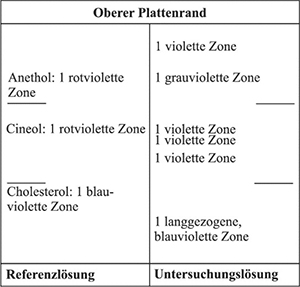
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,830 bis 0,845
Trockenrückstand (H 2.2.6): mindestens 1,0 Prozent
Gehaltsbestimmung
Die Gehaltsbestimmung erfolgt wie bei der Droge beschrieben mit folgender Untersuchungslösung: 0,200 g Urtinktur werden in einem Spitzkolben unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird wie unter „Gehaltsbestimmung“ bei der Droge beschrieben weiterbehandelt.
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Aufnahme einer Reinheitsprüfung auf Equisetum palustre analog zur HAB-Monographie „Equisetum arvense“, da hier ebenfalls die Gefahr einer Verwechslung mit Equisetum palustre besteht.
Equisetum hiemale
Equisetum hyemale
Verwendet werden die im Sommer gesammelten frischen ganzen Pflanzen von Equisetum hiemale L.
Beschreibung
Der aufrechte, sehr raue, unverzweigte, bis 1,50 m hohe Spross ist meist dunkelgrün, seltener etwas graugrün und hat einen Durchmesser von 4 bis 10 mm. Er setzt sich aus 3 bis 9 cm langen, flach gerippten Stängelgliedern zusammen, an deren Knoten Blätter sitzen, die zu einer stängelumfassenden, enganliegenden, walzenförmigen Scheide zusammengewachsen sind. Am Grunde und am Saum trägt sie eine schwarze Querbänderung. Die Spitzen der Blätter sind in jungem Stadium zu zugespitzten, weiß berandeten Zähnen ausgezogen, fallen jedoch schon frühzeitig ab, so dass nur noch ein stumpfer, gekerbter Rand sichtbar ist. Der spitzkegelförmige, dunkelgraue Sporangienstand sitzt auf dem obersten, sehr kurzen Stängelglied und wird am Grunde von der obersten, glockenförmigen Scheide umschlossen.
Die unterirdischen Sprossteile entsprechen in ihrem morphologischen Aufbau den oberirdischen Sprossen, sind jedoch von schwarzbrauner Farbe und haben eine etwas kleinere Zentralhöhle. Die nur undeutlich rinnig erscheinenden, 2 bis 5 mm dicken Sprossachsen tragen an den Knoten 2 bis 4 mm hohe enganliegende, schwarzbraune Blattscheiden, an deren Basis gebüschelt feine, faserförmige, verzweigte Wurzeln entspringen. An der gleichen Stelle entspringen im unteren Bereich gelegentlich, in Nähe des Übergangs zu den oberirdischen Sprossachsen gehäuft, Seitenachsen. Die Internodien sind zum Teil in diesem Bereich sehr kurz, unregelmäßig knotig und mit Knospen neuer Seitenachsen besetzt.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 2a.
Eigenschaften
Die Urtinktur ist eine gelbbraun bis grünbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 2,5 mg Rutosid-Trihydrat R, 2,5 mg Hyperosid R und 1,0 mg Kaffeesäure R werden in 20 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ameisensäure R, Essigsäure 99 % R, Wasser R, Ethylacetat R (7,5:7,5:18:67 V/V/V/V)
Auftragen: 20 μl [oder 5 μl] Untersuchungslösung und 5 μl [oder 5 μl] Referenzlösung; bandförmig 20 mm [oder 8 mm]
Laufstrecke: 10 cm [oder 6 cm]
Trocknen: 5 min lang im Kaltluftstrom
Detektion: Die Platte wird 3 min lang bei 100 °C erhitzt und noch warm mit einer Lösung von Diphenylboryloxylethylamin R (10 g · l–1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l–1) in Methanol R behandelt. Die Platte wird im Kaltluftstrom getrocknet. Die Auswertung erfolgt nach 10 min im ultravioletten Licht bei 365 nm.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
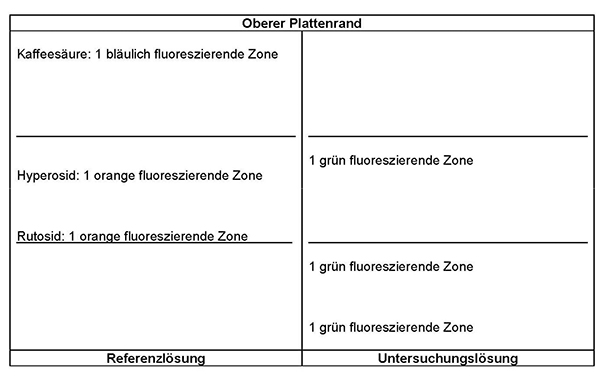
Prüfung auf Reinheit:
Equisetum-arvense:
Im Chromatogramm der Untersuchungslösung (siehe Prüfung auf Identität) darf im mittleren Drittel keine orange fluoreszierende Zone vorhanden sein.
Equisetum palustre: Dünnschichtchromatographie (2.2.27)
Untersuchungslösung:
5 g Urtinktur werden mit einer Lösung von 3 ml Schwefelsäure 0,5 mol · l–1 in 30 ml Wasser R versetzt, 10 min lang bei Raumtemperatur gerührt und anschließend durch Watte in einen 25-ml-Messzylinder filtriert.
19 ml Filtrat werden mit 1 ml konzentrierter Ammoniaklösung R alkalisiert und anschließend auf eine Chromatographiesäule von etwa 0,15 m Länge und etwa 30 mm innerem Durchmesser gegeben, die mit 15 g granulierter Kieselgur RH3 gefüllt ist.
Nach 15 min wird mit 40 ml Dichlormethan R in einen 50-ml-Rundkolben eluiert. Das Eluat wird unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Methanol R aufgenommen.
Referenzlösung: 5 mg Papaverinhydrochlorid R werden in 5 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254R (2 bis 10 µm)
Fließmittel: Essigsäure 99 % R, Wasser R, 1-Butanol R (17:17:66 V/V/V)
Auftragen: 20 μl Untersuchungslösung und 10 μl Referenzlösung; bandförmig 10 mm
Laufstrecke: 6 cm
Detektion: Nach vollständigem Entfernen des Fließmittels im Warmluftstrom wird die Platte mit Dragendorffs Reagenz R besprüht und im Tageslicht ausgewertet.
Ergebnis: Im Chromatogramm der Untersuchungslösung darf keine orangefarbene Zone zwischen Auftragelinie und der Referenzsubstanz Papaverinhydrochlorid auftreten (Equisetum palustre).
Relative Dichte (2.2.5): 0,930 bis 0,950
Trockenrückstand (H 2.2.6): mindestens 1,6 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Textpassage zu den Pyrrolizidinalkaloiden entsprach nicht mehr den aktuell geltenden Anforderungen4, 5 und ist deshalb überarbeitet worden.
In diesem Zuge sind auch formale Änderungen vorgenommen worden, wie die Streichung des nicht charakteristischen Geruchs (bei Droge und Urtinktur) und der Bezug auf Ph. Eur. 2.2.27 bei der DC-Methode.
Weiterhin erfolgte eine Anpassung des wissenschaftlichen Pflanzennamens an den aktuell gültigen Namen gemäß der Datenbank „Medicinal Plant Names Services“ (MPNS) im Monographie-Titel und bei der Definition.
Es sind jedoch noch weitere Aktualisierungen der Monographie erforderlich, wie zum Beispiel die Ergänzung der HPTLC-Bedingungen und der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten. Diese werden vorgenommen, sobald die vollständige Überprüfung der Monographie abgeschlossen ist.
Eutrochium purpureum
Eupatorium purpureum
Verwendet werden die frischen unterirdischen Teile von Eutrochium purpureum (L.) E.E.Lamont nach dem Abblühen.
Eutrochium purpureum kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an Kapitel 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)5. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die 10 bis 15 mm dicken, harten, in der Regel horizontal wachsenden, wenige Zentimeter langen, knolligen Wurzelstöcke tragen an der Oberseite kurze Reste der Sprossachsen und die 1 bis 3 mm dicken, rotbraunen Knospen der nächstjährigen Triebe. Der Wurzelstock ist rundherum, gehäuft auf der Unterseite, dicht mit zahlreichen 1 bis 2 mm, selten 3 mm dicken, bis 500 mm langen, absteigenden Wurzeln besetzt; die Wurzeln sind hellbraun bis hellgraubraun, die feinen Seitenwurzeln schmutzig-weißlich.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine goldgelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 10 mg Menthol R, 25 µl (+)-Carvon R und 10 mg Anethol R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Ethylacetat R, Toluol R (7:93 V/V)
Auftragen: 50 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die violette Zone des Menthols, im mittleren Drittel die rote Zone des (+)-Carvons und am Übergang vom mittleren zum oberen Drittel die violette Zone des Anethols.
Das Chromatogramm der Untersuchungslösung zeigt zwischen Start und der Referenzsubstanz Menthol zwei oder drei violette Zonen, knapp oberhalb der Referenzsubstanz Menthol eine violette Zone, zwischen den Referenzsubstanzen Menthol und (+)-Carvon nicht immer deutlich getrennt eine blaugrüne und eine violette Zone sowie zwischen den Referenzsubstanzen (+)-Carvon und Anethol eine grünliche und eine violette Zone.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,890 bis 0,910
Trockenrückstand (H 2.2.6): mindestens 1,8 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Definition: Der wissenschaftliche Pflanzenname wird auf den aktuell gültigen Namen gemäß der Datenbank „Medicinal Plant Names Services“ (MPNS) geändert und die Monographie-Titel werden entsprechend angepasst.
- –
-
Korrektur bei der botanischen Beschreibung basierend auf aktuell vorliegenden Drogenmustern
Galphimia glauca
Thryallis glauca
Verwendet werden die getrockneten Blätter und Blütenstände von Galphimia glauca Cav.
Beschreibung
Die Droge hat einen schwach süßlich-würzigen Geruch.
Die Laubblätter besitzen einen 4 bis 12 mm langen, oberseits rinnigen, selten noch schwach flaumig dunkelrot behaarten Stiel. Ihre Spreite ist eiförmig oder länglich eiförmig, am Grund stumpf oder abgerundet, am Scheitel stumpf oder häufig bespitzt, bis 60 mm lang und 30 mm breit, oberseits in der Regel grünlich grau, runzelig bis glatt, kahl, unterseits heller, rau erscheinend, mit deutlich hervortretendem, weißlichem Mittelnerv und schwächeren Seitennerven. Der Rand ist etwas verdickt, glatt und insbesondere im unteren Teil nach unten umgebogen. Am Grund der Spreite oder etwas darüber befindet sich seitlich je eine etwa 0,5 mm lang gestielte, bis 1 mm breite, flachtrichterförmige, bräunlich bis schwarz erscheinende Drüse.
Die zusammengesetzt traubigen Blütenstände sind bis 120 mm lang und enthalten 10 bis 30 schwach zygomorphe, goldgelbe bis gelbbraune Blüten. Die Achsenteile sind dunkelrot behaart oder kahl. Die in der Achsel eines lineal-lanzettlichen bis linealen, häufig rotbraunen Tragblattes stehenden, 6 bis 11 mm langen Blütenstiele tragen etwas oberhalb des Grunds bis unterhalb der Mitte zwei lineal-lanzettliche, rötlich braune, 1 bis 4 mm lange Vorblättchen. Die bis 23 mm breiten Blüten sind häufig flach ausgebreitet. Der Kelch besteht aus fünf verkehrt-eiförmigen bis länglich-ovalen, grünen und am Rand etwas Helleren oder ins Rotbraun bis Rotviolett übergehenden, 3 bis 4 mm langen Blättern mit schwach zurückgebogener Spitze. Die fünf verschieden großen Kronblätter sind aus stumpfem Grund fast herzförmig oder aus etwas verschmälertem Grund eiförmig, unterseits gekielt, am Rand sehr fein gefranst, bis 9 mm lang und 4 bis 5 mm breit. Der 1,5 bis 2 mm lange Nagel ist häufig zumindest an der Innenseite rötlich überlaufen, ebenso gelegentlich der untere Teil der Kronblätter. Die Filamente der zehn Staubblätter sind gelbbraun bis rötlich braun gefärbt. Der dreiteilige Fruchtknoten ist oberständig, abgeflacht kugelig, am Rücken der von je einem Griffel gekrönten Teile deutlich gekielt, dunkelgrün bis grünlich, an den Kielen bisweilen rötlich violett.
Schnittdroge: Sie besteht aus den zusammengefalteten oder geschrumpften, oberseits dunkler grün bis braungrün und rau erscheinenden, unterseits helleren, matten Fragmenten der Laubblätter mit unterseits deutlich hervortretenden Nerven und zahlreichen Blüten oder ihren Fragmenten:
Auf einem wenige Millimeter langen Stiel stehen Blüten mit fünfzähligem, nur an der Basis verwachsenem Kelch mit verkehrt-eirunden bis länglich-ovalen Kelchblättern und der aus fünf kurzgenagelten, bis 10 mm langen, blassgelben bis bräunlichen, glattrandigen oder am Rand feingefransten Kronblättern mit deutlichem Mittelnerv bestehenden Korolle. Fragmente der Kronblätter sind zahlreich. Die Filamente der Staubblätter sind gelbbraun bis rötlich braun. Die mehr oder weniger weit entwickelte, dreiteilige, oberständige, noch vom Kelch umgebene Frucht ist abgeflacht kugelig, am Rücken gekielt und enthält in jedem Fruchtfach in der Regel nur einen bis 2,5 mm großen, fast kugeligen, schräg zugespitzten, glänzenden, hellbraunen Samen. Die dünneren Stängelstücke sind in der Regel hellgrün, rundlich, fein längsgestreift und matt.
Mikroskopische Merkmale: Die Epidermiszellen der Laubblattoberseite sind in Aufsicht unregelmäßig, in der Regel drei- bis viereckig, mit schwachwelligen, getüpfelten Wänden und verdickter Außenwand. Das einreihige, die Hälfte bis zwei Drittel des Mesophylls einnehmende Palisadenparenchym besteht aus schmalen, dicht stehenden Zellen, das Schwammparenchym aus wenigen Lagen rundlicher bis flacher, wenigarmiger locker angeordneter Zellen. Die in Aufsicht wellig- bis eckig-buchtigen Epidermiszellen der Unterseite sind flach oder teils einzeln, teils zu zwei oder drei miteinander verwachsen und zu verschieden hohen, an der Außenseite dickwandigen Papillen ausgewölbt. Die von vier bis sechs Nebenzellen umgebenen Spaltöffnungen sind paracytisch. Die in Aufsicht oberseits in der Regel axial gestreckten, polygonalen, geradwandigen, unterseits mehr welligen Epidermiszellen der Kelchblätter tragen beiderseits eine fein längsgestreifte Kutikula. Im Mesophyll der Kelchblätter liegen zahlreiche, häufig in axialen Reihen angeordnete Zellen mit bis 25 µm selten bis 40 µm großen, feinspitzigen Calciumoxalatdrusen mit dunklem Zentrum. Die Epidermiszellen der Kronblätter sind in Aufsicht oberseits fast isodiametrisch bis etwas axial gestreckt, papillös, unterseits mehr axial gestreckt und kaum papillös und beiderseits mit feinwellig gestreifter Kutikula bedeckt. Das Endothecium der Staubblätter hat bügelförmige Wandverdickungen. Die Pollen sind kugelig bis breit ellipsoidisch, 14 bis 18 µm groß, mit glatter Exine und drei Keimporen. Auf den Blütenstandsachsen und gelegentlich auch auf den Kelchblättern kommen einzellige, T-förmige, mehr oder weniger rötlich braune, glatte, beidendig stumpf-spitzige bis breit abgerundete, bis 500 µm lange und 48 µm breite Haare mit in der Regel exzentrischer Stielansatzstelle vor.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 1 g pulverisierte Droge (710) wird mit 10 ml Ethanol 70 % R versetzt, die Mischung 2 h lang gerührt und anschließend filtriert.
Referenzlösung: 5 mg Hyperosid R und 5 mg Kaffeesäure R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 µm) [oder DC-Platte mit Kieselgel R (2 bis 10 µm)]
Fließmittel: Ameisensäure R, Wasser R, Ethylacetat R (10:10:80 V/V/V)
Auftragen: 10 µl [oder 3 µl]; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 15 cm [oder 6 cm]
Detektion: Die Platte wird 10 min lang bei 105 bis 110 °C getrocknet, nach dem Erkalten mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l−1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l−1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 min im ultravioletten Licht bei 365 nm.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.

Prüfung auf Reinheit
Fremde Bestandteile (2.8.2): höchstens 10 Prozent Stängelanteile mit einem Durchmesser von mehr als 1,0 mm und höchstens 2 Prozent andere fremde Bestandteile
Asche (2.4.16): höchstens 9,0 Prozent
Arzneiformen
Herstellung
Urtinktur aus der pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine gelbbraune Flüssigkeit.
Prüfung auf Identität
Die Urtinktur gibt die Identitätsreaktion der Droge.
Untersuchungslösung: die Urtinktur
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.

Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,895 bis 0,915
Trockenrückstand (H 2.2.6): mindestens 2,5 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Textpassage zu den Pyrrolizidinalkaloiden entsprach nicht mehr den aktuell geltenden Anforderungen4, 5 und ist deshalb überarbeitet worden.
In diesem Zuge sind auch formale Änderungen vorgenommen worden, wie der Bezug auf Ph. Eur. 2.2.27 bei der DC-Methode.
Weiterhin erfolgte eine Anpassung des wissenschaftlichen Pflanzennamens an den aktuell gültigen Namen gemäß der Datenbank „Medicinal Plant Names Services“ (MPNS) im Monographie-Titel und bei der Definition.
Es sind jedoch noch weitere Aktualisierungen der Monographie erforderlich, wie zum Beispiel die Ergänzung der HPTLC-Bedingungen. Diese werden vorgenommen, sobald die vollständige Überprüfung der Monographie abgeschlossen ist.
Jacobaea maritima
Senecio cineraria, Senecio bicolor, Cineraria maritima
Verwendet wird die frische, ganze Pflanze von Jacobaea maritima (L.) Pelser & Meijden; sie wird unmittelbar vor der Blütezeit geerntet.
Jacobaea maritima kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an Kapitel 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)5. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Wurzel ist büschelförmig, sehr stark verzweigt, faserig und von hellbrauner Farbe.
Die bis 8 cm hohen Stängel der staudigen bis halbstrauchigen Pflanze sind aufrecht und am Grund stark, oberwärts spärlich verzweigt. Die Sprossachsen sind schneeweiß-filzig behaart.
Die 40 bis 150 mm langen und 25 bis 70 mm breiten, gestielten Laubblätter stehen an den Blüten tragenden Stängeln nahe der Basis gehäuft und an den nicht blühenden fast rosettig. Die unteren Laubblätter sind schief-trapezförmig, mehr oder weniger ganzrandig, die wechselständigen mittleren und oberen fiederspaltig mit vier bis sechs länglichen, stumpfen, fast dreilappigen Abschnitten, deren obere oft zusammenfließen. Junge Blätter sind beiderseits grauweiß-filzig, ältere oberseits spinnwebig behaart, seltener fast kahl und nur unterseits schneeweiß-filzig.
Die zahlreichen, doldenrispig angeordneten Blütenköpfchen haben einen Durchmesser von 12 bis 15 mm. Sie werden von einem einreihigen Hüllkelch aus 5 bis 8 mm langen Hüllblättern umgeben, der am Grund bis zu fünf 1 bis 2 mm große Hochblätter trägt. Auf einem flachen, spreublattlosen Blütenstandsboden stehen zehn bis zwölf gelbe Zungenblüten mit einer 10 bis 13 mm langen und 3 bis 6 mm breiten, meist zurückgebogenen Zunge und zahlreiche scheibenständige, gelbe Röhrenblüten.
Die gestreiften Früchte tragen einen einreihigen Pappus, der ungefähr so lang ist wie die Scheibenblüten.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 2a
Eigenschaften
Die Urtinktur ist eine gelbbraune Flüssigkeit mit charakteristischem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 5 ml Urtinktur werden unter vermindertem Druck bis zur Hälfte eingeengt und mit 1 ml gesättigter Natriumchlorid-Lösung R versetzt. Die Mischung wird 2-mal mit je 5 ml Ethylacetat R ausgeschüttelt. Die vereinigten organischen Phasen werden zur Trockne eingedampft. Der Rückstand wird mit 0,5 ml Ethylacetat R aufgenommen.
Referenzlösung: 50 mg Brenzcatechin R, 10 mg Borneol R und 10 mg Bornylacetat R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254 R
Fließmittel: Methanol R, Ethylacetat R, Toluol R (5:20:75 V/V/V)
Auftragen: 20 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 365 nm ausgewertet.
Ergebnis A: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.

Detektion B: Die Platte wird mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
Ergebnis B: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
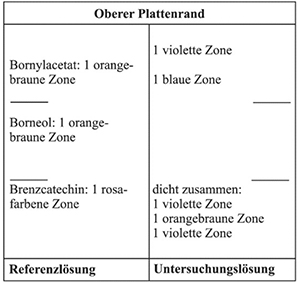
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,930 bis 0,950
Trockenrückstand (H 2.2.6): mindestens 2,0 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Droge, Definition: Änderung der systematischen Bezeichnung von Cantharidin auf den IUPAC-Namen
- –
-
Droge, Prüfung auf Identität, DC-Methode: Ergänzung der HPTLC-Bedingungen
- –
-
Droge, Prüfung auf Reinheit „Fremde Bestandteile“: Streichung der Prüfung auf Abwesenheit von fremden Käfern, da dies ohne vertretbaren Aufwand nicht möglich ist. Die Einhaltung der Spezifikation für „Fremde Bestandteile“ von höchstens 1,0 Prozent, die auch fremde Käfer einschließt, ist ausreichend. Verwechslungen mit anderen Cantharidin-haltigen Käfern können zudem an der Urtinktur über die Reinheitsprüfung auf Mylabris-Arten ausgeschlossen werden.
- –
-
Droge, Gehaltsbestimmung: Optimierung der GC-Methode und Aufnahme des Hinweises, dass für die Herstellung der Untersuchungslösung die Zerkleinerung der Tiere unter Vermeidung von Wärmeentwicklung durchzuführen ist.(Es wird keine Gehaltsbestimmung an der Urtinktur aufgenommen, da dort kein Cantharidin nachgewiesen werden konnte).
- –
-
Urtinktur, Eigenschaften: Aufnahme des unangenehm durchdringenden Geruchs wie bei der Droge
- –
-
Urtinktur, Prüfung auf Reinheit: Änderung der Obergrenze des Trockenrückstands aufgrund der vorliegenden Chargendaten auf 3,0 %
Lytta vesicatoria
Cantharis
Verwendet werden die getöteten, bei höchstens 40 °C getrockneten, möglichst wenig beschädigten Spanischen Fliegen (Lytta vesicatoria L.), die mindestens 0,15 und höchstens 0,8 Prozent Cantharidin (1S,2R,6S,7R)-2,6-Dimethyl-4,10-dioxatricyclo[5.2.1.02,6]decan-3,5-dion, C10H12O4;Mr 196,20) enthalten.
Beschreibung
Die Tiere haben einen unangenehmen, durchdringenden Geruch.
Die 15 bis 30 mm langen und 4 bis 8 mm breiten Käfer erscheinen durch Interferenzfärbung metallisch smaragdgrün glänzend. Der etwa 3 mm breite, im Umriss herzförmige, nach unten geneigte Kopf mit tiefer Scheitelfurche trägt zwei hervortretende Facettenaugen, zwei fadenförmige, 4 bis 6 mm lange, schwarze, elfgliedrige Fühler und zwei viergliedrige Taster. Zwischen Kopf und Halsschild ist eine halsartige Verbindung erkennbar. Der Halsschild ist von den Vorwinkeln nach hinten verengt und oben mit seichter Mittelfurche versehen; die Vorderwinkel treten als eckige Beulen stark hervor. Zwischen Halsschild und Flügeldecken liegt ein kleines stumpf-dreieckiges Schildchen. Die Flügeldecken sind schmal, dünn, weich, etwas gewölbt, hinten abgerundet, oberseits smaragdgrün mit zwei feinen Längsrippen und unterseits braun. Sie bedecken den Thorax und den Hinterleib fast vollständig. Die Flugflügel sind durchscheinend, häutig, geadert und braun. Der Hinterleib ist schlank, achtgliedrig und weich. Die sechs langen Beine und der ventrale Teil der Körpersegmente sind zottig weißlich behaart. Die zwei vorderen Beinpaare besitzen fünfgliedrige, das hintere Paar viergliedrige Tarsen (Fußteile). Die Fühler des kleineren und schlankeren Männchens erreichen etwa die Hälfte, die des größeren Weibchens etwa ein Viertel der Körperlänge.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: Die Tiere werden vorsichtig (Abzug!) pulverisiert. 1 g Pulver (355) wird mit 10 ml Ethanol 90 % R versetzt, die Mischung 1 h lang geschüttelt und anschließend filtriert.
Referenzlösung: 20 mg Menthol R und 10 mg Guajazulen R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254R (5 bis 40 µm) [oder DC-Platte mit Kieselgel F254R (2 bis 10 µm)]
Fließmittel: Ethanol 96 % R, Toluol R (10:90 V/V)
Auftragen: 100 µl [oder 25 µl] Untersuchungslösung und 10 µl [oder 2,5 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.

Prüfung auf Reinheit
Fremde Bestandteile:
- a)
-
(2.8.2): höchstens 1,0 Prozent
- b)
-
Die unzerkleinerten Tiere dürfen keinen Geruch nach Ammoniak aufweisen.
Asche (2.4.16): höchstens 8,0 Prozent
Gehaltsbestimmung
Gaschromatographie (2.2.28)
Interner-Standard-Lösung: 10,0 mg Benzophenon R werden in Aceton R zu 10,0 ml gelöst.
Untersuchungslösung: Die Tiere werden unter Vermeidung von Wärmeentwicklung vorsichtig (Abzug!) pulverisiert. 1,000 g Pulver (355) wird mit 10,0 ml Aceton R versetzt, die Mischung 1 h lang geschüttelt und anschließend filtriert. 1,0 ml Filtrat werden mit 1,0 ml Interner Standardlösung gemischt.
Referenzlösung: 5,0 mg Cantharidin RH werden in Aceton R zu 5,0 ml gelöst. 1,0 ml Lösung werden mit 1,0 ml Interner-Standard-Lösung gemischt.
Säule:
- –
-
Material: Quarzglas
- –
-
Größe: l = 30 m, Ø = etwa 0,53 mm
- –
-
Stationäre Phase: Cyanopropyl(7)phenyl(7)methyl(86)polysiloxan R (Filmdicke 1,0 µm)
Trägergas: Helium zur Chromatographie R
Durchflussrate: 2,0 ml/min
Splitverhältnis: 1:20
Temperatur:
| Zeit (min) |
Temperatur (°C) |
|
|---|---|---|
| Säule | 0 – 10 | 230 |
| 10 – 13 | 230 → 260 | |
| 13 – 23 | 260 | |
| Probeneinlass | 240 | |
| Detektor | 270 |
Detektion: Flammenionisation
Einspritzen: 1 µl
Reihenfolge der Elution: Benzophenon, Cantharidin
Eignungsprüfung
- –
-
Wiederholpräzision: höchstens 2,0 Prozent relative Standardabweichung für das Flächenverhältnis des Cantharidin-Peaks zum Peak des internen Standards nach 6-maligem Einspritzen der Referenzlösung.
- –
-
Auflösung: mindestens 1,5 zwischen den Peaks von Benzophenon und Cantharidin im Chromatogramm der Referenzlösung
Der Prozentgehalt (m/m) an Cantharidin wird nach folgender Formel berechnet:
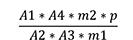
| A1 | = | Fläche des Peaks von Cantharidin im Chromatogramm der Untersuchungslösung |
| A2 | = | Fläche des Peaks von Cantharidin im Chromatogramm der Referenzlösung |
| A3 | = | Fläche des Peaks von Benzophenon im Chromatogramm der Untersuchungslösung |
| A4 | = | Fläche des Peaks von Benzophenon im Chromatogramm der Referenzlösung |
| m1 | = | Einwaage der Droge in Gramm |
| m2 | = | Masse der Referenzsubstanz Cantharidin RH in Gramm |
| p | = | Prozentgehalt an Cantharidin in der Referenzsubstanz Cantharidin RH |
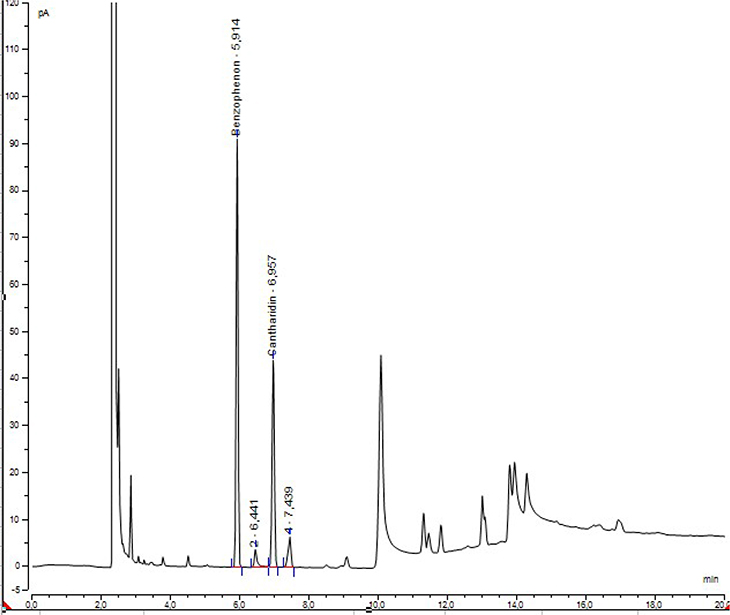
Beispielchromatogramm: Untersuchungslösung der Droge von Lytta vesicatoria
Arzneiformen
Herstellung
Urtinktur aus den unmittelbar zuvor pulverisierten (Abzug!) Tieren (710) und flüssige Verdünnungen nach Vorschrift 4b mit Ethanol 86 % (m/m)
Die 2. und 3. Dezimalverdünnung werden mit Ethanol 86 % (m/m), die 4. Dezimalverdünnung wird mit Ethanol 62 % (m/m) und die folgenden Verdünnungen werden mit Ethanol 43 % (m/m) hergestellt.
Eigenschaften
Die Urtinktur ist eine goldgelbe bis bräunlich grüne Flüssigkeit mit einem unangenehmen, durchdringenden Geruch.
Prüfung auf Identität
Chromatographie: Die Prüfung erfolgt wie unter „Prüfung auf Identität“ bei der Droge angegeben mit der Urtinktur als Untersuchungslösung.
Die Chromatogramme werden vor der Detektion mit Anisaldehyd-Reagenz R für die Reinheitsprüfung „Mylabris-Arten“ ausgewertet.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,827 bis 0,845
Trockenrückstand (H 2.2.6): mindestens 1,0 und höchstens 3,0 Prozent
Mylabris-Arten: Die unter „Prüfung auf Identität“ erhaltenen Chromatogramme werden vor der Detektion mit Anisaldehyd-ReagenzR im ultravioletten Licht bei 365 nm ausgewertet. Oberhalb der Referenzsubstanz Menthol darf im mittleren Drittel keine intensive, hellblau fluoreszierende Zone erscheinen.
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Textpassage zu den Pyrrolizidinalkaloiden entsprach nicht mehr den aktuell geltenden Anforderungen4, 5 und ist deshalb überarbeitet worden.
In diesem Zuge sind auch formale Änderungen eingearbeitet worden, wie die Streichung der unspezifischen nasschemischen Prüfung auf Identität und der Bezug auf Ph. Eur. 2.2.27 bei der DC-Methode.
Es sind jedoch noch weitere Aktualisierungen der Monographie erforderlich, wie zum Beispiel die Ergänzung der HPTLC-Bedingungen und der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten. Diese werden vorgenommen, sobald die vollständige Überprüfung der Monographie abgeschlossen ist.
Packera aurea
Senecio aureus
Verwendet werden die frischen oberirdischen Teile von Packera aurea (L.) A.Löve et D.Löve zur Blütezeit.
Packera aurea kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an Kapitel 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)5. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Laubblätter sind 50 bis 300 mm lang gestielt, ihre Spreite ist abgerundet, sehr unterschiedlich groß, ausgewachsen bis 220 mm lang und 180 mm breit, beiderseits grün oder gelegentlich unterseits purpurfarben, anfangs oder bisweilen stets dünn, jedoch später meist fast lederig. Der Blattrand ist mit abgerundeten oder stumpflichen Zähnen versehen, gelegentlich auch besonders am Grund scharf gesägt. Der Stängel, zum Teil auch zwei oder mehrere, ist aufrecht, nur im oberen Teil wenig verzweigt, 0,2 bis 1,2 m hoch und, ebenso wie die Laubblätter, kahl oder in jungem Zustand mehr oder weniger fein flockig-filzig behaart, aber rasch verkahlend.
Die ungeteilten, den Stängel umgebenden Grundblätter sind verschieden, aber in der Regel lang und stets dünn gestielt. Ihre Spreite ist fast kreisrund bis eiförmig, am Grund vorwiegend mehr oder weniger stark herzförmig, am oberen Ende breit abgerundet, am Rand gekerbt oder bisweilen gesägt, in der Regel ¾- bis ½-mal so lang wie breit, gelegentlich bis 110 mm lang und breit, oft aber viel kleiner. Die wenigen, wechselständigen Stängelblätter sind stark reduziert, mehr oder weniger einfach fiederspaltig, nach oben hin zunehmend kürzer gestielt bis sitzend.
Die wenigen bis zahlreichen, einzeln lang gestielten Blütenköpfchen bilden in etwa eine lockere Schirmrispe. Sie sind von einem zylindrischen bis glockenförmigen Hüllkelch umgeben, der aus 13 bis 21 in einer Reihe angeordneten, schmal-linealen, bisweilen lineal-lanzettlichen, grünen oder oft purpurfarben überlaufenen, kahlen, 5 bis 11 mm langen und 0,5 bis 1,5 mm breiten Blättchen besteht. Der etwa 5 bis 12 mm breite Blütenstandsboden ist flach und ohne Spreublätter; er trägt am Rand 8 bis 13 goldgelbe weibliche Zungenblüten. Die häufig zugespitzte, etwa 6 bis 13 mm lange Zunge ist mehr oder weniger zurückgebogen und geht basal in eine etwa halb so lange Röhre über. Die zahlreichen scheibenständigen, gelben zwittrigen Röhrenblüten haben eine sehr schmal trichterförmige, nach oben kaum erweiterte, fünfzipflige, 6 bis 10 mm lange Krone. Der unterständige Fruchtknoten beider Blütenarten ist fast zylindrisch, gerippt, kahl und etwa 3,5 bis 4 mm lang. Er trägt an der Spitze einen einreihigen Pappus aus einfachen, sehr weichen und haarartigen Borsten, der länger als die Kronröhre ist.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine braungrüne Flüssigkeit mit heuartigem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 5 ml Urtinktur werden unter vermindertem Druck bis zur Hälfte eingeengt und mit 1 ml gesättigter Natriumchlorid-Lösung R versetzt. Die Mischung wird 2-mal mit je 5 ml Ethylacetat R ausgeschüttelt. Die vereinigten organischen Phasen werden zur Trockne eingeengt. Der Rückstand wird mit 0,5 ml Ethylacetat R aufgenommen.
Referenzlösung: 50 mg Brenzcatechin R, 10 mg Borneol R und 10 mg Bornylacetat R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254 R
Fließmittel: Methanol R, Ethylacetat R, Toluol R (5:20:75 V/V/V)
Auftragen: 20 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Die Platte wird mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt am Übergang vom unteren zum mittleren Drittel die rosafarbene Zone des Brenzcatechins, im mittleren Drittel die orangebraune Zone des Borneols und im oberen Drittel die orangebraune Zone des Bornylacetats.
Das Chromatogramm der Untersuchungslösung zeigt zwischen Start und der Referenzsubstanz Brenzcatechin eine violette Zone. Knapp unterhalb der Referenzsubstanz Brenzcatechin liegt eine orangebraune Zone. Etwa in Höhe der Referenzsubstanz Brenzcatechin tritt eine violette Zone auf und etwa in Höhe der Referenzsubstanz Borneol tritt eine violette Zone auf. Oberhalb der Referenzsubstanz Bornylacetat liegt eine kräftige, violette Zone.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,900 bis 0,920
Trockenrückstand (H 2.2.6): mindestens 1,6 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Textpassage zu den Pyrrolizidinalkaloiden entsprach nicht mehr den aktuell geltenden Anforderungen4, 5 und ist deshalb überarbeitet worden.
In diesem Zuge sind auch formale Änderungen eingearbeitet worden, wie der Bezug auf Ph. Eur. 2.2.27 bei der DC-Methode.
Es sind jedoch noch weitere Aktualisierungen der Monographie erforderlich, wie zum Beispiel die Ergänzung der HPTLC-Bedingungen und der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten. Diese werden vorgenommen, sobald die vollständige Überprüfung der Monographie abgeschlossen ist.
Petasites hybridus
Petasites
Verwendet werden die frischen oberirdischen Teile von Petasites hybridus (L.), G. Gaertn., B. Mey. et Scherb. gegen Ende der Blütezeit.
Petasites hybridus kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an Kapitel 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)5. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Pflanze hat einen charakteristischen, schwach widerlichen Geruch.
Die gegen Ende der Blütezeit erscheinenden Laubblätter sind in der Knospe rückwärts gerollt, später flach ausgebreitet, herzförmig oder rundlich-nierenförmig, kurz zugespitzt, am Grund tief ausgebuchtet, am Rand scharf ausgebissen, gezähnt, anfangs weich, später derb, oberseits grün, unterseits graufilzig, zur Fruchtzeit bis 1 m lang und bis 0,6 m breit. Der Blattstiel ist ringsum deutlich gerippt, oberseits tief eng gefurcht, bis zum Grund des Blattstiels geflügelt.
Die Blüten tragenden Stängel erscheinen an anderen Ästen der Grundachse vor den Laubblättern und sind von aufrechter, dicker, röhriger sowie fleischiger Gestalt, zur Blütezeit etwa 400 mm hoch. Sie sind mit zahlreichen weichen, purpurfarbenen, lanzettlichen, oft schlaff herabhängenden Schuppen besetzt.
Die männlichen Pflanzen enthalten in Trauben überwiegend scheinzwittrige Blüten mit röhrig-fünfzähnigem Saum, in denen nur Pollen erzeugt werden, während der Fruchtknoten oft nur als Stiel erscheint. Die eiförmigen Narbenlappen überragen den Kronsaum nicht. Vereinzelt treten allerdings auch ein bis drei voll entwickelte weibliche Blüten mit engröhriger Krone auf, die verkümmerte, einseitig entwickelte Kronzipfel aufweisen können. Während die Narbenlappen wenig hervorragen, fehlen diesen Blüten Staubblätter völlig; doch gibt es bisweilen auch Übergangsformen, auf deren Griffel noch vereinzelte funktionslose Fegehaare sitzen.
Auf den weiblichen Pflanzen nehmen die fertilen Blüten den Randteil des Kopfes ein. In der Scheibenmitte stehen einzeln große, unfruchtbare Honigblüten, deren Kronröhre becherartig erweitert und am Grund mit einer Honigdrüse versehen ist. Durch die Anwesenheit von verkümmerten, selten ganz fehlenden männlichen und weiblichen Geschlechtsorganen sind sie als umgewandelte Zwitterblüten aufzufassen. Die Kopfstände der weiblichen Pflanzen stellen eine längliche Traube oder Rispe dar, bei den männlichen Pflanzen eine kurze Traube. Die Blütenfarbe wechselt von schmutzigpurpur- bis blassrosafarben.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine dunkelgrüne bis gelbbraune Flüssigkeit mit aromatischem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 5 mg Hyperosid R und 5 mg Kaffeesäure R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Ameisensäure R, Wasser R, Ethylacetat R (13:20:67 V/V/V)
Auftragen: 20 µl µl Untersuchungslösung und 10 µl Referenzlösung; 20 mm
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l–1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l–1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 min im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im mittleren Drittel die gelb fluoreszierende Zone des Hyperosids und im oberen Drittel die grünblau fluoreszierende Zone der Kaffeesäure.
Das Chromatogramm der Untersuchungslösung zeigt etwa in Höhe der Referenzsubstanz Hyperosid eine oder zwei blaugrün fluoreszierende Zonen, in der Mitte zwischen den Referenzsubstanzen eine blaugrün fluoreszierende Zone sowie unterhalb, in Höhe und oberhalb der Referenzsubstanz Kaffeesäure je eine blaugrün fluoreszierende Zone.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,895 bis 0,915
Trockenrückstand (H 2.2.6): mindestens 1,1 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Textpassage zu den Pyrrolizidinalkaloiden entsprach nicht mehr den aktuell geltenden Anforderungen4, 5 und ist deshalb überarbeitet worden.
In diesem Zuge sind auch formale Änderungen eingearbeitet worden, wie der Bezug auf Ph. Eur. 2.2.27 bei der DC-Methode.
Es sind jedoch noch weitere Aktualisierungen der Monographie erforderlich, wie zum Beispiel die Ergänzung der HPTLC-Bedingungen und der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten. Diese werden vorgenommen, sobald die vollständige Überprüfung der Monographie abgeschlossen ist.
Symphytum officinale
Symphytum
Verwendet werden die frischen unterirdischen Teile von Symphytum officinale L. vor Beginn der Blüte.
Symphytum officinale kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an Kapitel 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)5. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Pflanzenteile haben einen charakteristischen Geruch.
Der mehrköpfige, rübenförmige Wurzelstock ist gewöhnlich durch Verschwinden des Marks hohl. Er geht in die Hauptwurzel beziehungsweise an den Seitenästen in sprossbürtige Wurzeln über. Die Wurzeln sind etwa 25 mm dick und bis zu 300 mm lang, kaum verzweigt, tief längsrunzelig, außen dunkelbraun bis braunschwarz, innen heller und lassen im Querschnitt bei Lupenbetrachtung einen strahligen Holzkörper erkennen. Dickere Wurzeln sind zuweilen hohl.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine rötlich braune bis dunkelbraune Flüssigkeit mit charakteristischem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 10 mg Allantoin CRS werden in 5 ml Wasser R gelöst und mit Methanol R zu 10 ml verdünnt.
Platte: DC-Platte mit Kieselgel F254 R
Fließmittel: Ameisensäure R, Wasser R, Ethylmethylketon R, Ethylacetat R (10:10:30:50 V/V/V/V)
Auftragen: 40 µl; bandförmig 20 mm
Laufstrecke: 10 cm
Trocknen: 15 min lang im Warmluftstrom
Detektion: Das Chromatogramm der Untersuchungslösung wird zunächst im ultravioletten Licht bei 365 nm ausgewertet. Anschließend wird die Platte mit Dimethylaminobenzaldehyd-Lösung R 7 behandelt und unter Beobachtung bis zur deutlichen Farbentwicklung der Zonen bei 105 bis 110 °C erhitzt. Die Auswertung erfolgt im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im mittleren Drittel die gelbe Zone des Allantoins.
Das Chromatogramm der Untersuchungslösung zeigt im ultravioletten Licht bei 365 nm zwischen Start und der Referenzsubstanz Allantoin eine blau fluoreszierende Zone. Nach dem Besprühen zeigt das Chromatogramm im Tageslicht in Höhe der Referenzsubstanz Allantoin eine gelbe Zone und darüber eine weitere gelbe Zone.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,900 bis 0,920
Trockenrückstand (H 2.2.6): mindestens 1,2 Prozent
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Textpassage zu den Pyrrolizidinalkaloiden entsprach nicht mehr den aktuell geltenden Anforderungen4, 5 und ist deshalb überarbeitet worden.
In diesem Zuge sind auch formale Änderungen eingearbeitet worden, wie der Bezug auf Ph. Eur. 2.2.27 bei der DC-Methode.
Es sind jedoch noch weitere Aktualisierungen der Monographie erforderlich, wie zum Beispiel die Ergänzung der HPTLC-Bedingungen und der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten. Diese werden vorgenommen, sobald die vollständige Überprüfung der Monographie abgeschlossen ist.
Tussilago farfara
Farfara
Verwendet werden die frischen Blätter von Tussilago farfara L.
Tussilago farfara kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an Kapitel 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)5. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Blätter haben einen schwachen Geruch.
Die Spreite der grundständigen, lang gestielten Blätter ist im Umriss rundlich, breit ei- bis herzförmig, in der Regel nur leicht fünf- bis zwölflappig und am Grund mit einer stumpfen Bucht versehen, deren Durchmesser 100 bis 200 mm beträgt, selten bis 300 mm. Der Blattrand ist leicht ausgeschweift bis deutlich doppelt gezähnt und mit aufsitzenden, knorpeligen, dunkel erscheinenden Zähnchen besetzt. Die grobmaschige, handförmige Nervatur ist oberseits mehr oder weniger stark eingesenkt und tritt unterseits in der Regel deutlich hervor; wenigstens vier der Seitennerven erster Ordnung gehen fächerförmig vom Ansatz der Grundbucht aus. Die Blattfläche ist oberseits sattgrün, früh verkahlend, unterseits blassgrün und, zumindest auf den Nerven, mehr oder weniger dicht weißlich-wollig behaart. Der Blattstiel ist seitlich zusammengedrückt, oberseits deutlich gefurcht, an den Seiten glatt und nicht gerippt; er ist mehr oder weniger behaart und, ebenso wie der Blattrand und die Hauptnerven oberseits, häufig rötlich violett überlaufen.
Mikroskopische Merkmale: Die Epidermiszellen der Blattoberseite sind in der Aufsicht etwa 40 bis 60 µm groß, polygonal bis schwach wellig-buchtig, dünnwandig, im Querschnitt flach rechteckig, die der Blattunterseite kleiner und stark wellig-buchtig. Die Kutikula der Oberseite zeigt eine deutliche Streifung, die über mehrere Epidermiszellen hinweg und um die Haaransatzstellen und die Spaltöffnungen radiär verläuft. Die Epidermis der Unterseite zeigt nur eine auf die Breite der Spaltöffnungen zulaufende Streifung. Die Spaltöffnungen vom anomocytischen Typ sind von drei bis sechs Nebenzellen umgeben, unterseits zahlreicher als oberseits; sie sind bis etwa 45 µm lang und bis etwa 35 µm breit und liegen in der Epidermisebene. Das Palisadenparenchym besteht aus drei oder vier Zelllagen. Die Zellen der obersten Lage sind kurz und dicht gelagert, diejenigen der übrigen mehr oder weniger gestreckt und durch Interzellularen getrennt. Das Schwammparenchym wird aus mehreren Lagen polyedrischer Zellen gebildet, die besonders in der Nähe der unteren Epidermis große Lufträume umschließen (Aerenchym). Die Haare der Unterseite sind etwa 100 bis 250 µm lang und etwa 10 bis 12 µm breit; sie bestehen aus bis zu sechs kurzen, dünnwandigen, oft kollabierten Fußzellen und einer langen, am Grunde unverdickten, an der Spitze abgerundeten, unregelmäßig verschlungenen Endzelle, deren glatte Kutikula bisweilen eine feine, schraubenförmig verlaufende Risslinie aufweist. Auf der Blattoberseite sind meist nur noch die Haaransatzstellen vorhanden. In den meisten Mesophyllzellen liegen Klumpen oder strahlige oder fedrige Kristallaggregate von Inulin; Calciumoxalat fehlt.
Prüfung auf Reinheit
Blätter von Petasites- und Arctium-Arten: Blattstücke, deren Palisadenparenchym nur aus einer bis zwei Zelllage/n besteht, oder solche, deren Schwammparenchym nur kleine Lufträume aufweist, dürfen nicht vorhanden sein. Ebenso dürfen keine Blattstücke vorhanden sein, die kurze, breite Gliederhaare, bestehend aus vier bis acht sehr kurzen, tonnenförmigen Zellen und einer meist abgebrochenen, peitschenförmigen Endzelle tragen. Desgleichen dürfen keine Blattstücke, deren Nerven letzter Ordnung im aufgehellten Präparat deutlich sichtbar sind und deren obere Epidermis aus wellig-buchtigen, relativ derbwandigen und deutlich getüpfelten Zellen ohne Kutikularstreifung besteht, vorhanden sein.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 2a
Eigenschaften
Die Urtinktur ist eine gelbbraune Flüssigkeit mit schwach aromatischem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 10 mg Rutosid-Trihydrat R, 10 mg Hyperosid R und 10 mg Kaffeesäure R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Ameisensäure R, Wasser R, Ethylmethylketon R, Ethylacetat R (10:10:30:50 V/V/V/V)
Auftragen: 30 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 15 cm
Trocknen: im Warmluftstrom
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l–1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l–1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 min im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die orangerot fluoreszierende Zone des Rutosids, im mittleren Drittel die orange fluoreszierende Zone des Hyperosids und im oberen Drittel die grünblau fluoreszierende Zone der Kaffeesäure.
Das Chromatogramm der Untersuchungslösung zeigt zwischen den Referenzsubstanzen Rutosid und Hyperosid zwei dicht beieinanderliegende hellgrün fluoreszierende Zonen, knapp oberhalb der Referenzsubstanz Hyperosid können zwei orange fluoreszierende Zonen erscheinen. Zwischen den Referenzsubstanzen Hyperosid und Kaffeesäure liegen zwei dicht beieinanderliegende grün fluoreszierende Zonen, knapp unterhalb der Referenzsubstanz Kaffeesäure liegt eine grün fluoreszierende Zone, etwa in Höhe der Referenzsubstanz Kaffeesäure liegt eine blau fluoreszierende Zone und darüber kann eine grün fluoreszierende Zone auftreten.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,930 bis 0,950
Trockenrückstand (H 2.2.6): mindestens 1,3 Prozent
Lagerung
Vor Licht geschützt
Neue Reagenzien
Natriummethanolat-Lösung (0,1 mol · l–1) RH
In einer Eis-Wasser-Mischung werden 180 ml wasserfreies Methanol R gekühlt und in kleinen Anteilen mit etwa 0,5 g frisch geschnittenem Natrium R versetzt.
Einstellung:
10 ml Dimethylformamid R werden unter Zusatz von 0,05 ml einer Lösung von Thymolblau R (3 g · l–1) in Methanol R mit der Natriummethanolat-Lösung bis zur reinen Blaufärbung titriert. Die Lösung wird sofort mit 0,100 g Benzoesäure RV versetzt, bis zum Lösen der Substanz geschüttelt und mit der Natriummethanolat-Lösung bis zur erneuten reinen Blaufärbung titriert.
Während der Titration ist die Lösung vor Kohlendioxid der Luft zu schützen.
Aus dem Titrationsvolumen der zweiten Titration wird die genaue Konzentration der Natriummethanolat-Lösung ermittelt und durch Verdünnen mit wasserfreiem Methanol R auf eine Konzentration von 0,1 mol · l–1 eingestellt.
1 ml Natriummethanolat-Lösung (0,1 mol · l–1) entspricht 12,21 mg C7H6O2.
Phorbol-12-myristat-13-acetat RH
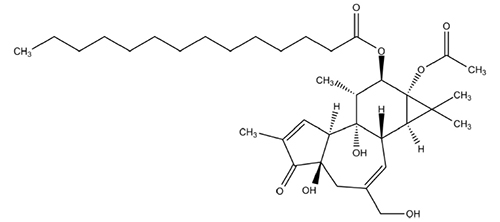
C36H56O8
M r 616,8
CAS Nr. 16561-29-8
[(1S,2S,6R,10S,11R,13S,14R,15R)-13-acetyloxy-1,6-dihydroxy-8-(hydroxymethyl)-4,12,12,15-tetramethyl-5-oxo-14-tetracyclo[8.5.0.02,6.011,13]pentadeca-3,8-dienyl] tetradecanoat
Eigenschaften
Weißes, amorphes oder kristallines Pulver, löslich in Ethanol 96 % und Methanol, praktisch unlöslich in Wasser
Prüfung auf Identität
IR-Spektroskopie (2.2.4): Das IR-Spektrum entspricht dem Referenzspektrum (siehe Abbildung).
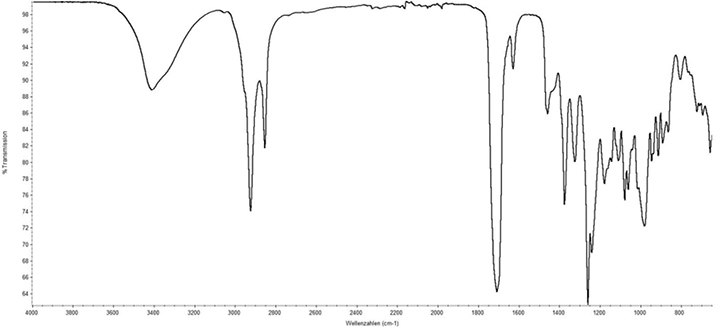
Abb.: IR-Spektrum von Phorbol-12-myristat-13-acetat
Wird die Substanz in der Gehaltsbestimmung verwendet, muss sie zusätzlich folgenden Anforderungen entsprechen:
Gehaltsbestimmung
Die Bestimmung erfolgt mit Hilfe der Flüssigchromatographie (2.2.29).
Untersuchungslösung: 5,0 mg Substanz werden in Methanol R zu 10,0 ml gelöst.
Säule
- –
-
Größe: l = 0,10 m, Ø = 4,6 mm
- –
-
Stationäre Phase: octadecylsilyliertes, nachsilanisiertes Kieselgel zur Chromatographie R mit festem Kern (2,6 μm)
- –
-
Temperatur: 25 °C
Mobile Phase
- –
-
Mobile Phase A: Wasser zur Chromatographie R
- –
-
Mobile Phase B: Acetonitril zur Chromatographie R
| Zeit (min) |
Mobile Phase A (% V/V) |
Mobile Phase B (% V/V) |
|---|---|---|
| 0 – 2 | 50 | 50 |
| 2 – 22 | 50 → 10 | 50 → 90 |
| 22 – 27 | 10 | 90 |
Durchflussrate: 1,0 ml · min–1
Detektion: Spektrometer bei 230 nm
Einspritzen: 10 μl
Der Gehalt, berechnet mit Hilfe des Verfahrens „Normalisierung“ (2.2.46), muss mindestens 98 Prozent betragen.
Revidiertes Reagenz
Anmerkung zur Monographie:
Das HAB-Reagenz wird um die Angaben als Gehaltsstandard für die Gehaltsbestimmung in der HAB-Monographie „Lytta vesicatoria, Cantharis“ ergänzt.
Die Reinheitsprüfung mittels DC wird gestrichen, da diese keinen zusätzlichen Erkenntnisgewinn liefert und die Reinheit zudem über die Übereinstimmung des IR-Spektrums mit dem Referenzspektrum gewährleistet werden kann.
Cantharidin RH
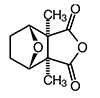
C10H12O4
M r 196,2
CAS Nr. 56-25-7
(1S,2R,6S,7R)-2,6-Dimethyl-4,10-dioxatricyclo[5.2.1.02,6]decan-3,5-dion
Eigenschaften
Farblose, glänzende, sublimierbare Plättchen; praktisch unlöslich in kaltem Wasser, sehr schwer löslich in heißem Wasser, Ethanol 96 % und Ether, wenig löslich in Aceton, Chloroform und Ethylacetat, unter Erwärmen löslich in fetten Ölen, Wachsen und Harzen
Prüfung auf Identität
Schmelztemperatur (2.2.14): etwa 218 °C
Oder
IR-Spektroskopie (2.2.4): Das IR-Spektrum entspricht dem Referenzspektrum (siehe Abbildung).
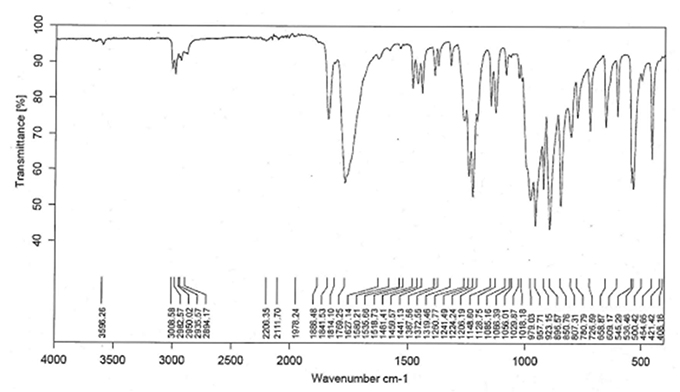
Abb.: IR-Spektrum von Cantharidin
Prüfung auf Reinheit
Aussehen der Lösung: Die Lösung von 50 mg Substanz in 2 ml Schwefelsäure R muss farblos (2.2.2, Methode I) sein.
Die unter Erwärmen hergestellte Lösung von 50 mg Substanz in 12 ml verdünnter Natriumhydroxid-Lösung R muss klar (2.2.1) und farblos (2.2.2, Methode II) sein.
Die unter Erwärmen hergestellte Lösung von 50 mg Substanz in 4 ml Chloroform R muss klar (2.2.1) und farblos (2.2.2, Methode I) sein.
Wird die Substanz in der Gehaltsbestimmung verwendet, muss sie zusätzlich folgenden Anforderungen entsprechen:
Gehaltsbestimmung
Die Bestimmung erfolgt mit Hilfe der Gaschromatographie (2.2.28) wie in der Monographie Lytta vesicatoria (HAB) beschrieben mit folgender Untersuchungslösung:
Untersuchungslösung: 5 mg Substanz werden in Aceton R zu 5 ml gelöst.
Der Gehalt, berechnet mit Hilfe des Verfahrens „Normalisierung“ (2.2.46), muss mindestens 95 Prozent betragen.
- 1
- Extrelut NT-20-Fertigsäule
- 2
- geeignet ist z. B. eine Kinetex C18 von Phenomenex
- 3
- Extrelut NT-20-Fertigsäule
- 4
- Bekanntmachung des BfArM vom 1. März 2023 „zur Prüfung des Gehalts an Pyrrolizidinalkaloiden zur Sicherstellung der Qualität und Unbedenklichkeit von Arzneimitteln, die homöopathische Zubereitungen aus pflanzlichen Ausgangsstoffen als Wirkstoffe enthalten“
- 5
- „Public Statement on the use of herbal medicinal products containing toxic, unsaturated pyrrolizidine alkaloids (PAs), including recommendations regarding contamination of herbal medicinal products with PAs“ des HMPC vom 7. Juli 2021 (EMA/HMPC/893108/2011 Rev. 1)











Kommentar hinterlassen