Bundesinstitut
für Arzneimittel und Medizinprodukte
Bekanntmachung
einer Mitteilung
zum Homöopathischen Arzneibuch
(Empfehlungen der Fachausschüsse der
Deutschen Homöopathischen Arzneibuch-Kommission)
Auf Grund des § 7 Absatz 5 der Geschäftsordnung für die Deutsche Homöopathische Arzneibuch-Kommission und deren Gremien (Bekanntmachung vom 17. Juli 2009, BfArM-Homepage) sind Empfehlungen der Fachausschüsse der Deutschen Homöopathischen Arzneibuch-Kommission den betroffenen Fach- und Wirtschaftskreisen zur Kenntnis zu bringen.
Der Fachausschuss Analytik der Deutschen Homöopathischen Arzneibuch-Kommission hat die unten genannten Entwürfe für ein neues und ein revidiertes Reagenz, die Allgemeine Monographie, eine neue Monographie und revidierte Monographien für die Aufnahme in das Homöopathische Arzneibuch empfohlen. Sie werden hiermit zur Kenntnis gebracht (Anlage).
Neues Reagenz
Kaliumhydroxid-Lösung, methanolische RH
Revidiertes Reagenz
Proscillaridin RH
Allgemeine Monographie
Ergänzende Regeln zur Allgemeinen Monographie „Urtinkturen für homöopathische Zubereitungen“ des Europäischen Arzneibuchs zu Hyoscyamus, Planta tota, Vorschrift 21
Neue Monographie
Aspidosperma quebracho-blanco (Quebracho)
Revidierte Monographien
- 1.
-
Aesculus hippocastanum ex cortice, ethanol. Decoctum (Aesculus, Cortex, ethanol. Decoctum)
- 2.
-
Apocynum cannabinum (Apocynum)
- 3.
-
Chelidonium majus (Chelidonium)
- 4.
-
Chelidonium majus e floribus, ethanol. Digestio
- 5.
-
Chelidonium majus Rh (Chelidonium Rh)
- 6.
-
Cerium oxalicum
- 7.
-
Cinnamomum verum (Cinnamomum)
- 8.
-
Drimia maritima, ethanol. Digestio (Urginea maritima, ethanol. Digestio; Scilla alba, ethanol. Digestio)
- 9.
-
Ephedra distachya spag. Zimpel (Ephedra spag. Zimpel)
- 10.
-
Euonymus europaeus (Euonymus europaea, Evonymus europaea)
- 11.
-
Eutrochium purpureum (Eupatorium purpureum)
- 12.
-
Garcinia (Gutti)
- 13.
-
Gaultheriae aetheroleum (Oleum gaultheriae)
- 14.
-
Harungana madagascariensis (Haronga)
- 15.
-
Jacobaea maritima (Senecio cineraria, Senecio bicolor, Cineraria maritima)
- 16.
-
Levisticum officinale, ethanol. Decoctum
- 17.
-
Malva sylvestris, ethanol. Infusum (Malva, ethanol. Infusum)
- 18.
-
Melilotus officinalis spag. Zimpel
- 19.
-
Ononis spinosa
- 20.
-
Packera aurea (Senecio aureus)
- 21.
-
Petasites hybridus (Petasites)
- 22.
-
Resina piceae (Abies nigra)
- 23.
-
Rheum
- 24.
-
Turnera diffusa (Damiana)
- 25.
-
Vaccinium myrtillus (Myrtillus)
Stellungnahmen zu dem oben genannten Entwurf des Homöopathischen Arzneibuches sind bis spätestens 6. Januar 2025 einschließlich an die Geschäftsstelle der Arzneibuch-Kommissionen im Bundesinstitut für Arzneimittel und Medizinprodukte, Kurt-Georg-Kiesinger-Allee 3, 53175 Bonn, zu richten.
43.07-2024-
Bundesinstitut
für Arzneimittel und Medizinprodukte
In Vertretung
Prof. Dr. Werner Knöss
Neues Reagenz:
Anmerkung zum Reagenz:
Das Reagenz „Kaliumhydroxid-Lösung, methanolische RN“ wird im DAB gestrichen und als Reagenz in das HAB aufgenommen, da es ausschließlich für die HAB-Monographien benötigt wird.
Kaliumhydroxid-Lösung, methanolische RH
10,0 g Kaliumhydroxid R werden in 30 ml Wasser R gelöst und mit Methanol R zu 100 ml verdünnt.
Revidiertes Reagenz:
Anmerkungen zum Reagenz:
Das Reagenz wird als Gehaltsstandard für die HAB-Monographie „Drimia maritima, ethanol. Digestio“ etabliert.
Proscillaridin RH
C30H42O8
M r 530,7
CAS Nr. 466-06-8
(3β)-3-[(6-Desoxy-α-L-mannopyranosyl)oxy]-14-hydroxybufa-4,20,22-trienolid
Eigenschaften
Weißes bis schwach gelbes, kristallines Pulver; praktisch unlöslich in Wasser, löslich in Ethanol, Methanol und Pyridin, praktisch unlöslich in Ether
Prüfung auf Identität
Schmelztemperatur (2.2.14): etwa 222 °C
oder
IR-Spektroskopie (2.2.24): Das IR-Spektrum entspricht dem Referenzspektrum (siehe Abbildung).
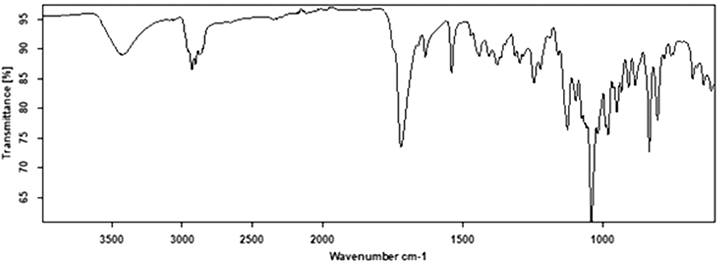
Abbildung: IR-Referenzspektrum von Proscillaridin
Wird die Substanz in der Gehaltsbestimmung verwendet, muss sie zusätzlich folgenden Anforderungen entsprechen:
Prüfung auf Reinheit
Wasser (2.5.32): höchstens 5,0 %, mit 20 mg Substanz bestimmt
Lösungsmittel-Rückstände (2.2.28): höchstens 3,0 %
Chromatographische Reinheit:
Die Bestimmung erfolgt mit Hilfe der Flüssigchromatographie (2.2.29) wie in der Monographie Drimia maritima, ethanol. Digestio (HAB) beschrieben mit folgender Untersuchungslösung:
Stammlösung: 5,0 mg Substanz werden in Methanol R2 zu 10,0 ml gelöst.
Untersuchungslösung: 800 µl Stammlösung werden in einer Mischung von 80 Volumteilen Wasser R und 20 Volumteilen Methanol R2 zu 10,0 ml verdünnt.
Die chromatographische Reinheit, berechnet mit Hilfe des Verfahrens „Normalisierung“ (2.2.46), muss mindestens 90 % betragen.
Gehaltsbestimmung
Der Gehalt wird unter Berücksichtigung des Wassergehalts und der Lösungsmittel-Rückstände sowie der chromatographischen Reinheit nach folgender Formel berechnet:
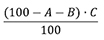
A = Gehalt an Wasser (2.5.32) in Prozent
B = Gehalt an Lösungsmittel-Rückständen (2.2.28) in Prozent
C = Chromatographische Reinheit (2.2.29) in Prozent
Allgemeine Monographie:
Ergänzende Regeln zur Allgemeinen Monographie „Urtinkturen für homöopathische Zubereitungen“ des Europäischen Arzneibuchs
Die Allgemeine Monographie „Ergänzende Regeln zur Allgemeinen Monographie ‚Urtinkturen für homöopathische Zubereitungen‘ des Europäischen Arzneibuchs“ wird durch Hinzufügung der folgenden Pflanze und des jeweils zugehörigen Höchstwertes für den Methanolgehalt revidiert:
| Stammpflanze | Herstellungsvorschrift nach HAB |
Verarbeitete Pflanzenteile | Methanolgehalt Höchstwert Prozent (V/V) |
|---|---|---|---|
| Hyoscyamus niger L. | V. 21 | Frische ganze Pflanze zur Blütezeit | 0,15 |
Neue Monographie:
Aspidosperma quebracho-blanco
Quebracho
Definition
Verwendet wird die getrocknete Stamm- und Zweigrinde von Aspidosperma quebracho-blanco Schltdl, die bezogen auf die getrocknete Droge mindestens 0,70 % (m/m) Alkaloide, berechnet als Yohimbin (C21H26N2O3; Mr 354,4) enthält.
Beschreibung
Die Rindenstücke sind 2 bis 3 cm dick, hart, flach oder rinnenförmig, außen tief gefurcht und querrissig. Die Innenrinde ist gelblich grau, rötlich grau oder gelbbraun und deutlich längsstreifig, der Bruch ist kurzsplitterig. Der Querschnitt zeigt eine mächtige, gelblich bis ziegelrote, von zahlreichen hellen Bändern durchzogene Borke, die sich scharf von der Innenrinde abhebt. Borke und Rinde erscheinen gelblich weiß gesprenkelt.
Schnittdroge: Die Schnittdroge ist gekennzeichnet durch gelblich bis ziegelrote Borkenstückchen und rötlich graue bis gelbbraune Rindenteile. Die Droge erscheint weißlich punktiert.
Mikroskopische Merkmale: Es ist kein primäres Rindengewebe vorhanden. Die Borke der sekundären Rinde ist von zahlreichen Korkfragmenten durchzogen, die aus dünnwandigen, farblosen, unverholzten Zellen bestehen. Zwischen den Korkfragmenten und in den inneren Rindenschichten befinden sich zahlreiche Bündel dickwandiger Sklerenchymfasern und in Nestern vorliegende dickwandige, getüpfelte Steinzellen. Sowohl Sklerenchymfasern als auch Steinzellen sind umhüllt von Kristallzellreihen von Calciumoxalatkristallen. Zusätzlich sind auch zahlreiche frei liegende Kristalle vorhanden. Die sekundäre Rinde ist von zwei- bis dreireihigen Markstrahlen durchzogen. Im dünnwandigen Parenchym können sich einfach oder zwei- bis vierfach zusammengesetzte Stärkekörner befinden. Die inneren Rindenschichten weisen meist kollabierte Siebröhren mit leitersprossenartig versteiften Siebplatten auf.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 1,0 g pulverisierte Droge (355) wird mit 10 ml Salzsäure 1% RN versetzt und für 10 Minuten im Wasserbad erhitzt. Anschließend wird die Mischung mit 0,5 g wasserfreiem Natriumcarbonat R versetzt und nach Beendigung der Gasentwicklung filtriert. Das Filtrat wird dreimal mit je 25 ml Dichlormethan R extrahiert. Die vereinigten organischen Phasen werden über wasserfreiem Natriumsulfat R getrocknet, unter vermindertem Druck zur Trockne eingeengt und der Rückstand in 1 ml Methanol R aufgenommen.
Referenzlösung: 5 mg Yohimbinhydrochlorid RN und 5 mg Noscapinhydrochlorid R werden jeweils in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Diethylamin R, Ethylacetat R, Toluol R (10:20:70 V/V/V)
Auftragen: 50 μl [oder 10 μl] Untersuchungslösung und 20 μl [oder 5 μl] Referenzlösung; bandförmig 20 mm [oder 8 mm]
Laufstrecke: 10 cm [oder 6 cm]
Trocknen: 100 bis 105 °C bis zum Verschwinden des Fließmittelgeruchs
Detektion: Die Platte wird mit verdünntem Dragendorffs Reagenz R und anschließend mit Natriumnitrit-Lösung R behandelt. Die Auswertung erfolgt im Tageslicht.
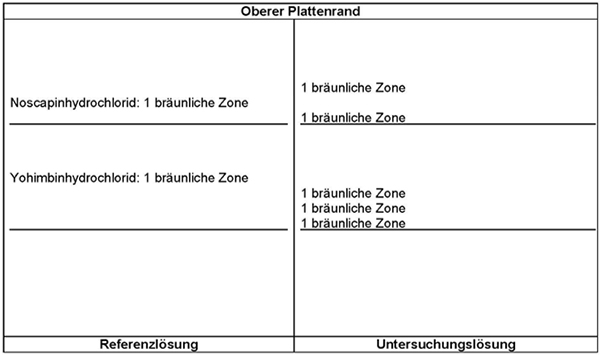
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
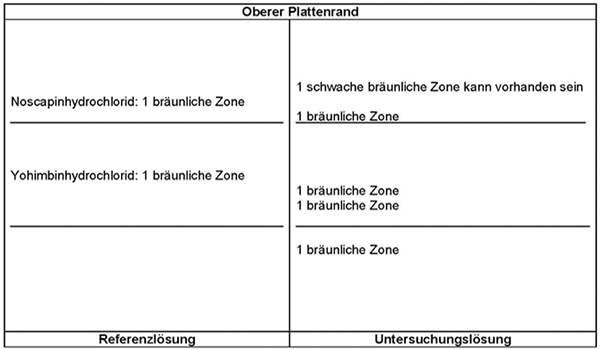
Prüfung auf Reinheit
Fremde Bestandteile (2.8.2): höchstens 2 %
Trocknungsverlust (2.2.32): höchstens 12,0 %, mit 1,000 g pulverisierter Droge (355) durch 2 h langes Trocknen im Trockenschrank bei 100 bis 105 °C bestimmt
Asche (2.4.16): höchstens 10,0 %
Gehaltsbestimmung
Untersuchungslösung:
1,000 g pulverisierte Droge (335) werden mit 50 ml Salzsäure 1 % RN 30 min lang im Wasserbad erhitzt. Nach dem Erkalten wird die Mischung mit Wasser R zu 100,0 ml ergänzt und durch Watte filtriert. Die ersten 25 ml Filtrat werden verworfen. Von dem weiteren Filtrat werden 15,0 ml mit 0,5 g wasserfreiem Natriumcarbonat R versetzt und nach Beendigung der Gasentwicklung auf ein mit 15 g granulierter Kieselgur RH gefülltes Chromatographierohr von etwa 150 mm Länge und 30 mm innerem Durchmesser gegeben1 und der Kolben mit 3 ml Wasser R nachgewaschen. Die Waschflüssigkeit wird ebenfalls auf die Säule gegeben und nach 15 min wird mit 150 ml Dichlormethan R, unter Nachwaschen des Kolbens, eluiert. Nach dem Abtropfen des Dichlormethans wird das Eluat unter vermindertem Druck auf etwa 20 bis 30 ml eingeengt und mit Dichlormethan R auf 50,0 ml ergänzt. 30,0 ml dieser Lösung werden in einen Scheidetrichter pipettiert und mit 20,0 ml Citrat-Pufferlösung pH 4,0 RN und 5,0 ml Eriochromschwarz-T-Lösung RN versetzt. Die Mischung wird kräftig geschüttelt.
Eventuell auftretende Emulsionen werden durch Zugabe von 1 ml gesättigter Natriumchlorid-Lösung R beseitigt. Die rot gefärbte, organische Phase wird durch eine mit Dichlormethan R befeuchtete Filterwatte in einen 100-ml-Messkolben filtriert, der 10,0 ml Methanol R enthält. Die wässrige Phase wird noch 3-mal mit je 20 ml Dichlormethan R extrahiert. Die vereinigten organischen Phasen werden mit Dichlormethan R zu 100,0 ml verdünnt.
Die Absorption A (2.2.25) der Lösung wird bei 520 nm gegen Dichlormethan R als Kompensationsflüssigkeit gemessen.
Referenzlösung:
5,00 mg Yohimbinhydrochlorid CRS werden mit Citrat-Pufferlösung pH 4,0 RN zu 50,0 ml gelöst. 10,0 ml dieser Lösung werden in einen Scheidetrichter pipettiert und mit 10,0 ml Citrat-Pufferlösung pH 4,0 RN versetzt. Nach Zugabe von 30 ml Dichlormethan R und 5,0 ml Eriochromschwarz-T-Lösung RN wird die Mischung kräftig geschüttelt. Eventuell auftretende Emulsionen werden durch Zugabe von 1 ml gesättigter Natriumchlorid-Lösung R beseitigt. Die rot gefärbte, organische Phase wird über eine mit Dichlormethan R befeuchtete Filterwatte in einen 100-ml-Messkolben filtriert, der 10,0 ml Methanol R enthält. Die wässrige Phase wird noch 3-mal mit je 20 ml Dichlormethan R extrahiert. Die vereinigten organischen Phasen werden mit Dichlormethan R zu 100,0 ml verdünnt. Die Absorption A (2.2.25) der Lösung wird bei 520 nm gegen Dichlormethan R als Kompensationsflüssigkeit gemessen.
Der Prozentgehalt (m/m) an Alkaloiden, berechnet als Yohimbin, wird nach folgender Formel berechnet:
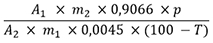
| A 1 | = Absorption der Untersuchungslösung |
| A 2 | = Absorption der Referenzlösung |
| m 1 | = Masse der Droge in Gramm |
| m 2 | = Masse der Referenzsubstanz Yohimbinhydrochlorid in Gramm |
| p | = Prozentgehalt von Yohimbinhydrochlorid CRS |
| T | = Trocknungsverlust in Prozent |
| 0,9066 | = Umrechnungsfaktor von Yohimbinhydrochlorid auf Yohimbin |
Arzneiformen
Die Urtinktur enthält mindestens 0,03 und höchstens 0,13 % (m/m) Alkaloide, berechnet als Yohimbin (C21H26N2O3; Mr 354,5).
Herstellung
Urtinktur aus der pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine rotbraune Flüssigkeit.
Prüfung auf Identität
Die Urtinktur gibt die Identitätsreaktion der Droge.
Untersuchungslösung: 10 ml Urtinktur werden unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 1 ml Methanol R aufgenommen und filtriert.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,880 bis 0,900
Trockenrückstand (H 2.2.6): mindestens 0,3 %
Gehaltsbestimmung
2,000 g Urtinktur werden unter vermindertem Druck zur Trockne eingeengt. Der Rückstand wird mit 5 ml Wasser R versetzt und nach Zugabe von 0,5 g wasserfreiem Natriumcarbonat R bis zum Lösen im Ultraschallbad behandelt. Die Mischung wird in ein mit 15 g granulierter Kieselgur RH gefülltes Chromatographierohr von etwa 150 mm Länge und 30 mm innerem Durchmesser gegeben2 und der Kolben dreimal mit je 4 ml Wasser R nachgewaschen. Die Waschflüssigkeit wird ebenfalls auf die Säule gegeben und nach 15 Minuten wird mit 150 ml Dichlormethan R, unter Nachwaschen des Kolbens, eluiert.
Die weitere Bestimmung erfolgt wie bei der Droge angegeben.
Der Prozentgehalt (m/m) an Alkaloiden, berechnet als Yohimbin, wird nach folgender Formel berechnet:
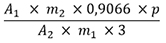
| A 1 | = Absorption der Untersuchungslösung |
| A 2 | = Absorption der Referenzlösung |
| m 1 | = Masse der Urtinktur in Gramm |
| m 2 | = Masse der Referenzsubstanz Yohimbinhydrochlorid in Gramm |
| p | = Prozentgehalt von Yohimbinhydrochlorid CRS |
| 0,9066 | = Umrechnungsfaktor von Yohimbinhydrochlorid auf Yohimbin |
Revidierte Monographien:
Anmerkungen zur Monographie:
Für die Urtinktur wird die DC-Methode gemäß der Ph.-Eur.-Monographie „Rosskastanienrinde“ (2945) übernommen. Die Durchführung der DC-Methode erfolgt wie im HAB üblich nach Ph. Eur. 2.2.27. Somit sind die in der Ph.-Eur.-Monographie angegebenen Referenzlösungen b und c nicht erforderlich. Weiterhin wird die DC-Untersuchung lediglich unter HPTLC-Bedingungen durchgeführt entsprechend einer allgemeinen Entscheidung des Ausschusses Analytik der Homöopathischen Arzneibuchkommission bei der Aufnahme von neuen DC-Methoden in das HAB.
Aesculus hippocastanum ex cortice, ethanol. Decoctum
Aesculus, Cortex, ethanol. Decoctum
Die Droge muss der Monographie Rosskastanienrinde (Ph. Eur.) entsprechen.
Arzneiformen
Herstellung
Urtinktur aus der pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 19f mit Ethanol 30 % (m/m)
Eigenschaften
Die Urtinktur ist eine rotbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: Urtinktur
Referenzlösung: 20 mg Saccharose R, 10 mg Aescin R und 25 mg Aesculin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254R (2 bis 10 μm)
Fließmittel: Essigsäure R, Wasser R, Ethylacetat R, 1-Propanol R (1,5:30:30:40 V/V/V/V)
Auftragen: 2 µl; bandförmig 8 mm
Laufstrecke: 6 cm
Trocknen: im Kaltluftstrom
Detektion:
Die Platte wird mit Anisaldehyd-Reagenz R 2 behandelt und anschließend 8 Minuten bei 120 °C erhitzt und im Tageslicht ausgewertet.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
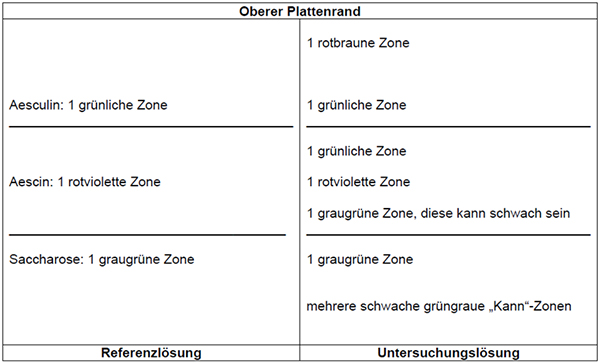
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,960 bis 0,975
Trockenrückstand (H 2.2.6): mindestens 1,5 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Streichung des unspezifischen Geruchs bei der Urtinktur
- –
-
Streichung der nasschemischen Identitätsprüfungen wie üblich, da Identitätsprüfung mittels DC ausreichend ist.
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösungen: Änderung der DAB-Reagenzien „Lanatosid C RN“ und „Scopoletin RN“ auf die Ph.-Eur.-Reagenzien „Lanatosid C R“ und „Scopoletin R“ aufgrund der Streichung im DAB
- –
-
Ergänzung der HPTLC-Bedingungen
- –
-
Änderung der Reihenfolge der Referenzsubstanzen der Referenzlösung nach dem Auftreten im Chromatogramm (von unten nach oben)
- –
-
Prüfung auf Reinheit: Änderung der Spezifikationen bei der relativen Dichte und beim Trockenrückstand basierend auf den vorgelegten Chargendaten
Apocynum cannabinum
Apocynum
Verwendet werden die frischen unterirdischen Teile von Apocynum cannabinum L.
Beschreibung
Die Pflanzenteile haben einen dumpf erdigen Geruch.
Der kriechende, in der Regel 20 mm, selten dickere Wurzelstock ist verzweigt. Er trägt oberseits Narben älterer, abgestorbener Sprossachsen sowie aufrechte, in vorjährige Triebe übergehende, mit Adventivwurzeln besetzte Verzweigungen. Die im Frühjahr ausgegrabenen Organe tragen die Erneuerungsknospen diesjähriger Triebe. Die Stücke des Wurzelstocks sind unregelmäßig rund, durch querlaufende bis in den Holzkörper reichende Einbuchtungen in kurze, unvollständig zylindrische, gebogene Segmente unterteilt, graubraun oder grau, deutlich längsrissig und an den aufsteigenden Stücken oft mit Blattnarben versehen.
Die Wurzeln sind 100 bis 200 mm lang, gelegentlich auch länger, 3 bis 15 mm dick, rund und ähnlich wie die Wurzelstöcke durch querverlaufende Einbuchtungen in unterschiedlich lange Segmente unterteilt, graubraun und deutlich längsrissig. Die nur selten vorkommenden, stärker verzweigten Seitenwurzeln sind heller.
Wurzel und Wurzelstock haben einen auf dem Querschnitt schwach gelblichen, in der Regel mehr als die Hälfte, aber weniger als zwei Drittel des Durchmessers einnehmenden Holzkörper, eine weißliche Rinde und ein sehr schmales, braunes Abschlussgewebe. Aus der Rinde tritt an mehreren Stellen weißer Milchsaft aus.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine gelbe bis gelbbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 5 ml Urtinktur werden mit 5 ml Blei(II)‐acetat‐Lösung R versetzt. Die Mischung wird 2 min lang zum Sieden erhitzt und nach dem Abkühlen zentrifugiert. Die überstehende Lösung wird 2-mal mit je 15 ml einer Mischung von 40 Volumteilen 2-Propanol R und 60 Volumteilen Dichlormethan R ausgeschüttelt. Die vereinigten organischen Phasen werden über wasserfreies Natriumsulfat R filtriert. Das Filtrat wird unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Methanol R gelöst. Gegebenenfalls wird die Lösung zentrifugiert.
Referenzlösung: 10 mg Lanatosid C R, 20 mg Cymarin RH und 2 mg Scopoletin R werden in 10 ml wasserfreiem Ethanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 µm) [oder DC-Platte mit Kieselgel R (2 bis 10 µm)]
Fließmittel: Wasser R, Methanol R, Ethylacetat R (8:11:81 V/V/V)
Auftragen: 20 µl [oder 5 µl] Untersuchungslösung und 10 µl [oder 3 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Mischung von 2 Volumteilen einer Lösung von Chloramin T R (30 g · l−1) und 8 Volumteilen einer Lösung von Trichloressigsäure R (250 g · l−1) in Ethanol 96 % R behandelt und 5 bis 10 min lang bei 105 bis 110 °C erhitzt. Die Auswertung erfolgt sofort im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die blau fluoreszierende Zone des Lanatosids C, im mittleren Drittel die gelbbraun fluoreszierende Zone des Cymarins und am Übergang vom mittleren zum oberen Drittel die blau fluoreszierende Zone des Scopoletins.
Das Chromatogramm der Untersuchungslösung zeigt von der Startlinie bis knapp oberhalb der Referenzsubstanz Lanatosid C mehrere schwache, gelbbraun fluoreszierende Zonen, knapp unterhalb der Referenzsubstanz Cymarin eine gelbbraun fluoreszierende Zone, in Höhe der Referenzsubstanz Cymarin eine intensive, gelbbraun fluoreszierende Zone sowie etwa in Höhe der Referenzsubstanz Scopoletin eine gelbbraun fluoreszierende Zone und darüber eine oder zwei blau fluoreszierende Zone/n. Darüber kann eine schwache, gelbbraun fluoreszierende Zone erscheinen.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,895 bis 0,920
Trockenrückstand (H 2.2.6): mindestens 2,5 und höchstens 5,0 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Bei der Definition für das Ausgangsmaterial ist der sehr weit gefasste Erntezeitpunkt „im Spätherbst oder zu Beginn des Austriebs“ auf die Zeit zu Beginn des Austriebs eingegrenzt worden, da bei Ausgangsmaterial, das im Spätherbst geerntet wurde, die Obergrenze der Spezifikation für den Alkaloid-Gehalt oft überschritten wurde.Dies entspricht auch der allgemeinen Regelung in Kapitel H 5.2.2 des HAB, wonach unterirdische Teile zwei- bis mehrjähriger Pflanzen im Frühjahr geerntet werden.
- –
-
Die botanische Beschreibung ist basierend auf aktuellen Pflanzenmustern ergänzt worden.
- –
-
Bei der Gehaltsspezifikation ist die Obergrenze basierend auf den vorliegenden Chargendaten von Urtinkturen aus Ausgangsmaterial, das zu Beginn des Austriebs geerntet wurde, angehoben worden.
- –
-
Bei der DC-Methode sind die HPTLC-Parameter ergänzt worden.
- –
-
Bei der Gehaltsbestimmung ist unter „Eignungsprüfung“ ein abweichender Symmetriefaktor von höchstens 2,0 aufgenommen worden, da der Symmetriefaktor für den Peak von Chelidonin oft außerhalb des üblichen Bereichs von 0,8–1,8 des Ph.-Eur.-Kapitels 2.2.46 lag. Die gleiche Änderung ist bereits in den HAB-Monographien „Chelidonium majus e floribus, ethanol. Digestio“ und „Chelidonium majus Rh“ vorgenommen worden.
Chelidonium majus
Chelidonium
Verwendet wird der frische Wurzelstock mit anhängenden Wurzeln von Chelidonium majus L. zu Beginn des Austriebs.
Beschreibung
Der Wurzelstock hat einen schwach erdigen Geruch.
Die unterirdischen Organe bestehen aus einem vielköpfigen, orangebraunen bis dunkelbraunen, bis 30 mm dicken, 50 bis 100 mm langen Wurzelstock mit unregelmäßiger, borkiger bis tief längs gefurchter Oberfläche und einem mächtigen Wurzelsystem. Das weißliche, hellorangebraune oder dunkelbraune Gewebe des Wurzelstocks ist fein quer geringelt und von schwammig weicher Konsistenz. Er geht in eine ästig verzweigte Pfahlwurzel über, die mit vielen bis zu 5 mm dicken Seitenwurzeln besetzt ist. Die Pfahlwurzel ist längs gefurcht, selten unregelmäßig quer geringelt und matt orangebraun, die Nebenwurzeln sind heller orangebraun. Die äußere Rinde der Wurzel ist tiefgelb bis rotorange, der innere Teil und der deutlich abgesetzte Holzkörper sind hellgrün, heller gelborange bis rötlich-hellbraun. Aus dem Anschnitt von Wurzelstock und Wurzel tritt spontan oder beim Zusammendrücken ein tiefgelber bis oranger Milchsaft aus.
Arzneiformen
Die Urtinktur enthält mindestens 0,06 und höchstens 0,30 % Alkaloide, berechnet als Chelidonin (C20H19NO5; Mr 353,4).
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine braungelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 0,5 g Urtinktur werden mit 15 ml verdünnter Essigsäure R versetzt und 30 min lang im Wasserbad unter Umschwenken erwärmt. Nach dem Abkühlen wird die Mischung in einem Scheidetrichter mit 3 ml konzentrierter Ammoniak-Lösung R und 50 ml Chloroform R versetzt und 15 min lang kräftig geschüttelt. Die abgetrennte organische Phase wird unter vermindertem Druck zur Trockne eingeengt und der Rückstand in 1 ml Methanol R gelöst.
Referenzlösung: 10 mg Berberinchlorid R und 10 mg Chelidonin RH werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ameisensäure R, Wasser R, 1-Propanol R (1:9:90 V/V/V)
Auftragen: 40 µl [oder 10 μl] Untersuchungslösung und 20 µl [oder 5 μl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 15 cm [oder 6 cm]
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 365 nm ausgewertet.
Ergebnis A: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.

Detektion B: Die Platte wird mit verdünntem Dragendorffs Reagenz R und danach mit Natriumnitrit-Lösung R behandelt. Die Auswertung erfolgt im Tageslicht.
Ergebnis B: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
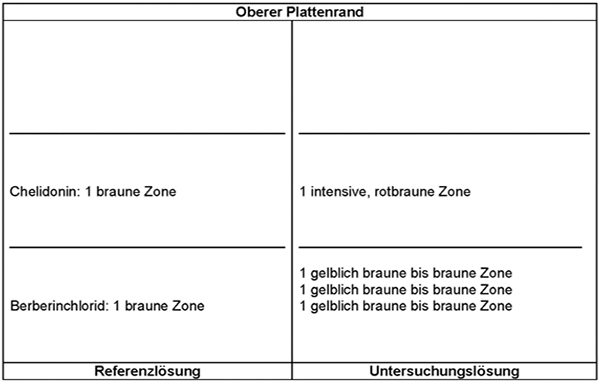
In der Untersuchungslösung sind die drei gelblich braunen bis braunen Zonen auf Höhe des Berberinchlorids und darüber nicht immer gut getrennt.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,900 bis 0,920
Trockenrückstand (H 2.2.6): mindestens 1,2 %
Gehaltsbestimmung
Flüssigchromatographie (2.2.29)
Untersuchungslösung: 0,60 g Urtinktur werden mit einer Mischung von 75 Volumteilen einer Lösung von Trifluoressigsäure R (1,5 ml · l–1) und 25 Volumteilen Methanol R 2 zu 5,0 ml verdünnt. Die Lösung wird über einen Filter der Porenweite 0,45 µm filtriert.
Stammlösung: 10,0 mg Chelidonin RH werden in Methanol R 2 zu 10,0 ml gelöst.
Referenzlösung: 2,0 ml Stammlösung werden mit einer Mischung von 75 Volumteilen einer Lösung von Trifluoressigsäure R (1,5 ml · l–1) und 25 Volumteilen Methanol R 2 zu 20,0 ml verdünnt.
Säule
- –
-
Größe: l = 0,15 m, Ø = 4,6 mm
- –
-
Stationäre Phase: nachsilanisiertes, alkyliertes Kieselgel zur Chromatographie zur Verwendung mit stark wässrigen mobilen Phasen R (4 μm)
- –
-
Temperatur: 20 °C
Mobile Phase
Mobile Phase A: eine Lösung von Trifluoressigsäure R (1,5 ml · l–1)
Mobile Phase B: Acetonitril zur Chromatographie R
| Zeit (min) |
Mobile Phase A (% V/V) |
Mobile Phase B (% V/V) |
|---|---|---|
| 0 – 5 | 73 | 27 |
| 5 – 18 | 73 → 40 | 27 → 60 |
| 18 – 19 | 40 → 0 | 60 → 100 |
| 19 – 20 | 0 → 73 | 100 → 27 |
| 20 – 27 | 73 | 27 |
Durchflussrate: 1,0 ml · min–1
Detektion: Spektrometer bei 291 nm
Einspritzen: 25 μl
Relative Retention (bezogen auf Chelidonin, tR etwa 11 min)
| – Magnoflorin: | etwa 0,31 |
| – Alkaloid 1: | etwa 0,40 |
| – Alkaloid 2: | etwa 0,61 |
| – Protopin: | etwa 0,81 |
| – Allocryptopin: | etwa 0,90 |
| – Coptisin: | etwa 1,10 |
| – Alkaloid 3: | etwa 1,15 |
| – Sanguinarin: | etwa 1,29 |
| – Berberin: | etwa 1,38 |
| – Chelerythrin: | etwa 1,52 |
Eignungsprüfung: Referenzlösung
- –
-
Wiederholpräzision: höchstens 2,0 % relative Standardabweichung der Fläche des Chelidonin-Peaks nach 6 Einspritzungen
- –
-
Symmetriefaktor: höchstens 2,0 für den Peak von Chelidonin
Der Gehalt an Gesamtalkaloiden in Prozent (m/m), berechnet als Chelidonin, wird nach folgender Formel berechnet:
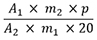
| A 1 | = Summe der Flächen aller Alkaloid-Peaks von Magnoflorin bis Chelerythrin im Chromatogramm der Untersuchungslösung |
| A 2 | = Fläche des Peaks von Chelidonin im Chromatogramm der Referenzlösung |
| m 1 | = Einwaage der Urtinktur in Gramm |
| m 2 | = Masse der Referenzsubstanz Chelidonin RH in Gramm |
| p | = Prozentgehalt an Chelidonin in der Referenzsubstanz Chelidonin RH |
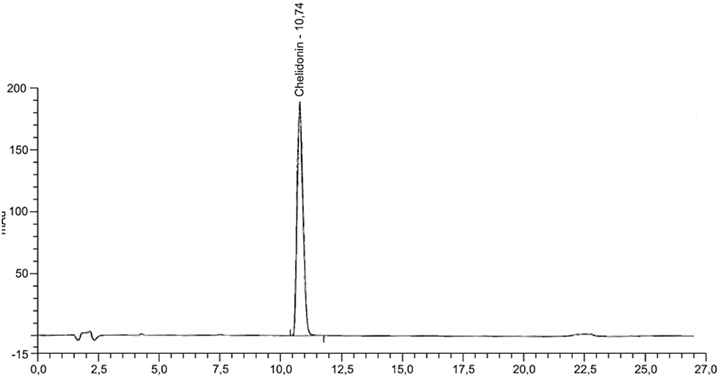
Beispielchromatogramm 1: Referenzlösung Chelidonin (0,1 mg · ml−1)
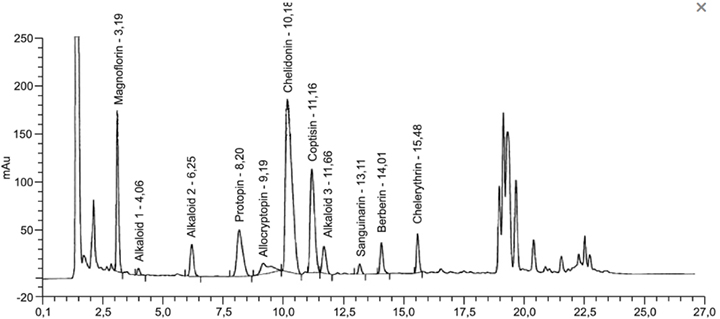
Beispielchromatogramm 2: Untersuchungslösung Chelidonium majus Ø, Vorschrift 3a
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Bei der Urtinktur ist der unspezifische Geruch gestrichen worden.
- –
-
Bei der DC-Methode sind in den DC-Kästen die Zonen an die Untersuchungsergebnisse der aktuellen Überprüfung der DC-Methode unter TLC- und HPTLC-Bedingungen angepasst und die HPTLC-Parameter ergänzt worden.
Chelidonium majus e floribus, ethanol. Digestio
Chelidonium, Flos, ethanol. Digestio
Verwendet werden die frischen Blüten von Chelidonium majus L.
Beschreibung
Die gelben, radiären Blüten stehen in wenigblütigen, langgestielten, lockeren Dolden. Sie haben zwei blassgelbe, verstreut behaarte, hinfällige Kelchblätter, vier breit-eiförmige Kronblätter und zahlreiche gelbe Staubblätter. Der kurze, dicke Griffel hat eine zweilappige Narbe. Der längliche, aus zwei Fruchtblättern gebildete Fruchtknoten ist einfächerig und hat zahlreiche, zweireihig angeordnete Samenanlagen.
Arzneiformen
Die Urtinktur enthält mindestens 0,02 und höchstens 0,10 % Alkaloide, berechnet als Chelidonin (C20H19NO5; Mr 353,4).
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 18c
Eigenschaften
Die Urtinktur ist eine braungelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 10 ml Urtinktur werden auf dem Wasserbad auf etwa 5 ml eingeengt. Der Rückstand wird mit 3 ml verdünnter Ammoniak-Lösung R 1 versetzt und die Mischung mit 10 ml Ether R ausgeschüttelt. Die abgetrennte organische Phase wird über wasserfreiem Natriumsulfat R getrocknet, dekantiert, unter vermindertem Druck zur Trockne eingeengt und der Rückstand in 1 ml Methanol R aufgenommen.
Referenzlösung: 10 mg Berberinchlorid R und 20 mg Methylrot R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ameisensäure R, Wasser R, 1-Propanol R (1:9:90 V/V/V)
Auftragen: 40 µl [oder 7 µl] Untersuchungslösung und 10 µl [oder 3 µl] Referenzlösung; bandförmig 20 mm [oder 8 mm]
Laufstrecke: 10 cm [oder 6 cm]
Trocknen: ca. 5 min im Warmluftstrom
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 365 nm ausgewertet.
Ergebnis A:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
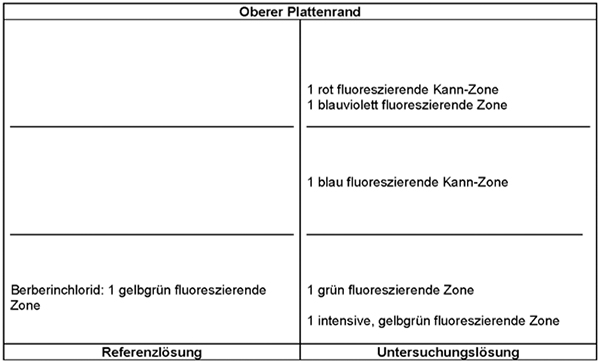
Detektion B: Die Platte wird mit verdünntem Dragendorffs Reagenz R und danach mit Natriumnitrit-Lösung R behandelt. Die Auswertung erfolgt sofort im Tageslicht.
Ergebnis B:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
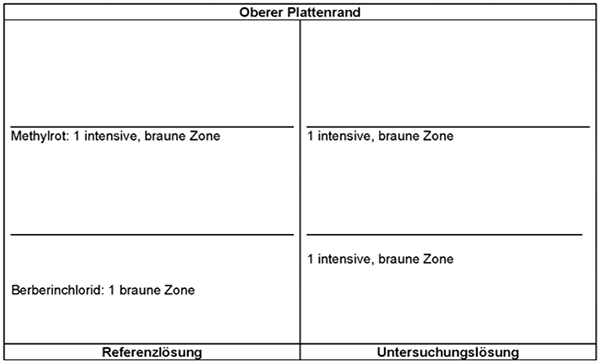
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,900 bis 0,915
Trockenrückstand (H 2.2.6): mindestens 1,4 %
Gehaltsbestimmung
Flüssigchromatographie (2.2.29)
Untersuchungslösung: 1,00 g Urtinktur werden mit einer Mischung von 75 Volumteilen einer Lösung von Trifluoressigsäure R (1,5 ml · l–1) und 25 Volumteilen Methanol R 2 zu 5,0 ml verdünnt. Die Lösung wird über einen Filter der Porenweite 0,45 µm filtriert.
Stammlösung: 10,0 mg Chelidonin RH werden in Methanol R 2 zu 10,0 ml gelöst.
Referenzlösung: 2,0 ml Stammlösung werden mit einer Mischung von 75 Volumteilen einer Lösung von Trifluoressigsäure R (1,5 ml · l–1) und 25 Volumteilen Methanol R 2 zu 20,0 ml verdünnt.
Säule
- –
-
Größe: l = 0,15 m, Ø = 4,6 mm
- –
-
Stationäre Phase: nachsilanisiertes, alkyliertes Kieselgel zur Chromatographie zur Verwendung mit stark wässrigen mobilen Phasen R (4 μm)
- –
-
Temperatur: 20 °C
Mobile Phase
Mobile Phase A: eine Lösung von Trifluoressigsäure R (1,5 ml · l–1)
Mobile Phase B: Acetonitril zur Chromatographie R
| Zeit (min) |
Mobile Phase A (% V/V) |
Mobile Phase B (% V/V) |
|---|---|---|
| 0 – 5 | 73 | 27 |
| 5 – 18 | 73 → 40 | 27 → 60 |
| 18 – 19 | 40 → 0 | 60 → 100 |
| 19 – 20 | 0 → 73 | 100 → 27 |
| 20 – 27 | 73 | 27 |
Durchflussrate: 1,0 ml · min–1
Detektion: Spektrometer bei 291 nm
Einspritzen: 25 μl
Relative Retention (bezogen auf Chelidonin, t R etwa 11 min)
| – Protopin: | etwa 0,81 |
| – Alkaloid 1: | etwa 1,03 |
| – Coptisin: | etwa 1,06 |
| – Alkaloid 2: | etwa 1,13 |
| – Alkaloid 3: | etwa 1,18 |
| – Berberin: | etwa 1,31 |
Hinweis: Nicht alle aufgeführten Peaks müssen vorhanden sein und weitere Peaks können auftreten.
Eignungsprüfung: Referenzlösung
- –
-
Wiederholpräzision: höchstens 2,0 % relative Standardabweichung der Fläche des Chelidonin-Peaks nach 6 Einspritzungen
- –
-
Symmetriefaktor: höchstens 2,0 für den Peak von Chelidonin
Der Gehalt an Gesamtalkaloiden in Prozent (m/m), berechnet als Chelidonin, wird nach folgender Formel berechnet:
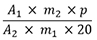
| A 1 | = Summe der Flächen aller Alkaloid-Peaks mit einer relativen Retention von 0,8 bis 1,5 im Chromatogramm der Untersuchungslösung |
| A 2 | = Fläche des Peaks von Chelidonin im Chromatogramm der Referenzlösung |
| m 1 | = Einwaage der Urtinktur in Gramm |
| m 2 | = Masse der Referenzsubstanz Chelidonin RH in Gramm |
| p | = Prozentgehalt an Chelidonin in der Referenzsubstanz Chelidonin RH |
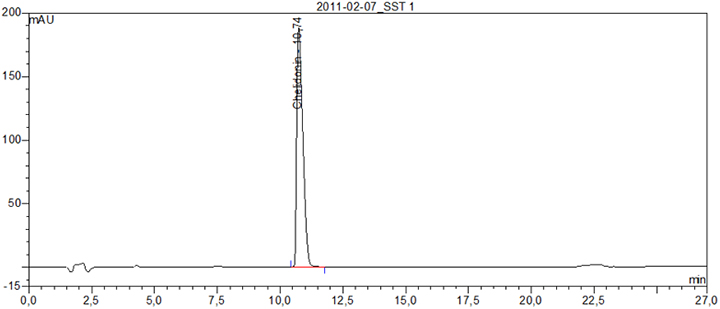
Beispielchromatogramm 1: Referenzlösung Chelidonin (0,1 mg ∙ ml-1)
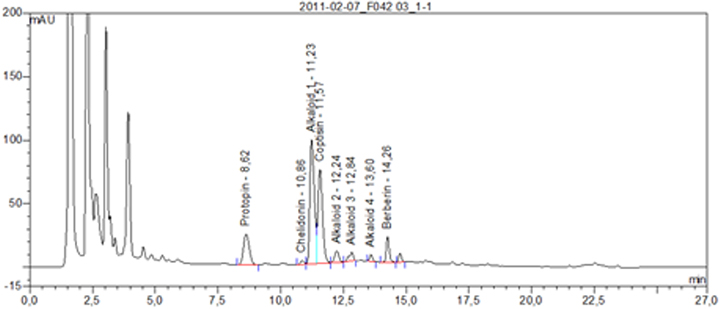
Beispielchromatogramm 2: Untersuchungslösung Chelidonium majus e floribus, ethanolische Digestio Ø, Vorschrift 18c
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Bei der Definition für das Ausgangsmaterial ist der sehr weit gefasste Erntezeitpunkt „im Spätherbst oder zu Beginn des Austriebs“ auf die Zeit zu Beginn des Austriebs eingegrenzt worden, da bei Ausgangsmaterial, das im Spätherbst geerntet wurde, die Obergrenze der Spezifikation für den Alkaloid-Gehalt oft überschritten wurde.
Dies entspricht auch der allgemeinen Regelung in Kapitel H 5.2.2 des HAB, wonach unterirdische Teile zwei- bis mehrjähriger Pflanzen im Frühjahr geerntet werden. - –
-
Die botanische Beschreibung ist basierend auf aktuellen Pflanzenmustern ergänzt worden.
- –
-
Bei der DC-Methode sind aufgrund einer aktuellen Überprüfung unter TLC- und HPTLC-Bedingungen folgende Änderungen vorgenommen worden:
- –
-
Bei der TLC ist die Laufstrecke von 15 cm auf 10 cm verkürzt worden, um die Entwicklungszeit zu reduzieren. Dadurch ergeben sich keine Änderungen im DC.
- –
-
Die HPTLC-Parameter sind ergänzt worden.
- –
-
Im DC-Kasten für Detektion A ist in der Untersuchungslösung die zweite gelbgrün fluoreszierende Zone (im Chromatogramm von unten) von oberhalb auf Höhe des Berberinchlorids verschoben worden.
Chelidonium majus Rh
Chelidonium Rh
Verwendet wird der frische Wurzelstock mit anhängenden Wurzeln von Chelidonium majus L. zu Beginn des Austriebs.
Beschreibung
Der Wurzelstock hat einen schwach erdigen Geruch.
Die unterirdischen Organe bestehen aus einem vielköpfigen, orangebraunen bis dunkelbraunen, bis 30 mm dicken, 50 bis 100 mm langen Wurzelstock mit unregelmäßiger, borkiger bis tief längs gefurchter Oberfläche und einem mächtigen Wurzelsystem. Das weißliche, hell orangebraune oder dunkelbraune Gewebe des Wurzelstocks ist fein quer geringelt und von schwammig weicher Konsistenz. Er geht in eine ästig verzweigte Pfahlwurzel über, die mit vielen bis zu 5 mm dicken Seitenwurzeln besetzt ist. Die Pfahlwurzel ist längs gefurcht, selten unregelmäßig quer geringelt und matt orangebraun, die Nebenwurzeln sind heller orangebraun. Die äußere Rinde der Wurzel ist tiefgelb bis rotorange, der innere Teil und der deutlich abgesetzte Holzkörper sind hellgrün, heller gelborange bis rötlich hellbraun. Aus dem Anschnitt von Wurzelstock und Wurzel tritt spontan oder beim Zusammendrücken ein tiefgelber bis orangefarbener Milchsaft aus.
Arzneiformen
Die Urtinktur enthält mindestens 0,10 und höchstens 0,50 % Alkaloide, berechnet als Chelidonin (C20H19NO5; Mr 353,4).
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 21
Eigenschaften
Die Urtinktur ist eine braune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 0,5 g Urtinktur werden mit 15 ml verdünnter Essigsäure R versetzt und 30 min lang im Wasserbad unter Umschwenken erwärmt. Nach dem Abkühlen wird die Mischung in einem Scheidetrichter mit 3 ml konzentrierter Ammoniak-Lösung R und 50 ml Chloroform R versetzt und 15 min lang kräftig geschüttelt. Die abgetrennte organische Phase wird unter vermindertem Druck zur Trockne eingeengt und der Rückstand in 1 ml Methanol R gelöst.
Referenzlösung: 10 mg Berberinchlorid R und 10 mg Chelidonin RH werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ameisensäure R, Wasser R, 1-Propanol R (1:9:90 V/V/V)
Auftragen: 60 µl [oder 15 µl] Untersuchungslösung und 10 µl [oder 3 µl] Referenzlösung; bandförmig 20 mm [oder 8 mm]
Laufstrecke: 10 cm [oder 6 cm]
Trocknen: ca. 5 min im Warmluftstrom
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 365 nm ausgewertet.
Ergebnis A: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
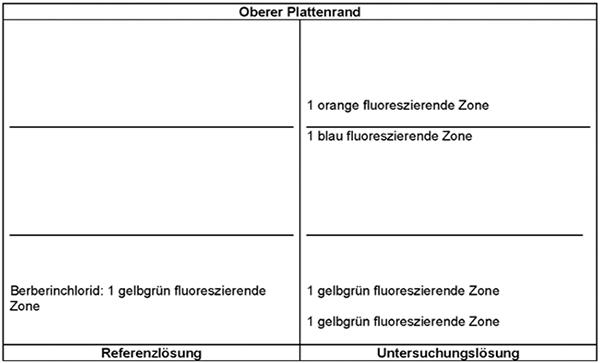
Detektion B: Die Platte wird mit verdünntem Dragendorffs Reagenz R und danach mit Natriumnitrit-Lösung R behandelt. Die Auswertung erfolgt sofort im Tageslicht.
Ergebnis B: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
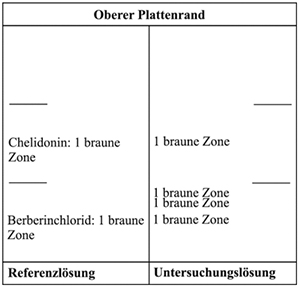
Prüfung auf Reinheit
Relative Dichte (2.2.5): 1,015 bis 1,055
Trockenrückstand (H 2.2.6): mindestens 3,0 %
Gehaltsbestimmung
Flüssigchromatographie (2.2.29)
Untersuchungslösung: 0,60 g Urtinktur werden mit einer Mischung von 75 Volumteilen einer Lösung von Trifluoressigsäure R (1,5 ml ∙ l–1) und 25 Volumteilen Methanol R 2 zu 5,0 ml verdünnt. Die Lösung wird über einen Filter der Porenweite 0,45 µm filtriert.
Stammlösung: 10,0 mg Chelidonin RH werden in Methanol R 2 zu 10,0 ml gelöst.
Referenzlösung: 2,0 ml Stammlösung werden mit einer Mischung von 75 Volumteilen einer Lösung von Trifluoressigsäure R (1,5 ml ∙ l–1) und 25 Volumteilen Methanol R 2 zu 20,0 ml verdünnt.
Säule
- –
-
Größe: l = 0,15 m, Ø = 4,6 mm
- –
-
Stationäre Phase: nachsilanisiertes, alkyliertes Kieselgel zur Chromatographie zur Verwendung mit stark wässrigen mobilen Phasen R (4 μm)
- –
-
Temperatur: 20 °C
Mobile Phase
Mobile Phase A: eine Lösung von Trifluoressigsäure R (1,5 ml ∙ l–1)
Mobile Phase B: Acetonitril zur Chromatographie R
| Zeit (min) |
Mobile Phase A (% V/V) |
Mobile Phase B (% V/V) |
|---|---|---|
| 0 – 5 | 73 | 27 |
| 5 – 18 | 73 → 40 | 27 → 60 |
| 18 – 19 | 40 → 0 | 60 → 100 |
| 19 – 20 | 0 → 73 | 100 → 27 |
| 20 – 27 | 73 | 27 |
Durchflussrate: 1,0 ml · min–1
Detektion: Spektrometer bei 291 nm
Einspritzen: 25 μl
Relative Retention (bezogen auf Chelidonin, tR etwa 11 min)
| – Alkaloid 1: | etwa 0,28 |
| – Alkaloid 2: | etwa 0,38 |
| – Alkaloid 3: | etwa 0,58 |
| – Alkaloid 4: | etwa 0,61 |
| – Protopin: | etwa 0,84 |
| – Allocryptopin: | etwa 0,95 |
| – Coptisin: | etwa 1,07 |
| – Alkaloid 5: | etwa 1,10 |
| – Sanguinarin: | etwa 1,20 |
| – Berberin: | etwa 1,28 |
| – Chelerythrin: | etwa 1,40 |
Hinweis: Nicht alle aufgeführten Peaks müssen vorhanden sein und weitere Peaks können auftreten.
Eignungsprüfung: Referenzlösung
- –
-
Wiederholpräzision: höchstens 2,0 % relative Standardabweichung der Fläche des Chelidonin-Peaks nach 6 Einspritzungen
- –
-
Symmetriefaktor: höchstens 2,0 für den Peak von Chelidonin
Der Gehalt an Gesamtalkaloiden in Prozent (m/m), berechnet als Chelidonin, wird nach folgender Formel berechnet:
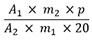
| A 1 | = Summe der Flächen aller Alkaloid-Peaks mit einer relativen Retention von 0,25 bis 1,60 im Chromatogramm der Untersuchungslösung |
| A 2 | = Fläche des Peaks von Chelidonin im Chromatogramm der Referenzlösung |
| m 1 | = Einwaage der Urtinktur in Gramm |
| m 2 | = Masse der Referenzsubstanz Chelidonin RH in Gramm |
| p | = Prozentgehalt an Chelidonin in der Referenzsubstanz Chelidonin RH |
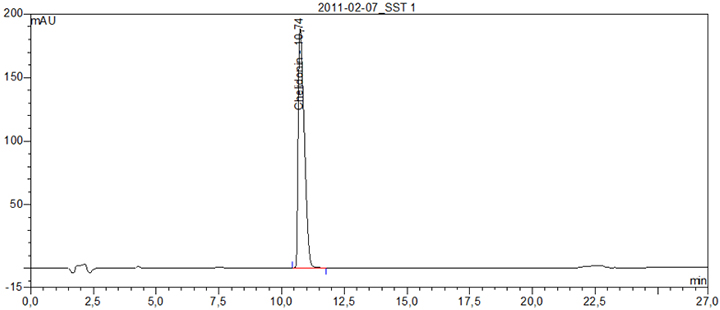
Beispielchromatogramm 1: Referenzlösung Chelidonin (0,1 mg ∙ ml-1)
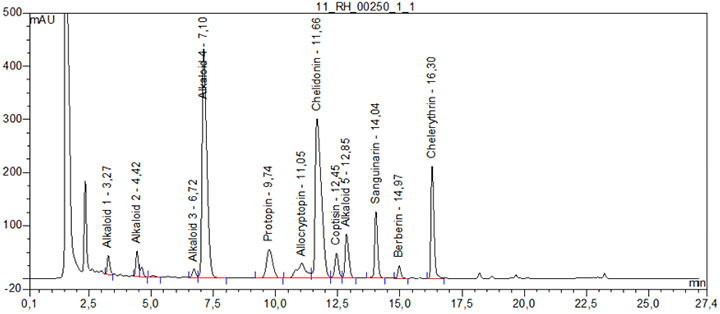
Beispielchromatogramm 2: Untersuchungslösung Chelidonium majus Rh Ø, Vorschrift 21
Lagerung
Dicht verschlossen, vor Licht geschützt
Anmerkungen zur Monographie:
Bei der Gehaltsbestimmung wird aufgrund von Problemen bei der Endpunkterkennung statt Methanol R nach Zusatz der Acetat Pufferlösung Ethanol 50 % R und nach Zusatz der Indikatorlösung Ethanol 96 % R eingesetzt. Hierdurch wird eine leichtere homogene Verteilung der Indikatorlösung und Erhöhung der Stabilität durch Solvatationseffekte erreicht.
Cerium oxalicum
Ce2 (C2O4)3 · x H2O
M r 544
Verwendet wird Cer(III)-oxalat, das mindestens 77 und höchstens 87 % Ce2 (C2O4)3 enthält.
Eigenschaften
Weißes bis schwach gelbliches, kristallines Pulver; unlöslich in Wasser und Ethanol, löslich in verdünnten Mineralsäuren
Prüfung auf Identität
- A.
-
0,1 g Substanz werden mit 2 ml verdünnter Natriumhydroxid-Lösung R versetzt. Die Mischung wird zum Sieden erhitzt und anschließend filtriert. Wird das Filtrat mit 5 ml verdünnter Essigsäure R und 1 ml Calciumchlorid-Lösung R versetzt, entsteht ein weißer, kristalliner Niederschlag, der in Salzsäure R löslich ist.
- B.
-
50 mg Substanz werden in 4 ml verdünnter Salzsäure R unter Erwärmen gelöst. Wird die Mischung mit 1 ml Wasserstoffperoxid-Lösung 3 % R und 4 ml verdünnter Ammoniak-Lösung R 1 versetzt, entsteht ein oranger Niederschlag.
Prüfung auf Reinheit
Prüflösung: 2,5 g Substanz werden 2 h lang bei etwa 600 °C geglüht. Der Rückstand wird mit 5 ml verdünnter Salpetersäure R versetzt, die Mischung zum Sieden erhitzt und über ein hartes Filterpapier filtriert. Das Filter wird 3‑mal mit je 10 ml destilliertem Wasser R gewaschen. Das mit der Waschflüssigkeit vereinigte Filtrat wird mit verdünnter Natriumhydroxid-Lösung R unter Verwendung von Universal-Indikator-Papier RH neutralisiert und mit destilliertem Wasser R zu 50,0 ml verdünnt.
Chlorid (2.4.4): 0,125 g Substanz werden mit 10 ml Wasser R versetzt. Die Mischung wird 5 min lang zum Sieden erhitzt und nach dem Erkalten filtriert. Das Filtrat wird durch Nachwaschen des Filters mit Wasser R zu 15 ml ergänzt. Diese Lösung muss der Grenzprüfung auf Chlorid entsprechen (400 ppm).
Sulfat (2.4.13): 7,5 ml Prüflösung werden mit destilliertem Wasser R zu 15 ml verdünnt. Diese Lösung muss der Grenzprüfung auf Sulfat entsprechen (400 ppm).
Carbonat: 0,1 g Substanz werden in einem Reagenzglas mit 0,5 ml kohlendioxidfreiem Wasser R durchfeuchtet. Die Mischung wird mit 2,5 ml verdünnter Essigsäure R versetzt und das Reagenzglas rasch mit einem durchbohrten Stopfen verschlossen, der ein 2‑mal im rechten Winkel gebogenes Glasrohr trägt, dessen anderes Ende in 5 ml Bariumhydroxid-Lösung R taucht. Nach 5 Minuten langem Erwärmen im Wasserbad muss die Bariumhydroxid-Lösung R klar sein (2.2.1).
Schwermetalle (2.4.8): 12 ml Prüflösung müssen der Grenzprüfung A auf Schwermetalle entsprechen. Zur Herstellung der Referenzlösung wird die Blei-Lösung (2 ppm Pb) R verwendet (40 ppm).
Calcium (2.4.3): 5 ml Prüflösung werden mit destilliertem Wasser R zu 15 ml verdünnt. Diese Lösung muss der Grenzprüfung auf Calcium entsprechen (400 ppm).
Ammonium (2.4.1): 50 mg Substanz werden mit 10 ml Wasser R versetzt. Die Mischung wird 5 min lang zum Sieden erhitzt und nach dem Erkalten filtriert. Das Filtrat wird unter Nachwaschen des Filters mit Wasser R zu 15 ml ergänzt. Diese Lösung muss der Grenzprüfung A auf Ammonium entsprechen (200 ppm).
Säureunlösliche Verunreinigungen: höchstens 0,5 % 2,0 g Substanz werden mit einer Mischung von 30 ml Salzsäure R 1 und 30 ml Wasser R versetzt. Diese Mischung wird zum Sieden erhitzt und anschließend über einen tarierten Glassintertiegel Nr. 16 (2.1.2) filtriert. Der Rückstand wird zunächst mit 10 ml heißer verdünnter Salzsäure R und anschließend 3‑mal mit je 5 ml Wasser R gewaschen. Der Tiegel mit dem Rückstand wird bei 105 bis 110 °C bis zur Massekonstanz getrocknet.
Gehaltsbestimmung
50,0 mg Substanz werden in einem 100-ml-Erlenmeyerkolben in 5 ml Salzsäure R 1 unter Erwärmen gelöst. Die Lösung wird mit 20 ml Wasserstoffperoxid-Lösung 30 % R versetzt, etwa 30 min lang zum Rückfluss erhitzt und anschließend auf 5 bis 10 ml, jedoch nicht zur Trockne eingeengt. Nach dem Abkühlen wird der Rückstand mit 5 ml Wasser R und 10,0 ml Natriumedetat-Lösung (0,05 mol · l−1) versetzt. Die Mischung wird 10 min lang zum Sieden erhitzt, anschließend abgekühlt und mit Natriumacetat R auf einen pH-Wert von 4 eingestellt. Nach Zusatz von 10 ml Acetat-Pufferlösung pH 4,6 R, 30 ml Ethanol 50 % R und 1 ml einer Lösung von 6 mg Dithizon R in 20 ml Ethanol 96 % R wird die Lösung mit Zinksulfat-Lösung (0,05 mol · l−1) bis zum Farbumschlag nach reinem Rosarot titriert.
1 ml Natriumedetat-Lösung (0,05 mol · l−1) entspricht 13,608 mg Ce2(C2O4)3.
Arzneiformen
Die 1. Dezimalverreibung enthält mindestens 7,3 und höchstens 9,1 % Ce2(C2O4)3.
Herstellung
Verreibungen nach Vorschrift 6
Eigenschaften
Die 1. Dezimalverreibung ist ein weißes Pulver.
Prüfung auf Identität
1 g der 1. Dezimalverreibung wird mit 10 ml Wasser R versetzt, die Mischung 5 Minuten lang geschüttelt und anschließend zentrifugiert. Dieser Waschvorgang wird wiederholt. Der Rückstand gibt die Identitätsreaktion A der Substanz.
0,5 g der 1. Dezimalverreibung geben die Identitätsreaktion B der Substanz.
Gehaltsbestimmung
0,500 g der 1. Dezimalverreibung werden bei 600 °C verascht. Der Rückstand wird in 5 ml Salzsäure R aufgenommen und die Mischung zum Sieden erhitzt. Nach dem Abkühlen wird die Mischung mit 5 ml Wasserstoffperoxid-Lösung 30 % R versetzt und erneut zum Sieden erhitzt. Der Zusatz von Wasserstoffperoxid-Lösung 30 % R wird gegebenenfalls wiederholt, bis die Lösung klar und annähernd farblos geworden ist. Nach dem Abkühlen wird die Lösung mit Wasser R in einen 200-ml-Erlenmeyerkolben überspült und mit 10,0 ml Natriumedetat-Lösung (0,05 mol · l−1) versetzt. Die weitere Bestimmung erfolgt wie bei der Substanz unter „Gehaltsbestimmung“ angegeben.
Anmerkungen zur Monographie:
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Änderung des Reagenzes „Cumarin RH“ auf „Cumarin R“ aus Gründen der Vereinheitlichung zu anderen HAB-Monographien
- –
-
Detektion A: Cumarin ist bei 254 nm nicht sichtbar, sondern erst nach Besprühen mit methanolischer Kaliumhydroxid-Lösung und Auswertung bei 365 nm
- –
-
Detektion B: Änderung des DAB-Reagenzes „methanolische Kaliumhydroxid-Lösung RN“ auf „methanolische Kaliumhydroxid-Lösung RH“ aufgrund der Streichung im DAB (Reagenz wird ausschließlich für die HAB-Monographien benötigt) und Aufnahme ins HAB
- –
-
Trockenrückstand: Anpassung der Spezifikation basierend auf aktuell vorliegenden Chargendaten
Cinnamomum verum
Cinnamomum
Die Droge muss der Monographie Zimtrinde (Ph. Eur.) entsprechen.
Arzneiformen
Herstellung
Urtinktur aus der unmittelbar zuvor pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine tiefrotbraune Flüssigkeit mit charakteristischem, aromatischem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 20 mg Cumarin R werden in Methanol R zu 100,0 ml gelöst (Stammlösung).
2,0 ml Cumarin-Stammlösung, 50 µl Zimtaldehyd R und 10 µl Eugenol R werden gemischt und die Mischung in Methanol R zu 10,0 ml gelöst.
Platte: DC-Platte mit Kieselgel F254 R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Toluol R
Auftragen: 10 µl [oder 3 µl] für die „Prüfung auf Reinheit“ und 30 µl [oder 10 µl] Untersuchungslösung für die Prüfung auf Identität und 10 µl [oder 3 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]; 2-mal mit 5 min langem Zwischentrocknen
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 254 nm ausgewertet.
Ergebnis A: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die Zone des Zimtaldehyds und darüber die schwächere Zone des Eugenols.
Das Chromatogramm der Untersuchungslösung zeigt knapp oberhalb des Starts sowie in Höhe der Referenzsubstanzen Zimtaldehyd und Eugenol je eine Zone.
Detektion B: Anschließend wird die Platte mit methanolischer Kaliumhydroxid-Lösung RH besprüht. Die Auswertung erfolgt im ultravioletten Licht bei 365 nm.
Ergebnis B: Im Chromatogramm der Referenzlösung erscheint knapp oberhalb des Starts die grünlich blau fluoreszierende Zone des Cumarins.
Das Chromatogramm der Untersuchungslösung zeigt zwischen Start und der Referenzsubstanz Zimtaldehyd eine schwache grünlich und eine intensiver hellblau fluoreszierende Zone.
Detektion C: Anschließend wird die Platte mit Phloroglucin-Lösung R besprüht.
Ergebnis C: Im Chromatogramm der Referenzlösung erscheint die Zone des Zimtaldehyds gelblich braun.
Im Chromatogramm der Untersuchungslösung erscheinen die im ultravioletten Licht bei 365 nm intensiv hellblau fluoreszierende Zone rosaviolett und die Zone in Höhe der Referenzsubstanz Zimtaldehyd gelblich orangebraun.
Die Chromatogramme werden für die „Prüfung auf Reinheit“ aufbewahrt.
Prüfung auf Reinheit
Cinnamomum aromaticum Nees: Die Prüfung erfolgt mit Hilfe der unter „Prüfung auf Identität“ erhaltenen Chromatogramme. Die im Chromatogramm der 10 µl [oder 3 µl] Untersuchungslösung in Höhe der Referenzsubstanz Cumarin liegende Zone darf nach dem Besprühen mit methanolischer Kaliumhydroxid-Lösung RH, jedoch vor dem Besprühen mit Phloroglucin-Lösung R nicht intensiver sein als die der Referenzsubstanz.
Relative Dichte (2.2.5): 0,890 bis 0,900
Trockenrückstand (H 2.2.6): mindestens 0,8 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Ergänzung der Gehaltsspezifikation auf Gesamtbufadienolide, berechnet als Proscillaridin
- –
-
Streichung der unspezifischen nasschemischen Identitätsprüfungen und der nasschemischen Reinheitsprüfung auf Drimia maritima (L.) Stearn s. l. rotschalig, da die Identitäts- und Reinheitsprüfung mittels DC ausreichend ist.
- –
-
DC-Methode: Ergänzung der HPTLC-Bedingungen und Ersatz der DC-Beschreibung durch einen DC-Kasten
- –
-
Umformulierung der dünnschichtchromatographischen Reinheitsprüfung auf Drimia maritima (L.) Stearn s. l. rotschalig für eine eindeutige Unterscheidung von Drimia maritima (L.) Stearn s. str. weißschalig
- –
-
Aufnahme der Gehaltsbestimmungsmethode auf Gesamtbufadienolide, berechnet als Proscillaridin
Drimia maritima, ethanol. Digestio
Urginea maritima3, ethanol. Digestio
Scilla alba4, ethanol. Digestio
Verwendet werden die frischen fleischigen Zwiebelschuppen der weißschaligen Unterart von Drimia maritima (L.) Stearn s. str. [Syn. Urginea maritima (L.) Baker s. str.] mit eindeutig nachweisbarem Glucoscillaren-A- oder Scillaren-A-Anteil sowie eindeutig nachweisbarem Proscillaridin-Anteil.
Beschreibung
Die Zwiebel hat einen Durchmesser von 50 bis 200 mm, in der Regel 100 bis 150 mm. Die äußeren Zwiebelschuppen sind trockenhäutig, dünn und rotbraun. Die bis zu 40 inneren mehr oder weniger fleischigen Zwiebelschuppen sind grünlich weiß bis fast farblos.
Arzneiformen
Die Urtinktur enthält mindestens 0,01 bis 0,04 % Bufadienolide, berechnet als Proscillaridin (C30H42O8;Mr 530,7).
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 18c
Eigenschaften
Die Urtinktur ist eine blassgelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung:
10 ml Urtinktur werden unter vermindertem Druck auf etwa 3 ml eingeengt. Der Rückstand wird mit 20 ml Wasser R und 10 ml Blei(II)-acetat-Lösung R versetzt, die Mischung geschüttelt und nach 5 min zentrifugiert. Der abgetrennte Überstand wird mit 10 ml Natriummonohydrogenphosphat-Lösung R versetzt, die Mischung geschüttelt und nach 5 Minuten zentrifugiert. Der abgetrennte Überstand wird 3-mal mit je 30 ml einer Mischung von 5 Volumteilen Ethylacetat R und 1 Volumteil 2-Propanol R ausgeschüttelt und falls erforderlich zentrifugiert. Die vereinigten organischen Phasen werden mit etwa 2 g wasserfreiem Natriumsulfat R getrocknet und filtriert. Das Filtrat wird unter vermindertem Druck zur Trockne eingedampft und der Rückstand in 1 ml Methanol R aufgenommen.
Referenzlösung: 5 mg Lanatosid C R und 5 mg Proscillaridin RH werden in 1 ml einer Mischung gleicher Volumteile Ethylacetat R und Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Wasser R, Methanol R, Ethylacetat R (8:11:81 V/V/V)
Auftragen: 30 µl [oder 6 µl] Untersuchungslösung und 10 µl [oder 2 µl] Referenzlösung, bandförmig 20 mm [oder 10 mm]
Laufstrecke: 15 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 min im ultravioletten Licht bei 365 nm auch für die Reinheitsprüfung „Drimia maritima (L.) Stearn s. l. rotschalig [Syn.: Urginea maritima (L.) Baker s. l. rotschalig“].
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
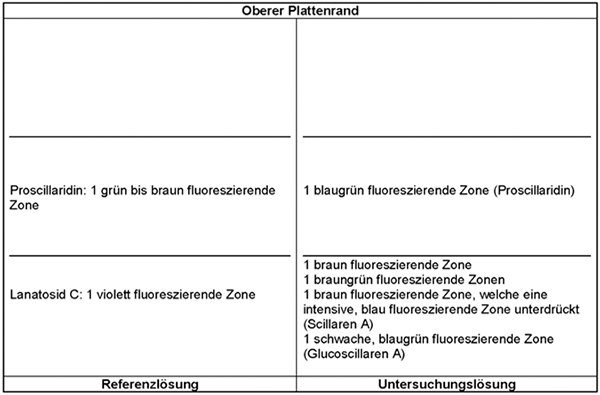
Prüfung auf Reinheit
Drimia maritima (L.) Stearn s. l. rotschalig [Syn.: Urginea maritima (L.) Baker s. l., rotschalig]:
Die unter „Prüfung auf Identität“ erhaltenen Chromatogramme werden ausgewertet. Das Chromatogramm der Untersuchungslösung muss etwa in Höhe der Referenzsubstanz Lanatosid C eine braun fluoreszierende Zone zeigen, welche eine intensive, blau fluoreszierende Zone unterdrückt. Diese braun fluoreszierende Zone erscheint bei Drimia maritima (L.) Stearn s. l. rotschalig [Syn.: Urginea maritima (L.) Baker s. l. rotschalig] nicht.
Relative Dichte (2.2.5): 0,910 bis 0,930
Trockenrückstand (H 2.2.6): mindestens 4,0 und höchstens 7,0 %
Gehaltsbestimmung
Flüssigchromatographie (2.2.29)
Untersuchungslösung:
1,00 g Urtinktur wird mit einer Mischung von 80 Volumteilen Wasser R und 20 Volumteilen Methanol R2 zu 5,0 ml versetzt und durch einen Membranfilter5 (nominale Porengröße 0,45 μm) filtriert.
Referenzlösung:
Stammlösung: 5,0 mg Proscillaridin RH werden (unter Berücksichtigung des tatsächlichen Gehalts) in Methanol R2 zu 10,0 ml gelöst.
Durch Verdünnen mit einer Mischung aus 80 Volumteilen Wasser R und 20 Volumteilen Methanol R2 werden 6 Referenzlösungen mit folgenden Konzentrationen hergestellt:
| Volumen der Stammlösung (μl/10,0 ml) |
|
|---|---|
| Referenz 1 | 50 |
| Referenz 2 | 100 |
| Referenz 3 | 200 |
| Referenz 4 | 300 |
| Referenz 5 | 500 |
| Referenz 6 | 800 |
Säule
- –
-
Größe: l = 0,150 m; Ø 4,6 mm
- –
-
Stationäre Phase: octadecylsilyliertes Kieselgel zur Chromatographie R (3 μm)6
- –
-
Temperatur: 25 °C
Mobile Phase
Mobile Phase A: Wasser R
Mobile Phase B: Acetonitril R
| Zeit (min) |
Mobile Phase A (% V/V) |
Mobile Phase B (% V/V) |
|---|---|---|
| 0 – 5 | 80 | 20 |
| 5 – 30 | 80 → 60 | 20 → 40 |
| 30 – 35 | 60 → 0 | 40 → 100 |
| 35 – 40 | 0 | 100 |
| 40 – 45 | 0 → 80 | 100 → 20 |
| 45 – 50 | 80 | 20 |
Durchflussrate: 1,0 ml · min-1
Detektion: Spektrometer bei 300 nm
Einspritzen: 10 μl
Relative Retention (bezogen auf Proscillaridin, tR etwa 26 min)
- –
-
Bufadienolid 1: etwa 0,52
- –
-
Bufadienolid 2: etwa 0,61
- –
-
Bufadienolid 3: etwa 0,65
- –
-
Bufadienolid 4: etwa 0,72
- –
-
Bufadienolid 5: etwa 0,81
Eignungsprüfung: Referenzlösung
- –
-
Wiederholpräzision: höchstens 2,0 % relative Standardabweichung für die Fläche des Proscillaridin-Peaks, mit 6 Einspritzungen der Stammlösung
Eine Kalibriergerade wird erstellt, indem die Peakfläche der jeweiligen Referenzlösung von Proscillaridin RH bestimmt und gegen die entsprechende Konzentration aufgetragen wird.
Der Prozentgehalt (m/m) an Gesamtbufadienoliden, berechnet als Proscillaridin wird nach folgender Formel berechnet:
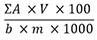
| ƩA: | Summe der Flächen der Bufadienolide 1 bis 5 im Chromatogramm der Untersuchungslösung |
| b: | Steigung der Kalibriergeraden (y = bx) |
| V: | Volumen der Untersuchungslösung in Millilitern |
| m: | Einwaage der Urtinktur in Gramm |
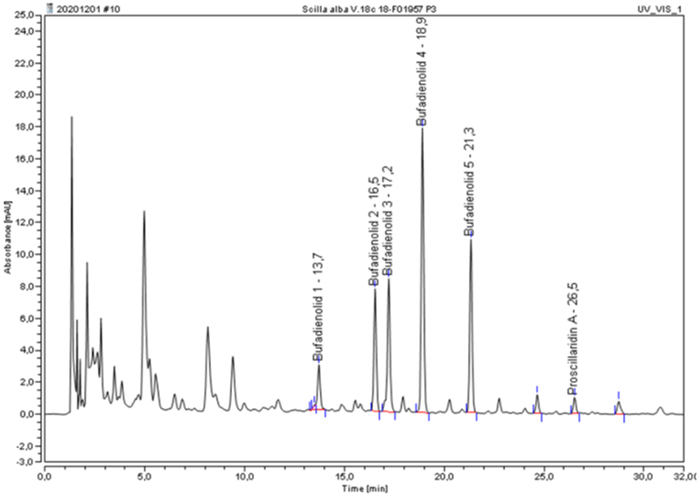
Beispielchromatogramm: Untersuchungslösung Drimia maritima, ethanol. Digestio, Vorschrift 18c
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Bezug beim Ausgangsmaterial auf die homöopathische Ph.-Eur.-Monographie „Ephedra vulgaris für homöopathische Zubereitungen“
- –
-
Streichung des unspezifischen Geruchs bei der Urtinktur
- –
-
Streichung der nasschemischen Identitätsprüfung wie üblich, da die dünnschichtchromatographische Prüfung ausreichend ist.
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Änderung bei der Referenzlösung auf das Ph.-Eur.-Reagenz „Ephedrinhydrochlorid R“
- –
-
Änderung bei der Detektion von „besprüht“ auf „behandelt“, um neben dem Sprühen auch das Tauchen mit einzuschließen
Ephedra distachya spag. Zimpel
Ephedra spag. Zimpel
Das Ausgangsmaterial muss der Monographie Ephedra vulgaris für homöopathische Zubereitungen (Ph. Eur.) entsprechen
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 25
Eigenschaften
Die Urtinktur ist eine hellgelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 25 ml Urtinktur werden in einem Scheidetrichter vorsichtig bis zur alkalischen Reaktion (2.2.4) gegen rotes Lackmuspapier R mit konzentrierter Ammoniak-Lösung R versetzt. Die Mischung wird 3-mal mit je 15 ml Ether R ausgeschüttelt. Die vereinigten organischen Phasen werden über wasserfreiem Natriumsulfat R getrocknet, filtriert und das Filtrat vorsichtig zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Ethanol 96 % R aufgenommen.
Referenzlösung: 10 mg Ephedrinhydrochlorid R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: konzentrierte Ammoniak-Lösung R, Wasser R, 2-Propanol R (2:7:91 V/V/V)
Auftragen: 30 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Nach dem Verdunsten des Fließmittels wird die Platte mit einer Lösung von Ninhydrin R (2 g · l−1) in Ethanol 96 % R behandelt und 5 bis 10 min lang bei 105 bis 110 °C erhitzt. Die Auswertung erfolgt im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die rotviolette Zone des Ephedrinhydrochlorids.
Das Chromatogramm der Untersuchungslösung zeigt im mittleren und oberen Drittel zwei rotviolette und eine graue Zone/n. In Höhe der Referenzsubstanz darf keine Zone erscheinen.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,975 bis 0,985
Trockenrückstand (H 2.2.6): höchstens 0,3 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Änderung des wissenschaftlichen Namens und damit auch des Haupttitels der Monographie auf „Euonymus europaeus“ aufgrund der Anpassung der Taxonomie an die im Internet veröffentlichte Datenbank „Medicinal Plant Names Services“ von Kew (https://mpns.science.kew.org/mpns-portal/searchName)
- –
-
Streichung des unspezifischen Geruchs bei der Urtinktur
- –
-
Streichung der nasschemischen Identitätsprüfungen wie üblich, da die Identitätsprüfung mittels DC ausreichend ist
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösung: Änderung des DAB-Reagenzes „Lanatosid C RN“ auf das Ph.-Eur.-Reagenz „Lanatosid C R“ aufgrund der Streichung im DAB
- –
-
Änderung der Reihenfolge der Referenzsubstanzen der Referenzlösung nach dem Auftreten im Chromatogramm (von unten nach oben)
Euonymus europaeus
Euonymus europaea
Evonymus europaea
Verwendet werden die frischen reifen Früchte von Euonymus europaeus L.
Beschreibung
Die vierfächerigen Kapseln sind 10 bis 13 mm lang, an den Kanten abgerundet und rosa- bis karminrot. Sie enthalten in jedem Fach einen eiförmigen, 6 bis 7 mm langen, weißlichen Samen, der von dem orangeroten Arillus vollständig umschlossen wird.
Arzneiformen
Die Urtinktur enthält höchstens 0,01 % Cardenolidglykoside, bestimmt als Digitoxin (C41H64O13; Mr 765).
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 2a
Eigenschaften
Die Urtinktur ist eine orangebraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 10 ml Urtinktur werden mit 20 ml Wasser R und 10 ml Blei(II)-acetat-Lösung R versetzt. Die Mischung wird geschüttelt und nach 5 Minuten zentrifugiert. Die überstehende Lösung wird 2-mal mit je 15 ml einer Mischung von 3 Volumteilen Chloroform R und 2 Volumteilen 2-Propanol R ausgeschüttelt; bei Emulsionsbildung wird erneut zentrifugiert. Die vereinigten organischen Phasen werden unter vermindertem Druck bei höchstens 50 °C zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Methanol R gelöst.
Referenzlösung: 50 mg Lanatosid C R und 50 mg Digitoxin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Wasser R, Methanol R, Ethylacetat R (8:11:81 V/V/V)
Auftragen: 40 µl Untersuchungslösung und 20 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Mischung von 2 Volumteilen einer Lösung von Chloramin T R (30 g · l−1) und 8 Volumteilen einer Lösung von Trichloressigsäure R (250 g · l−1) in Ethanol 96 % R behandelt und 5 bis 10 min lang bei 105 bis 110 °C erhitzt. Die Auswertung erfolgt sofort im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die blau fluoreszierende Zone des Lanatosids C und im mittleren Drittel die gelb fluoreszierende Zone des Digitoxins.
Das Chromatogramm der Untersuchungslösung zeigt etwa in Höhe der Referenzsubstanz Lanatosid C eine gelb fluoreszierende Zone und etwas unterhalb der Referenzsubstanz Digitoxin eine schwache, gelb fluoreszierende Zone.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,935 bis 0,955
Trockenrückstand (H 2.2.6): mindestens 4,0 %
Gehaltsbestimmung
UV-Vis Spektroskopie (2.2.25)
Untersuchungslösung: 15,00 g Urtinktur werden unter vermindertem Druck auf etwa 5 ml eingedampft, mit 25 ml Wasser R in einen 100-ml-Messkolben hinübergespült und nach Zusatz von 10 ml einer Lösung von Blei(II)-acetat R (150 g · l−1) geschüttelt. Nach einigen Minuten wird die Mischung mit Wasser R zu 100,0 ml verdünnt und anschließend zentrifugiert. 30,0 ml Zentrifugat werden 3-mal mit je 25 ml Chloroform R ausgeschüttelt. Die vereinigten Chloroformauszüge werden über wasserfreiem Natriumsulfat R getrocknet, filtriert und das Filtrat anschließend unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 3,0 ml Ethanol 96 % R gelöst. Die Lösung wird mit 3,0 ml alkalischer Natriumpikrat-Lösung R versetzt und 30 min lang vor direkter Lichteinwirkung geschützt aufbewahrt.
Referenzlösung: 25,00 mg Digitoxin CRS werden in Ethanol 96 % R zu 50,0 ml gelöst. 5,0 ml Lösung werden mit Ethanol 96 % R zu 50,0 ml verdünnt. 3,0 ml dieser Lösung werden mit 3,0 ml alkalischer Natriumpikrat-Lösung R versetzt und 30 min lang vor direkter Lichteinwirkung geschützt aufbewahrt.
Kompensationsflüssigkeit: 3,0 ml Ethanol 96 % R und 3,0 ml alkalischer Natriumpikrat-Lösung R werden gemischt.
Die Absorption A (2.2.25) von Referenzlösung und Untersuchungslösung wird im Maximum bei 495 nm gegen die gleichzeitig hergestellte Kompensationsflüssigkeit gemessen.
Der Prozentgehalt (m/m) an Cardenolidglykosiden, berechnet als Digitoxin, wird mit Hilfe der gemessenen Absorptionen und der Konzentrationen der Lösungen nach folgender Gleichung berechnet:
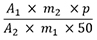
| A 1 | = Absorption der Untersuchungslösung |
| A 2 | = Absorption der Referenzlösung |
| m 1 | = Einwaage der Urtinktur in Gramm |
| m 2 | = Masse des Digitoxins in der Referenzlösung in Gramm |
| p | = Prozentgehalt an Digitoxin in der Referenzsubstanz |
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Monographie ist kürzlich in Bezug auf die Anpassung der Textpassage zu den Pyrrolizidinalkaloiden an die aktuell geltenden Anforderungen7, 2 überarbeitet worden.
Nach weiterer Überprüfung sind jetzt noch die folgenden Änderungen vorgenommen worden:
- –
-
die Ergänzung der HPTLC-Bedingungen
- –
-
der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten.
Eutrochium purpureum
Eupatorium purpureum
Verwendet werden die frischen unterirdischen Teile von Eutrochium purpureum (L.) E.E.Lamont nach dem Abblühen.
Eutrochium purpureum kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)8. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die 10 bis 15 mm dicken, harten, in der Regel horizontal wachsenden, wenige Zentimeter langen, knolligen Wurzelstöcke tragen an der Oberseite kurze Reste der Sprossachsen und die 1 bis 3 mm dicken, rotbraunen Knospen der nächstjährigen Triebe. Der Wurzelstock ist rundherum, gehäuft auf der Unterseite, dicht mit zahlreichen 1 bis 2 mm, selten 3 mm dicken, bis 500 mm langen, absteigenden Wurzeln besetzt; die Wurzeln sind hellbraun bis hellgraubraun, die feinen Seitenwurzeln schmutzig-weißlich.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine goldgelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 10 mg Menthol R , 25 µl (+)-Carvon R und 10 mg Anethol R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ethylacetat R, Toluol R (7:93 V/V)
Auftragen: 50 µl [oder 15 µl] Untersuchungslösung und 10 µl [oder 3 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 min lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 min im Tageslicht.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
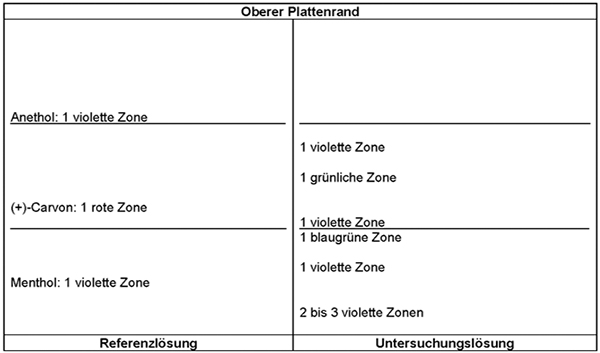
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,890 bis 0,910
Trockenrückstand (H 2.2.6): mindestens 1,8 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Streichung des Geruchs bei Droge und Urtinktur
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösung: Änderung der Reihenfolge der Referenzsubstanzen nach dem Auftreten im Chromatogramm (von unten nach oben); Korrektur des Reagenzes „Guajacol RH“ auf „Guajacol R“, da das Reagenz nicht im HAB, sondern in der Ph. Eur. aufgeführt wird
- –
-
Detektion: Änderung des DAB-Reagenzes „methanolische Kaliumhydroxid-Lösung RN“ auf „methanolische Kaliumhydroxid-Lösung RH“ aufgrund der Streichung im DAB (Reagenz wird ausschließlich für die HAB-Monographien benötigt) und Aufnahme ins HAB
Garcinia
Gutti
Verwendet wird das nach dem Einschneiden von Stämmen und Zweigen verschiedener Garcinia-Arten ausgetretene, getrocknete Gummiharz.
Beschreibung
Das Harz besteht aus harten, harzartigen, spröden, walzenförmigen, massiven oder in der Mitte hohlen, rotgelben, außen längsgestreiften und schmutzig-gelb bestäubten Stangen oder aus teilweise zusammengeflossenen, unregelmäßigen Klumpen. Es erscheint rotgelb und zerbricht in kleine, dunkle, orange, undurchsichtige Splitter mit flachmuscheligem, glattem und matt glänzendem Bruch.
Prüfung auf Identität
Prüflösung: 1 g pulverisierte Droge (500) wird mit 10 ml Ethanol 90 % R versetzt, die Mischung 5 min lang unter Rückflusskühlung zum Sieden erhitzt und nach dem Erkalten filtriert.
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 1 ml Prüflösung wird mit 4 ml Ethanol 90 % R verdünnt.
Referenzlösung: 50 mg Vanillin R und 10 mg Guajacol R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Ameisensäure R, Ethylacetat R, Toluol R (1:25:74 V/V/V)
Auftragen: 20 µl; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Echtblausalz-B-Lösung RH besprüht, etwa 20 min lang bei Raumtemperatur getrocknet, anschließend mit methanolischer Kaliumhydroxid-Lösung RH besprüht. Die Auswertung erfolgt im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt am Übergang vom unteren zum mittleren Drittel die violette Zone des Vanillins und im mittleren Drittel die rotbraune Zone des Guajacols.
Das Chromatogramm der Untersuchungslösung zeigt etwa in der Mitte zwischen Start und der Referenzsubstanz Vanillin eine braunviolette Zone sowie knapp unterhalb und knapp oberhalb der Referenzsubstanz Vanillin je eine violette Zone. Darüber kann eine gelbe Zone erscheinen. Etwa in Höhe der Referenzsubstanz Guajacol liegt eine violette Zone.
Prüfung auf Reinheit
Fremde Bestandteile (2.8.2): höchstens 2 %
Colophonium: Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 1 ml Prüflösung (siehe „Prüfung auf Identität“) wird mit 4 ml Ethanol 90 % R verdünnt.
Referenzlösung: 10 mg Chinolin RH werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Methanol R, Toluol R (5:95 V/V)
Auftragen: 20 µl; bandförmig 20 mm
Laufstrecke: 15 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Antimon(III)-chlorid-Lösung R besprüht. Die Auswertung erfolgt sofort im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die violett fluoreszierende Zone des Chinolins.
Das Chromatogramm der Untersuchungslösung darf in Höhe der Referenzsubstanz keine rosafarben fluoreszierende Zone zeigen.
Extraktgehalt: mindestens 70 %
1,000 g pulverisierte Droge (500) wird mit 20 ml Ethanol 90 % R versetzt und die Mischung unter häufigem Umschütteln 30 min lang stehen gelassen. Die Mischung wird in einen 25-ml-Messkolben filtriert und das Filtrat unter Waschen des Filters mit Ethanol 90 % R zu 25,0 ml verdünnt. 5,0 ml dieser Lösung werden auf dem Wasserbad zur Trockne eingedampft. Der bei 100 bis 105 °C getrocknete Rückstand muss mindestens 0,140 g wiegen.
Trocknungsverlust (2.2.32): höchstens 8,0 %, mit 1,000 g pulverisierter Droge (500) durch 4 h langes Trocknen im Vakuum bestimmt
Asche (2.4.16): höchstens 2,0 %
Arzneiformen
Herstellung
Urtinktur aus der pulverisierten Droge (500) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 86 % (m/m)
Die vierte Dezimalverdünnung wird mit Ethanol 62 % (m/m), die folgenden Verdünnungen werden mit Ethanol 43 % (m/m) hergestellt.
Eigenschaften
Die Urtinktur ist eine gelblich orange bis gelblich rote Flüssigkeit.
Prüfung auf Identität
Die Prüfung erfolgt wie unter „Prüfung auf Identität“ bei der Droge angegeben mit folgender Untersuchungslösung:
Untersuchungslösung: 1 ml Urtinktur wird mit 4 ml Ethanol 90 % R verdünnt.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,840 bis 0,860
Trockenrückstand (H 2.2.6): mindestens 6,5 und höchstens 9,0 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
In der Monographie werden die Reinheitsprüfungen auf Wasserlösliche Anteile (N 2.8.10) und Halogenhaltige Verunreinigungen (N 2.8.11) gemäß DAB gestrichen, da aufgrund der ausschließlichen Gewinnung von Gaultheriae aetheroleum mittels Wasserdampfdestillation keine entsprechenden Verunreinigungen auftreten und somit diese Prüfungen nicht erforderlich sind.
Gaultheriae aetheroleum
Oleum gaultheriae
Verwendet wird ätherisches Öl, das durch Wasserdampfdestillation aus den frischen Blättern von Gaultheria procumbens L. gewonnen wird. Es enthält mindestens 96,0 und höchstens 99,0 % Methylsalicylat (C8H8O3; Mr 152,1).
Eigenschaften
Farblose, gelbliche oder rötliche Flüssigkeit mit anhaltendem und starkem Geruch nach Methylsalicylat; sehr schwer löslich in Wasser, mischbar mit Ethanol und fetten Ölen
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 0,1 ml Öl werden in 10 ml Ethanol 96 % R gelöst.
Referenzlösung: 0,1 ml Methylsalicylat R werden in 10 ml Ethanol 96 % R gelöst.
Platte: DC-Platte mit Kieselgel F254 R
Fließmittel: Ether R, Cyclohexan R (10:90 V/V)
Auftragen: 30 µl; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 254 nm ausgewertet.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im mittleren Drittel die Zone des Methylsalicylats.
Das Chromatogramm der Untersuchungslösung zeigt in Höhe der Referenzsubstanz eine Zone vergleichbarer Intensität.
Prüfung auf Reinheit
Aussehen der Lösung: Die Lösung von 1,0 ml Öl in 7,0 ml Ethanol 90 % R muss klar sein (2.2.1).
Relative Dichte (2.2.5): 1,176 bis 1,183
Brechungsindex (2.2.6): 1,533 bis 1,538
Optische Drehung (2.2.7): −1,5° bis −0,5°
Säurezahl (2.5.1): höchstens 3,0
Fremde Ester (2.8.6): Das Öl muss der Prüfung „Fremde Ester in ätherischen Ölen“ entsprechen.
Fette Öle, verharzte ätherische Öle (2.8.7): Das Öl muss der Prüfung „Fette Öle, verharzte ätherische Öle in ätherischen Ölen“ entsprechen.
Gehaltsbestimmung
0,500 g Öl werden in 25 ml Ethanol 96 % R gelöst. Die Lösung wird nach Zusatz von 0,05 ml Phenolrot-Lösung R mit Natriumhydroxid-Lösung (0,1 mol · l−1) neutralisiert. Die neutralisierte Lösung wird mit 50,0 ml Natriumhydroxid-Lösung (0,1 mol · l−1) versetzt und die Mischung 1 h lang unter Rückfluss zum Sieden erhitzt. Nach dem Abkühlen wird mit Salzsäure (0,1 mol · l−1) bis zum Farbumschlag nach Gelb titriert. Ein Blindversuch wird durchgeführt.
1 ml Natriumhydroxid-Lösung (0,1 mol · l−1) entspricht 15,21 mg C8H8O3.
Arzneiformen
Die Lösung D1 enthält mindestens 9,1 und höchstens 10,4 % C8H8O3.
Herstellung
Lösung D1 nach Vorschrift 5a mit Ethanol 86 % (m/m)
Die 2. und 3. Dezimalverdünnung werden mit Ethanol 86 % (m/m), die folgenden Verdünnungen mit Ethanol 43 % (m/m) hergestellt.
Eigenschaften
Die Lösung D1 ist eine farblose bis schwach gelbliche Flüssigkeit mit einem Geruch nach Methylsalicylat.
Prüfung auf Identität
Die Lösung D1 gibt die Identitätsreaktion der Substanz. Für die Untersuchungslösung wird 1 ml Lösung D1 mit 9 ml Ethanol 96 % R versetzt.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,853 bis 0,858
Gehaltsbestimmung
Die Bestimmung erfolgt wie unter „Gehaltsbestimmung“ bei der Substanz angegeben mit 5,00 g der Lösung D1.
Lagerung
Dicht verschlossen, vor Licht geschützt
Anmerkungen zur Monographie:
Streichung des unspezifischen Geruchs bei Droge und Urtinktur
- –
-
Streichung der nasschemischen Prüfungen wie üblich, da die DC-Prüfung ausreichend ist.
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösung: Änderung der Reihenfolge der Referenzsubstanzen nach dem Auftreten im Chromatogramm (von unten nach oben)
- –
-
Detektion: Änderung des DAB-Reagenzes „methanolische Kaliumhydroxid-Lösung RN“ auf „methanolische Kaliumhydroxid-Lösung RH“ aufgrund der Streichung im DAB (Reagenz wird ausschließlich für die HAB-Monographien benötigt) und Aufnahme ins HAB
Harungana madagascariensis
Haronga
Verwendet wird eine Mischung, die zu etwa einem Teil aus getrockneten Blättern und zu etwa zwei Teilen aus getrockneter Zweigrinde von Harungana madagascariensis Lam. ex Poir. besteht.
Beschreibung
Die elliptischen, 100 bis 200 mm langen und bis 100 mm breiten Blätter sind ganzrandig, vorn zugespitzt, plötzlich in den kurzen Stiel verschmälert oder leicht herzförmig ausgerandet. Sie sind relativ dünn, aber ziemlich hart und spröde. Die Oberseite ist grau bis braungrün, oft etwas glänzend, die Unterseite heller und glanzlos. Junge Blätter sind beiderseits von einem dünnen, bräunlichen Haarfilz bedeckt, ältere Blätter auf der Oberseite fast kahl und auf der Unterseite, insbesondere auf den hier stark hervortretenden Nerven, mehr oder weniger filzig behaart.
Die Zweigrinde besteht aus flach gewölbten bis röhrenförmigen, gelben bis zimtbraunen, von einer dünnen, rissigen, regelmäßig geschichteten Borke bedeckten Stücken. Die Innenseite ist in der Regel dunkler gelbbraun bis rotbraun und schwach längsrunzelig. Die von dickeren Ästen abgeschälte Rinde besteht aus 1 bis 3 mm dicken, bandartigen, flachen bis wellig gebogenen Stücken, die häufig von der Borke befreit sind und dann außen schwarzrote Exkretrückstände aufweisen. Die Rinde ist hornartig hart, der Bruch glatt.
Schnittdroge: Die Schnittdroge besteht aus den dünnen, aber ziemlich harten und spröden, grauen bis braungrünen, oft auf einer Seite etwas glänzenden Stücken der Blätter, Teilen der braunen Blattstiele sowie Rindenstücken.
Die gelb- bis rotbraunen, etwa 1 bis 2 mm dicken Rindenstücke der Zweigrinde sind flach, auf der Innenseite deutlich längsstreifig, auf der Außenseite matt und gelegentlich unregelmäßig streifig. Die Stücke der Stammrinde sind unregelmäßig oder gebogen bis 5 mm dick. Auf den Querschnittsflächen oder an der Oberfläche können dunkle, glänzende Exkretbehälter erkennbar sein; das Exkret kann auch zu einer glänzenden Kruste zusammengelaufen sein.
Mikroskopische Merkmale: Die Blätter werden oberseits von einer geradwandigen polygonalen Epidermis mit mäßig verdickten, wenig gewölbten Außenwänden und einer feinwarzigen Kutikula bedeckt. Darunter liegt eine bis drei Reihen hohe Hypodermis aus 70 bis 85 µm großen, rundlichen bis liegend-ovalen, farblosen Zellen. Die Zellen des einreihigen Palisadenparenchyms sind 4- bis 6-mal länger als breit. Das mehrschichtige Schwammparenchym besteht überwiegend aus länglichen, liegenden Zellen. Die Epidermis der Blattunterseite besteht aus unregelmäßig wellig buchtigen Zellen mit dickwandiger, mehr oder weniger stark papillös vorgewölbter Außenseite. Die zahlreichen, von zwei bis vier Nebenzellen umgebenen Spaltöffnungen sind 15 bis 20 µm lang und 10 bis 15 µm breit. Im Mesophyll, insbesondere an der Grenze zum Palisadenparenchym, finden sich rundliche, farblose Zellen mit je einer Calciumoxalatdruse. Im Schwammparenchym liegen rundliche, 30 bis 100 µm große Exkretbehälter mit schwarzrotem Inhalt.
Die Leitbündel der stärkeren Blattnerven sind von einem fast geschlossenen Ring aus zwei bis vier Reihen verholzter Fasern umgeben. Zwischen diesen Leitbündeln und oberer sowie unterer Epidermis liegen kollenchymatisch verdickte Zellen. Von den auf beiden Blattseiten vorkommenden, auf einem kurzen, gedrungenen, mehrzelligen Stiel sitzenden, im Durchmesser 170 bis 380 µm weiten, dünnwandigen Sternhaarbüscheln sind oberseits oft nur noch die Abbruchstellen zu erkennen.
Die Parenchymzellen der fast ausschließlich aus sekundärem Gewebe bestehenden Rindenstücke sind oft tangential zusammengedrückt und haben stark, aber unregelmäßig verdickte, gelbliche Zellwände. Die zwei bis sechs Reihen breiten, in der Regel 30, vereinzelt bis über 40 Lagen hohen Markstrahlen bestehen aus Zellen mit knotig verdickter Wand. Die Rinde wird von zahlreichen 10 bis 30 µm, selten bis 100 µm weiten und dann tangential zusammengedrückten Exkretkanälen durchzogen, die oft Reste eines dunkelrotbraunen Exkretes enthalten. Die größeren Exkretgänge sind in tangentialen Reihen angeordnet, die schmaleren liegen einzeln oder zu Gruppen gehäuft. Die Rinde enthält Calciumoxalatdrusen und 2 bis 6 µm große einzelne oder etwa 10 µm große zusammengesetzte Stärkekörner.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 3 g pulverisierte Droge (710) werden mit 30 ml Ethanol 70 % R versetzt. Die Mischung wird 2 Stunden lang gerührt und anschließend filtriert.
10 ml werden auf dem Wasserbad auf etwa 3 ml eingeengt. Der Rückstand wird mit 10 ml Wasser R in einen Scheidetrichter überführt und die Mischung 2-mal mit je 15 ml Ether R ausgeschüttelt. Die vereinigten organischen Phasen werden über wasserfreiem Natriumsulfat R getrocknet und filtriert. Das Filtrat wird unter vermindertem Druck zur Trockne eingedampft und der Rückstand in 1 ml Methanol R aufgenommen.
Referenzlösung: 25 mg Gallussäure R , 5 mg Kaffeesäure R und 5 mg Emodin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Ameisensäure R, Ethylacetat R, Toluol R (10:40:50 V/V/V)
Auftragen: 40 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 15 cm
Detektion A: Nach Verdunsten des Fließmittels wird die Platte mit methanolischer Kaliumhydroxid-Lösung RH besprüht. Die Auswertung erfolgt sofort im Tageslicht.
Ergebnis A: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die gelbbraune Zone der Gallussäure und im mittleren Drittel die orangebraune Zone der Kaffeesäure und die rote Zone des Emodins.
Detektion B: Anschließend wird die Platte mit Echtblausalz-B-Lösung RH besprüht.
Ergebnis B: Im Chromatogramm der Referenzlösung erscheinen die Zonen der Gallussäure und der Kaffeesäure nun rotbraun und die Zone des Emodins violett.
Das Chromatogramm der Untersuchungslösung zeigt knapp oberhalb des Starts eine intensive braune Zone, knapp darüber eine oder zwei schwache braune Zone/n, zwischen den Referenzsubstanzen Gallussäure und Kaffeesäure eine rotbraune Zone, knapp oberhalb der Referenzsubstanz Kaffeesäure eine orangebraune Zone und etwa in Höhe der Referenzsubstanz Emodin eine blaugraue Zone.
Prüfung auf Reinheit
Fremde Bestandteile (2.8.2): höchstens 2 %
Asche (2.4.16): höchstens 5,0 %
Arzneiformen
Herstellung
Urtinktur aus der pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine rotbraune Flüssigkeit.
Prüfung auf Identität
Die Urtinktur gibt die Identitätsreaktion der Droge. Untersuchungslösung ist die Urtinktur.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,895 bis 0,915
Trockenrückstand (H 2.2.6): mindestens 1,8 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Monographie ist kürzlich in Bezug auf die Anpassung der Textpassage zu den Pyrrolizidinalkaloiden an die aktuell geltenden Anforderungen9, 2 überarbeitet worden.
Nach weiterer Überprüfung sind jetzt noch die folgenden Änderungen vorgenommen worden:
- –
-
Eine Korrektur beziehungsweise Anpassung der botanischen Beschreibung an aktuelle Probenmuster
- –
-
Die Streichung des Geruchs bei der Urtinktur
- –
-
Die Ergänzung der HPTLC-Bedingungen
- –
-
Die Änderung der Spezifikation der relativen Dichte auf 0,930 – 0,960, da die vorgelegten Chargendaten verschiedener Hersteller häufig an der Obergrenze der Spezifikation von 0,950 liegen beziehungsweise diese überschreiten.
Jacobaea maritima
Senecio cineraria
Senecio bicolor, Cineraria maritima
Verwendet wird die frische, ganze Pflanze von Jacobaea maritima (L.) Pelser & Meijden; sie wird unmittelbar vor der Blütezeit geerntet.
Jacobaea maritima kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)10. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Wurzel ist büschelförmig, sehr stark verzweigt, faserig und von hellbrauner Farbe.
Die bis 60 cm hohen Stängel der staudigen bis halbstrauchigen Pflanze sind aufrecht und am Grund stark, oberwärts spärlich verzweigt. Die Sprossachsen sind schneeweiß-filzig behaart.
Die 40 bis 190 mm langen und 25 bis 70 mm breiten, gestielten Laubblätter stehen an den blütentragenden Stängeln nahe der Basis gehäuft und an den nicht blühenden fast rosettig. Die unteren Laubblätter sind schief-trapezförmig, mehr oder weniger fiederschnittig, die wechselständigen mittleren und oberen überwiegend fiederschnittig mit vier bis sechs länglichen, stumpfen, fast dreilappigen Abschnitten, deren obere oft zusammenfließen. Junge Blätter sind beiderseits grauweiß-filzig, ältere oberseits spinnwebig behaart, seltener fast kahl und nur unterseits schneeweiß-filzig.
Die zahlreichen, doldenrispig angeordneten Blütenköpfchen haben einen Durchmesser von 12 bis 15 mm. Sie werden von einem einreihigen Hüllkelch aus 5 bis 8 mm langen Hüllblättern umgeben, der am Grund bis zu fünf 1 bis 2 mm große Hochblätter trägt. Auf einem flachen, spreublattlosen Blütenstandsboden stehen zehn bis zwölf gelbe Zungenblüten mit einer 10 bis 13 mm langen und 3 bis 6 mm breiten, meist zurückgebogenen Zunge und zahlreiche scheibenständige, gelbe Röhrenblüten.
Die gestreiften Früchte tragen einen einreihigen Pappus, der ungefähr so lang ist wie die Scheibenblüten.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 2a
Eigenschaften
Die Urtinktur ist eine gelbbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 5 ml Urtinktur werden unter vermindertem Druck bis zur Hälfte eingeengt und mit 1 ml gesättigter Natriumchlorid-Lösung R versetzt. Die Mischung wird 2-mal mit je 5 ml Ethylacetat R ausgeschüttelt. Die vereinigten organischen Phasen werden unter vermindertem Druck zur Trockne eingeengt. Der Rückstand wird mit 0,5 ml Ethylacetat R aufgenommen.
Referenzlösung: 50 mg Brenzcatechin R, 10 mg Borneol R und 10 mg Bornylacetat R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254 R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Methanol R, Ethylacetat R, Toluol R (5:20:75 V/V/V)
Auftragen: 20 µl [oder 5 µl] Untersuchungslösung und 10 µl [oder 2 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 365 nm ausgewertet.
Ergebnis A: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
Detektion B: Die Platte wird mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 Minuten lang bei 100 bis 105 C erhitzt. Die Auswertung erfolgt innerhalb von 10 Minuten im Tageslicht.
Ergebnis B: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
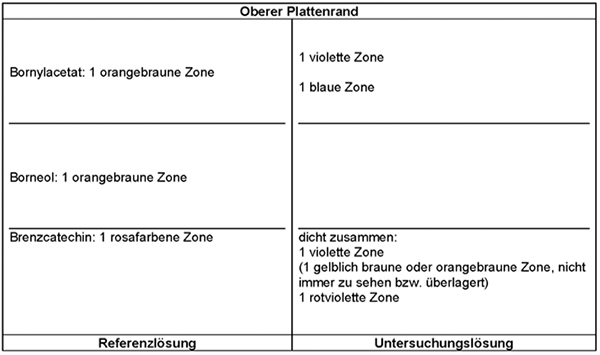
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,930 bis 0,960
Trockenrückstand (H 2.2.6): mindestens 2,0 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Streichung des unspezifischen Geruchs bei der Urtinktur
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösung: Änderung des DAB-Reagenzes „Scopoletin RN“ auf das Ph.-Eur.-Reagenz „Scopoletin R“ aufgrund der Streichung im DAB
- –
-
Änderung von „Cumarin RH“ auf „Cumarin R“ aus Gründen der Vereinheitlichung zu anderen HAB-Monographien
- –
-
Ersatz der DC-Beschreibung durch einen DC-Kasten und Anpassung der Zonen an die Ergebnisse der aktuell durchgeführten Untersuchungen
Levisticum officinale, ethanol. Decoctum
Levisticum, ethanol. Decoctum
Die Droge muss der Monographie Liebstöckelwurzel (Ph. Eur.) entsprechen.
Arzneiformen
Herstellung
Urtinktur aus der unmittelbar zuvor zerkleinerten Droge (2000) und flüssige Verdünnungen nach Vorschrift 19f mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine gelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 2 mg Scopoletin R und 10 mg Cumarin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: verdünnte Essigsäure R, Ether R und Toluol R, (50:50:50 V/V/V); die obere Phase wird verwendet.
Auftragen: 50 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 15 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit ethanolischer Kaliumhydroxid-Lösung R behandelt. Die Auswertung erfolgt im ultravioletten Licht bei 365 nm.
Ergebnis: Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
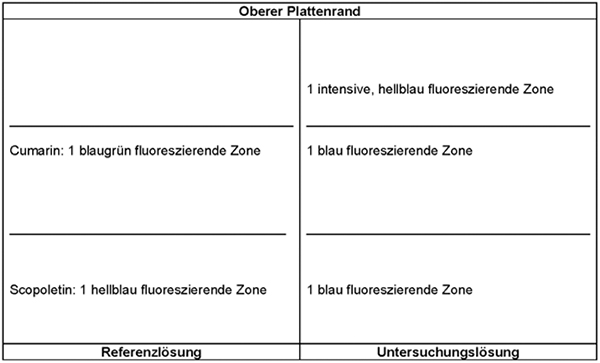
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,897 bis 0,907
Trockenrückstand (H 2.2.6): mindestens 2,5 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösung: Änderung des DAB-Reagenzes „Scopoletin RN“ auf „Scopoletin R“ aufgrund der Streichung im DAB
Malva sylvestris, ethanol. Infusum
Malva, ethanol. Infusum
Die Droge muss der Monographie Malvenblüten (Ph. Eur.) entsprechen.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 20 mit Ethanol 43 % (m/m)
Eigenschaften
Die Urtinktur ist eine rotbraune Flüssigkeit mit fruchtigem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: Eine Säule oder Kartusche mit 10 mm innerem Durchmesser wird in einer Schichtdicke von 20 mm mit etwa 350 mg octadecylsilyliertem Kieselgel zur Chromatographie RH11 gefüllt. Die Säule wird mit 10 ml Methanol R und anschließend mit 10 ml Wasser R gewaschen. 2 ml Urtinktur werden mit 10 ml Wasser R versetzt. Die Mischung wird auf die vorbereitete Säule gegeben. Die Säule wird mit 10 ml Wasser R gewaschen und anschließend mit 10 ml Methanol R eluiert. Das Eluat wird unter vermindertem Druck zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Methanol R aufgenommen.
Referenzlösung: 10 mg Rutosid-Trihydrat R, 10 mg Hyperosid R und 2 mg Scopoletin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Auftragen: 20 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Fließmittel: Ameisensäure R, Wasser R, Ethylacetat R (15:15:70 V/V/V)
Laufstrecke: 10 cm
Trocknen: bei 100 bis 105 °C
Detektion: Die noch warme Platte wird mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l−1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l−1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 Minuten im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im mittleren Drittel die orangefarben fluoreszierende Zone des Rutosids und darüber die orangefarben fluoreszierende Zone des Hyperosids. Im oberen Drittel liegt die hellblau fluoreszierende Zone des Scopoletins.
Das Chromatogramm der Untersuchungslösung zeigt zwischen Start und Referenzsubstanz Rutosid eine hellblau fluoreszierende Zone. In Höhe der Referenzsubstanz Rutosid liegen eine orangefarben und darüber eine grün fluoreszierende Zone. Etwas unterhalb der Referenzsubstanz Hyperosid liegt eine beigegrau fluoreszierende Zone. Etwas oberhalb der Referenzsubstanz Hyperosid liegen eine gelborange fluoreszierende Zone und darüber eine grün fluoreszierende Zone. Weitere Zonen können vorhanden sein.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,930 bis 0,950
Trockenrückstand (H 2.2.6): mindestens 2,2 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Streichung des unspezifischen Geruchs bei der Urtinktur
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Änderung von „Cumarin RH“ auf „Cumarin R“ aus Gründen der Vereinheitlichung zu anderen HAB-Monographien
- –
-
Bei Detektion B: Änderung des DAB-Reagenzes „methanolische Kaliumhydroxid-Lösung RN“ auf „methanolische Kaliumhydroxid-Lösung RH“ aufgrund der Streichung im DAB (Reagenz wird ausschließlich für die HAB-Monographien benötigt) und Aufnahme ins HAB
Melilotus officinalis spag. Zimpel
Verwendet werden die frischen oberirdischen Teile von Melilotus officinalis (L.) Lam. ohne verholzte Stängel zur Blütezeit.
Beschreibung
Die Pflanze entwickelt beim Zerreiben einen starken, süßlich-aromatischen Geruch nach Cumarin.
Die aufrechten bis aufsteigenden, 0,3 bis 0,9 m selten bis 2 m hohen Stängel sind kantig, kahl und nur oberwärts schwach behaart. Sie tragen entfernt stehende, dreizählig gefiederte Laubblätter. Der Stiel des Blattes und die Stiele der einzelnen Fiederblättchen sind etwa so lang wie die Blättchen oder kürzer; das mittlere Fiederblättchen ist deutlich länger gestielt als die seitlichen. Die bis 40 mm langen Fiederblättchen sind dünn länglich-verkehrt-eiförmig, die unteren mehr rautenförmig, die oberen elliptisch lanzettlich, stumpf mit 6 bis 13 Paar Seitennerven und kahl. Der Blattrand ist fast bis zum Grund der Fiederblättchen stumpf bis spitz und unregelmäßig gezähnt. Die Nebenblätter sind lanzettlich, 7 bis 8 mm lang und in der Regel ganzrandig.
Die Blüten stehen zu 30 bis 70 in der Achsel kleiner, rötlich gewimperter Deckblätter an in der Regel 40 bis 100 mm langen, das tragende Laubblatt um mindestens das Dreifache überragenden, lockeren Trauben. Die seidenhaarigen Blütenstiele sind herabgekrümmt, etwa 2 bis 3 mm lang und annähernd so lang wie der glockige Kelch. Die gelbe, später oft verblassende Krone besteht aus einer Fahne und zwei 5,5 bis 7 mm langen Flügeln sowie einem kürzeren Schiffchen. Die kahlen, mit einem langen Griffel besetzten Fruchtknoten haben vier bis acht Samenanlagen und entwickeln sich zu einer ein- oder zweisamigen, eiförmigen, an beiden Enden zugespitzten, 3 bis 4 mm langen, 2 bis 2,5 mm breiten und 1,5 mm dicken, kahlen, in der Regel gelblichen bis braunen, selten schwärzlichen, querrunzeligen Hülse.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 25
Eigenschaften
Die Urtinktur ist eine farblose Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 5 mg Cumarin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254 R
Fließmittel: 2-Propanol R, Aceton R, Cyclohexan R (5:15:80 V/V/V)
Auftragen: 30 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion A: Nach Verdunsten des Fließmittels werden die Chromatogramme im ultravioletten Licht bei 254 nm ausgewertet.
Ergebnis A: Das Chromatogramm der Referenzlösung zeigt am Übergang vom unteren zum mittleren Drittel die Zone des Cumarins.
Das Chromatogramm der Untersuchungslösung zeigt in Höhe der Referenzsubstanz eine Zone.
Detektion B: Anschließend wird die Platte mit methanolischer Kaliumhydroxid-Lösung RH besprüht. Die Auswertung erfolgt im ultravioletten Licht bei 365 nm.
Ergebnis B: Die beschriebenen Zonen fluoreszieren gelbgrün.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,970 bis 0,980
Trockenrückstand (H 2.2.6): mindestens 0,2 und höchstens 0,3 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Streichung des unspezifischen Geruchs bei Droge und Urtinktur
- –
-
Streichung der nasschemischen Identitätsprüfungen wie üblich, da Identitätsprüfung mittels DC ausreichend ist.
- –
-
Bei der Identitätsprüfung mittels DC:
- –
-
Bezug auf 2.2.27
- –
-
Referenzlösung: Änderung des DAB-Reagenzes „Scopoletin RN“ auf das Ph.-Eur.-Reagenz „Scopoletin R“ aufgrund der Streichung im DAB
- –
-
Änderung der Reihenfolge der Referenzsubstanzen der Referenzlösung nach dem Auftreten im Chromatogramm (von unten nach oben)
Ononis spinosa
Verwendet werden die frischen oberirdischen Teile von Ononis spinosa L. zur Blütezeit.
Beschreibung
Die von der Grundachse gebildeten, im unteren Teil häufig verholzten, aufrechten Stängel der ausdauernden Pflanze sind 0,3 bis 0,6 m selten bis 0,8 m hoch und reich verzweigt mit aufrechten oder aufsteigenden Zweigen. Diese tragen zahlreiche blattachselständige, mit Laubblättern besetzte, im oberen Teil zu in der Regel stechenden, oft geteilten Dornen umgewandelte Kurztriebe. Die Stängel sind in jungem Zustand ein- oder zweireihig zottig, sonst verstreut bis drüsig behaart.
Die zahlreichen wechselständigen Laubblätter sind im unteren Stängelbereich dreizählig gefiedert, mit einer größeren, länger gestielten Endfieder, im oberen Bereich, insbesondere in der Blütenregion, häufig ungeteilt und besitzen je zwei mit dem Blattstiel verwachsene, spitz-eiförmige, laubblattartige Nebenblätter. Die Fiederblättchen, in Form und Größe sehr veränderlich, sind gewöhnlich mehr als 3-mal so lang wie breit, eiförmig-länglich, zugespitzt, am Rand gezähnt und nur mit sehr feinen Drüsenhaaren besetzt, sonst überwiegend kahl.
Die in der Regel an den verdornten Kurztrieben gebildeten, kurz gestielten Blüten stehen fast ausschließlich einzeln in der Achsel eines Tragblattes. Der Kelch, der etwa die Länge des Tragblattes erreicht, ist bis auf etwa ein Drittel in fünf schmale Zipfel geteilt, von denen der untere, etwas längere, fast spornförmig nach unten gekrümmt ist, während die übrigen etwas nach oben ausgebreitet sind; er erscheint daher fast zweilippig. Der Kelch ist außen drüsig und verstreut zottig behaart; nach der Blüte wird er kaum verlängert. Die Krone ist rosa oder purpurfarben, gewöhnlich viel länger, bis zweimal so lang wie der Kelch, häufig 10 bis 20 mm lang. Die Kronblätter sind kurz genagelt. Die außen drüsig behaarte Fahne ist oft kreisrund, bisweilen kurz zugespitzt, häufig stark aufgebogen und nur wenig länger als das geschnabelte Schiffchen. Die länglich verkehrt-eiförmigen Flügel sind deutlich kürzer. Die mit ihren Filamenten zum größten Teil zu einer Röhre verwachsenen Staubblätter sind im Schiffchen verborgen.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine helle, gelbgrüne bis dunkle, braungelbe Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 10 ml Urtinktur werden auf 2 bis 3 ml eingeengt. Der Rückstand wird mit 5 ml Wasser R versetzt, die Mischung mit Essigsäure 99 % R auf einen pH-Wert von 3 bis 4 eingestellt und 3-mal mit je 20 ml Ethylacetat R ausgeschüttelt. Die vereinigten organischen Phasen werden filtriert. Das Filtrat wird zur Trockne eingedampft und der Rückstand in 1 ml Ethylacetat R aufgenommen.
Referenzlösung: 10 mg Hyperosid R und 5 mg Scopoletin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Fließmittel: Wasser R, Ameisensäure R, Ethylacetat R (5:5:90 V/V/V)
Auftragen: 20 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l−1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l−1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 Minuten im ultravioletten Licht bei 365 nm.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die orange fluoreszierende Zone des Hyperosids und am Übergang vom mittleren zum oberen Drittel die hellblau fluoreszierende Zone des Scopoletins.
Das Chromatogramm der Untersuchungslösung zeigt wenig oberhalb des Starts eine gelb fluoreszierende Zone, etwa in Höhe der Referenzsubstanz Hyperosid eine orange fluoreszierende Zone und zwischen den Referenzsubstanzen eine orange fluoreszierende Zone. Etwas unterhalb der Referenzsubstanz Scopoletin kann eine blaugrün fluoreszierende Zone erscheinen. Etwa in Höhe der Referenzsubstanz Scopoletin liegen eine blau fluoreszierende Zone sowie oberhalb der Referenzsubstanz Scopoletin eine orange und eine blaugrün fluoreszierende Zone.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,900 bis 0,920
Trockenrückstand (H 2.2.6): mindestens 2,0 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Monographie ist kürzlich in Bezug auf die Anpassung der Textpassage zu den Pyrrolizidinalkaloiden an die aktuell geltenden Anforderungen12, 2 überarbeitet worden.
Nach experimenteller Überprüfung sind jetzt noch die folgenden Änderungen vorgenommen worden:
- –
-
die Ergänzung der HPTLC-Bedingungen
- –
-
der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten.
Packera aurea
Senecio aureus
Verwendet werden die frischen oberirdischen Teile von Packera aurea (L.) A.Löve et D.Löve zur Blütezeit.
Packera aurea kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)13. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Laubblätter sind 50 bis 300 mm lang gestielt, ihre Spreite ist abgerundet, sehr unterschiedlich groß, ausgewachsen bis 220 mm lang und 180 mm breit, beiderseits grün oder gelegentlich unterseits purpurfarben, anfangs oder bisweilen stets dünn, jedoch später meist fast lederig. Der Blattrand ist mit abgerundeten oder stumpflichen Zähnen versehen, gelegentlich auch besonders am Grund scharf gesägt. Der Stängel, zum Teil auch zwei oder mehrere, ist aufrecht, nur im oberen Teil wenig verzweigt, 0,2 bis 1,2 m hoch und, ebenso wie die Laubblätter, kahl oder in jungem Zustand mehr oder weniger fein flockig-filzig behaart, aber rasch verkahlend.
Die ungeteilten, den Stängel umgebenden Grundblätter sind verschieden, aber in der Regel lang und stets dünn gestielt. Ihre Spreite ist fast kreisrund bis eiförmig, am Grund vorwiegend mehr oder weniger stark herzförmig, am oberen Ende breit abgerundet, am Rand gekerbt oder bisweilen gesägt, in der Regel ¾- bis ½-mal so lang wie breit, gelegentlich bis 110 mm lang und breit, oft aber viel kleiner. Die wenigen, wechselständigen Stängelblätter sind stark reduziert, mehr oder weniger einfach fiederspaltig, nach oben hin zunehmend kürzer gestielt bis sitzend.
Die wenigen bis zahlreichen, einzeln lang gestielten Blütenköpfchen bilden in etwa eine lockere Schirmrispe. Sie sind von einem zylindrischen bis glockenförmigen Hüllkelch umgeben, der aus 13 bis 21 in einer Reihe angeordneten, schmal-linealen, bisweilen lineal-lanzettlichen, grünen oder oft purpurfarben überlaufenen, kahlen, 5 bis 11 mm langen und 0,5 bis 1,5 mm breiten Blättchen besteht. Der etwa 5 bis 12 mm breite Blütenstandsboden ist flach und ohne Spreublätter; er trägt am Rand 8 bis 13 goldgelbe weibliche Zungenblüten. Die häufig zugespitzte, etwa 6 bis 13 mm lange Zunge ist mehr oder weniger zurückgebogen und geht basal in eine etwa halb so lange Röhre über. Die zahlreichen scheibenständigen, gelben zwittrigen Röhrenblüten haben eine sehr schmal trichterförmige, nach oben kaum erweiterte, fünfzipflige, 6 bis 10 mm lange Krone. Der unterständige Fruchtknoten beider Blütenarten ist fast zylindrisch, gerippt, kahl und etwa 3,5 bis 4 mm lang. Er trägt an der Spitze einen einreihigen Pappus aus einfachen, sehr weichen und haarartigen Borsten, der länger als die Kronröhre ist.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine braungrüne Flüssigkeit mit heuartigem Geruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 5 ml Urtinktur werden unter vermindertem Druck bis zur Hälfte eingeengt und mit 1 ml gesättigter Natriumchlorid-Lösung R versetzt. Die Mischung wird 2-mal mit je 5 ml Ethylacetat R ausgeschüttelt. Die vereinigten organischen Phasen werden unter vermindertem Druck zur Trockne eingeengt. Der Rückstand wird mit 0,5 ml Ethylacetat R aufgenommen.
Referenzlösung:
50 mg Brenzcatechin R, 10 mg Borneol R und 10 mg Bornylacetat R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254 R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Methanol R, Ethylacetat R, Toluol R (5:20:75 V/V/V)
Auftragen: 20 µl [oder 5 µl] Untersuchungslösung und 10 µl [oder 2 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Detektion: Die Platte wird mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 Minuten lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 Minuten im Tageslicht.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
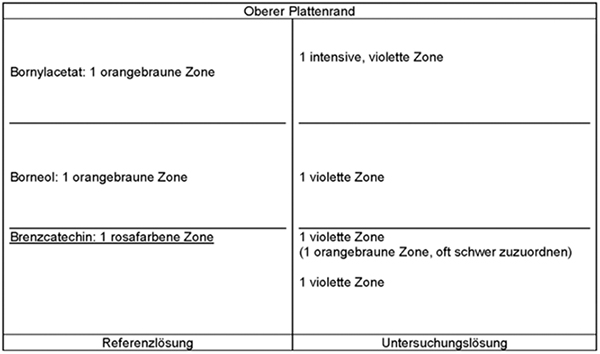
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,900 bis 0,920
Trockenrückstand (H 2.2.6): mindestens 1,6 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
Die Monographie ist kürzlich in Bezug auf die Anpassung der Textpassage zu den Pyrrolizidinalkaloiden an die aktuell geltenden Anforderungen14, 2 überarbeitet worden.
Nach weiterer Überprüfung sind jetzt noch die folgenden Änderungen vorgenommen worden:
- –
-
die Ergänzung der HPTLC-Bedingungen
- –
-
der Ersatz der DC-Beschreibung durch einen schematischen DC-Kasten
Petasites hybridus
Petasites
Verwendet werden die frischen oberirdischen Teile von Petasites hybridus (L.), G. Gaertn., B. Mey. et Scherb. gegen Ende der Blütezeit.
Petasites hybridus kann natürlich vorkommende Pyrrolizidinalkaloide mit einem 1,2-ungesättigten Necin-Gerüst sowie deren N-Oxide enthalten.
Der Gehalt dieser pflanzenspezifischen Pyrrolizidinalkaloide ist nach einer validierten Methode in Anlehnung an 2.8.26 „Pyrrolizidinalkaloide als Verunreinigungen“ des Europäischen Arzneibuchs zu bestimmen. Die Bestimmung kann am pflanzlichen Ausgangsmaterial, der Urtinktur, der homöopathischen Zubereitung oder am Fertigarzneimittel durchgeführt werden. Sie ist nicht erforderlich, wenn sichergestellt ist, dass für Erwachsene die maximal zulässige tägliche Aufnahmemenge von 1,0 μg Pyrrolizidinalkaloiden nicht überschritten wird (basierend auf einem Grenzwert von maximal 0,0237 μg/kg Körpergewicht pro Tag und unter Annahme eines Körpergewichtes von 50 kg)15. Für Kinder und Jugendliche ergibt sich dementsprechend ein niedrigerer Grenzwert unter Berücksichtigung des Körpergewichts der entsprechenden Altersgruppe.
Beschreibung
Die Pflanze hat einen charakteristischen, schwach widerlichen Geruch.
Die gegen Ende der Blütezeit erscheinenden Laubblätter sind in der Knospe rückwärts gerollt, später flach ausgebreitet, herzförmig oder rundlich-nierenförmig, kurz zugespitzt, am Grund tief ausgebuchtet, am Rand scharf ausgebissen, gezähnt, anfangs weich, später derb, oberseits grün, unterseits graufilzig, zur Fruchtzeit bis 1 m lang und bis 0,6 m breit. Der Blattstiel ist ringsum deutlich gerippt, oberseits tief eng gefurcht, bis zum Grund des Blattstiels geflügelt.
Die blütentragenden Stängel erscheinen an anderen Ästen der Grundachse vor den Laubblättern und sind von aufrechter, dicker, röhriger sowie fleischiger Gestalt, zur Blütezeit etwa 400 mm hoch. Sie sind mit zahlreichen weichen, purpurfarbenen, lanzettlichen, oft schlaff herabhängenden Schuppen besetzt.
Die männlichen Pflanzen enthalten in Trauben überwiegend scheinzwittrige Blüten mit röhrig-fünfzähnigem Saum, in denen nur Pollen erzeugt werden, während der Fruchtknoten oft nur als Stiel erscheint. Die eiförmigen Narbenlappen überragen den Kronsaum nicht. Vereinzelt treten allerdings auch ein bis drei voll entwickelte weibliche Blüten mit engröhriger Krone auf, die verkümmerte, einseitig entwickelte Kronzipfel aufweisen können. Während die Narbenlappen wenig hervorragen, fehlen diesen Blüten Staubblätter völlig; doch gibt es bisweilen auch Übergangsformen, auf deren Griffel noch vereinzelte funktionslose Fegehaare sitzen.
Auf den weiblichen Pflanzen nehmen die fertilen Blüten den Randteil des Kopfes ein. In der Scheibenmitte stehen einzeln große, unfruchtbare Honigblüten, deren Kronröhre becherartig erweitert und am Grund mit einer Honigdrüse versehen ist. Durch die Anwesenheit von verkümmerten, selten ganz fehlenden männlichen und weiblichen Geschlechtsorganen sind sie als umgewandelte Zwitterblüten aufzufassen. Die Kopfstände der weiblichen Pflanzen stellen eine längliche Traube oder Rispe dar, bei den männlichen Pflanzen eine kurze Traube. Die Blütenfarbe wechselt von schmutzigpurpur- bis blassrosafarben.
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine dunkelgrüne bis gelbbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 5 mg Hyperosid R und 5 mg Kaffeesäure R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Ameisensäure R, Wasser R, Ethylacetat R (13:20:67 V/V/V)
Auftragen: 20 µl [oder 5 µl] Untersuchungslösung und 10 µl [oder 2 µl] Referenzlösung; 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l−1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l−1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 Minuten im ultravioletten Licht bei 365 nm.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
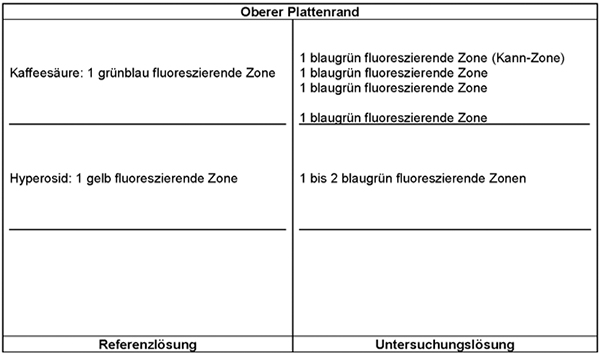
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,895 bis 0,915
Trockenrückstand (H 2.2.6): mindestens 1,1 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Prüfung auf Identität:
- –
-
Streichung der unspezifischen nasschemischen Prüfungen wie üblich, da die Identitätsprüfung mittels DC ausreichend ist.
- –
-
DC-Methode:
- –
-
Ersatz der Beschreibung der Zonen im Text durch einen DC-Kasten
- –
-
Die Referenzsubstanz Vanillin R ist nach dem Besprühen nicht sichtbar, deshalb Korrektur der Angabe und Auswertung bei 254 nm
- –
-
Einsatz eines Fluoreszenzindikators für die Markierung von Vanillin R
- –
-
Ergänzung der HPTLC-Parameter
- –
-
Prüfung auf Reinheit: Bei Trocknungsverlust und Sulfatasche: Anpassung der Spezifikationen basierend auf aktuell vorliegenden Chargendaten
Resina piceae
Abies nigra
Verwendet wird das getrocknete, durch Einschneiden der Rinde von Picea mariana (Mill.) Britton, Sterns et Poggenb. gewonnene Harz.
Eigenschaften
Die Substanz hat einen harzartigen Geruch und besteht aus gelblichen bis rötlich braunen, glasigen Stücken mit glänzendem, gelblich weißem, goldgelbem oder bräunlichem Bruch.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung:
2 g Substanz werden mit 20 ml Ethanol 90 % R versetzt. Die Mischung wird 2 Stunden lang gerührt und anschließend filtriert.
Referenzlösung: 5 mg Vanillin R und 10 µl Eugenol R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel F254R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Cyclohexan R, Ethylacetat R (50:50 V/V)
Auftragen: 8 µl [oder 2 µl] Untersuchungslösung und 20 µl [oder 5 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 15 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird im ultravioletten Licht bei 254 nm im Chromatogramm der Referenzlösung im mittleren Drittel die fluoreszenzmindernde Zone des Vanillins markiert. Anschließend wird die Platte mit Anisaldehyd-Reagenz R behandelt und 5 bis 10 Minuten lang bei 100 bis 105 °C erhitzt. Die Auswertung erfolgt innerhalb von 10 Minuten im Tageslicht.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich.
Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
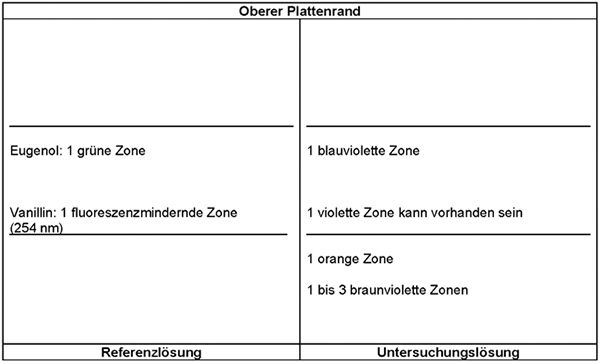
Prüfung auf Reinheit
Trocknungsverlust (2.2.32): höchstens 1,0 %, mit 1,000 g pulverisierter Substanz (500) durch 4 Stunden langes Trocknen im Vakuum bestimmt
Säurezahl (2.5.1): mindestens 140, mit 0,50 g Substanz bestimmt
Sulfatasche (2.4.14): höchstens 0,4 %, mit 1,000 g Substanz bestimmt
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 86 % (m/m)
Die 2. und 3. Dezimalverdünnung werden mit Ethanol 86 % (m/m), die 4. Dezimalverdünnung wird mit Ethanol 62 % (m/m), die folgenden Verdünnungen werden mit Ethanol 43 % (m/m) hergestellt.
Eigenschaften
Die Urtinktur ist eine gelbe bis gelbbraune Flüssigkeit mit aromatisch harzartigem Geruch.
Prüfung auf Identität
Die Urtinktur gibt die Identitätsreaktion der Substanz. Untersuchungslösung ist die Urtinktur.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,840 bis 0,860
Trockenrückstand (H 2.2.6): mindestens 8,5 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Streichung des unspezifischen Geruchs bei der Urtinktur
- –
-
Streichung der nasschemischen Identitätsprüfung wie üblich, da DC-Prüfung ausreichend ist.
- –
-
Bei der Identitätsprüfung mittels DC: Detektion: Änderung des DAB-Reagenzes „methanolische Kaliumhydroxid-Lösung RN“ auf „methanolische Kaliumhydroxid-Lösung RH“ aufgrund der Streichung im DAB (Reagenz wird ausschließlich für die HAB-Monographien benötigt) und Aufnahme ins HAB.
Rheum
Die Droge muss der Monographie Rhabarberwurzel (Ph. Eur.) entsprechen.
Arzneiformen
Herstellung
Urtinktur aus der pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine tiefrotbraune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 0,75 ml Urtinktur werden mit 1 ml Salzsäure R und 20 ml Wasser R versetzt. Die Mischung wird 15 Minuten lang im Wasserbad erwärmt und nach dem Abkühlen mit 30 ml Ether R ausgeschüttelt. Die abgetrennte organische Phase wird über wasserfreiem Natriumsulfat R 1 getrocknet, filtriert und zur Trockne eingedampft. Der Rückstand wird in 0,5 ml Methanol R gelöst.
Referenzlösung: 10 mg Emodin R werden in 5 ml Ethanol 96 % R gelöst. 10 mg Sudan III RN werden in 5 ml Dichlormethan R gelöst. Beide Lösungen werden vereinigt.
Platte: DC-Platte mit Kieselgel R
Auftragen: 20 µl Untersuchungslösung und 10 µl Referenzlösung; bandförmig 20 mm
Fließmittel: Ameisensäure R, Ethylacetat R, Petrolether R (1:25:74 V/V/V)
Laufstrecke: 15 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit methanolischer Kaliumhydroxid-Lösung RH besprüht. Die Auswertung erfolgt im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die rote Zone des Emodins und im mittleren Drittel die rote Zone des Sudan III.
Das Chromatogramm der Untersuchungslösung zeigt zwischen Start und der Referenzsubstanz Emodin mindestens eine rote Zone, in Höhe der Referenzsubstanz Emodin eine rote Zone sowie wenig unterhalb und wenig oberhalb der Referenzsubstanz Sudan III je eine rote Zone.
Prüfung auf Reinheit
Rhaponticinhaltige Rheum-Arten: Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 10 mg Rhaponticin R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R
Auftragen: 20 µl; bandförmig 20 mm
Fließmittel: Methanol R, Ether R (20:80 V/V)
Laufstrecke: 10 cm
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit Molybdatophosphorsäure-Lösung R behandelt. Die Auswertung erfolgt im Tageslicht.
Ergebnis: Das Chromatogramm der Referenzlösung zeigt im unteren Drittel die blaue Zone des Rhaponticins.
Das Chromatogramm der Untersuchungslösung darf in Höhe der Referenzsubstanz keine blaue Zone zeigen.
Relative Dichte (2.2.5): 0,900 bis 0,915
Trockenrückstand (H 2.2.6): mindestens 2,7 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Die botanische Beschreibung ist an aktuell untersuchte Pflanzenmuster angepasst worden.
- –
-
DC-Methode: Die Reihenfolge der Referenzsubstanzen ist nach ihrem Auftreten auf der DC-Platte geändert (von unten nach oben) und die DC-Beschreibung durch einen DC-Kasten ersetzt worden.
- –
-
Der Trockenrückstand ist basierend auf einer repräsentativen Anzahl von Chargendaten auf mindestens 1,5 % geändert worden.
Turnera diffusa
Damiana
Verwendet werden die getrockneten abgerebelten Blätter, Blüten und jungen Teile der Sprossachsen von Turnera diffusa Willd. ex Schult. und ihren Varietäten zur Blütezeit.
Beschreibung
Die Droge hat einen angenehm zitronenartigen Geruch.
Die 5 bis 30 mm langen, 2 bis 10 mm breiten, 1,5- bis 3‑mal, selten bis 4‑mal länger als breiten, an der Spitze abgestumpften Blätter sind an der Basis keilförmig in einen 1 bis 3 mm, selten bis 7 mm langen Blattstiel verschmälert und tragen über der Basis 0,2 bis 1 mm lange, zugespitzte Nebenblätter. Die zugespitzt gekerbten bis gesägten Blätter sind oberseits in der Regel überall dicht oder sehr kurz flaum- oder seidenhaarig oder nur auf dem Mittelnerv schwach feinhaarig, unterseits wenig oder dichter behaart oder in der Regel filzartig und dann grau flaumig-zottig oder selten auf beiden Seiten dicht-kurzwollig behaart. Auf der Unterseite kommen zahlreiche Drüsenhaare vor.
Die bis 1 mm breiten, braunen, behaarten bis verkahlenden oder grünlichen und anliegend feinbehaarten Stängelteile sind rund. Die an der Spitze der Stängel oder an den kurzen Seitenzweigen vor der Blütezeit dicht gedrängt, später entfernt stehenden gelben Blüten sind nicht oder bis 1 mm lang gestielt, zur Fruchtzeit etwa 2,5 mm lang gestielt. Die Nebenblätter gehen über der Basis von den Blütenstielchen ab. Die bis 30 mm langen Blüten tragen zwei gegenständige, längliche bis linealisch-pfriemliche, in der Regel 2 bis 4 mm, selten bis 5 mm lange Vorblätter, die dicht dem fast zylindrischen bis glockenförmigen, verwachsenen Kelch anliegen, der in fünf dreinervige, längliche bis lanzettliche Spitzen ausläuft. Die im unteren Teil verwachsene, den Kelch zur Hälfte bis ein Drittel ihrer Länge überragende Korolle trägt fünf umgekehrt-eiförmige bis länglich-eiförmige, 4,5 bis 7 mm lange und 2 bis 3,5 mm breite Kronblattzipfel. Die längeren der fünf Staubblätter sind etwa 5 mm, die kürzeren 2,5 bis 3,5 mm lang. Der rundliche bis zylindrische, einen dreiteiligen Griffel mit stark zerschlitzter Narbe tragende Fruchtknoten entwickelt sich zu einer eiförmigen bis umgekehrt-eiförmigen oder länglichen, 3 bis 4 mm langen und 2,5 bis 4 mm breiten, mit drei Klappen aufspringenden Frucht. Tragblätter, Kelchblätter und Fruchtknoten sind mehr oder weniger seidenhaarig oder kurz- bis feinwollig behaart.
Schnittdroge: Die Schnittdroge besteht aus den ganzen oder zerfallenen, dicht oder kurz flaum- oder seidenhaarigen, am Rand zugespitzt gekerbten bis gesägten Blättern oder ihren Stücken. Die länglichen, bis 1 mm breiten Stängelteile zeigen Reste von Ansatzstellen der wechselständig angeordneten Blätter. Außerdem finden sich kugelige bis zylindrische, von zwei Vorblättern und dem verwachsenen fünfzipfligen Kelch umgebene, mehr oder weniger weit entwickelte Früchte, die sich bei der Reife dreiklappig öffnen. Nicht selten kommen außen behaarte, auf der konkaven Innenseite glänzende, hellgrüne Klappen der Früchte sowie gelegentlich Teile der Blütenkrone vor.
Mikroskopische Merkmale: Die Blätter sind äquifazial mit einem ober- wie unterseits jeweils einreihigen Palisadenparenchym und nur wenig ausgeprägtem Schwammparenchym. Die Epidermen sind wellig-buchtig. Blattober- und -unterseite sind mit einzelligen, dickwandigen Haaren besetzt. In der Epidermis der Blattunterseite kommen Spaltöffnungen mit zwei bis drei Nebenzellen und Drüsenhaare vor, die auf einem kurzen, mehrzelligen, aber nur eine Zelllage hohen Stiel ein mehrzelliges Drüsenköpfchen tragen, das mit rotbraunem Inhalt gefüllt ist. Die Blätter führen Calciumoxalatkristalle in Form von Drusen oder Einzelkristallen. Der Blattstiel ist ein offenes, von dickwandigen Fasern umgebenes Leitbündel mit kleinen, radial angeordneten Gefäßen. Im Bereich der Epidermis und des Leitbündels liegen Idioblasten mit gelbem Zellinhalt.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: 1 g pulverisierte Droge (180) wird mit 10 ml Ethanol 70 % R versetzt, die Mischung 30 Minuten lang im Wasserbad unter Rückflusskühlung zum Sieden erhitzt und nach dem Erkalten filtriert.
Referenzlösung: 20 mg Arbutin R und 10 mg Hydrochinon R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 µm) [oder DC-Platte mit Kieselgel R (2 bis 10 µm)]
Fließmittel: Wasser R, Methanol R, Ethylacetat R (10:13:77 V/V/V)
Auftragen: 50 µl [oder 13 µl] Untersuchungslösung und 10 µl [oder 3 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 15 cm [oder 6 cm]
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit ethanolischer Molybdatophosphorsäure-Lösung RH behandelt und 5 bis 10 Minuten lang bei 105 bis 110 °C erhitzt. Nach dem Erkalten wird sie in einer Kammer so lange den Dämpfen von Ammoniak-Lösung R ausgesetzt, bis die gelbe Färbung des Untergrunds verschwunden ist. Die Auswertung erfolgt anschließend im Tageslicht.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere Zonen vorhanden sein.
Prüfung auf Reinheit
Fremde Bestandteile (2.8.2): höchstens 10 % Stängelanteile und höchstens 2 % andere fremde Bestandteile
Asche (2.4.16): höchstens 8,0 %
Arzneiformen
Herstellung
Urtinktur aus der pulverisierten Droge (710) und flüssige Verdünnungen nach Vorschrift 4a mit Ethanol 62 % (m/m)
Eigenschaften
Die Urtinktur ist eine braungrüne Flüssigkeit mit stark aromatischem Geruch.
Prüfung auf Identität
Die Urtinktur gibt die Identitätsreaktion der Droge. Untersuchungslösung ist die Urtinktur.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,890 bis 0,905
Trockenrückstand (H 2.2.6): mindestens 1,5 %
Lagerung
Vor Licht geschützt
Anmerkungen zur Monographie:
- –
-
Ausgangsmaterial:
- –
-
Beim Ausgangsmaterial ist, soweit möglich, auf die Ph.-Eur.-Monographie „Frische Heidelbeeren“ Bezug genommen worden (es erfolgt unter anderem keine Aufnahme der mikroskopischen Prüfung und keine Identitätsprüfung mittels DC, da diese Prüfungen in der Homöopathie aufgrund der erforderlichen sofortigen Weiterverarbeitung des frischen Ausgangsmaterials nicht durchgeführt werden können).
- –
-
Die Reinheitsprüfungen sind entsprechend der Ph.-Eur.-Monographie „Frische Heidelbeeren“ übernommen worden, bis auf die Prüfung auf Asche, da diese nur für Drogen relevant ist.
- –
-
Urtinktur:
- –
-
Streichung des unspezifischen Geruchs
- –
-
Streichung der unspezifischen nasschemischen Identitätsprüfungen
- –
-
DC-Methode: Ergänzung der HPTLC-Parameter und Ersatz der DC-Beschreibung durch einen DC-Kasten
Vaccinium myrtillus
Myrtillus
Verwendet werden die frischen reifen Früchte von Vaccinium myrtillus L.
Beschreibung
Die frische Frucht ist eine schwarzblaue, weißlich bereifte, kugelige Beere mit einem Durchmesser von etwa 5 mm. Die Basis zeigt eine Narbe oder, selten, ein Bruchstück des Stiels. Das obere Ende ist leicht eingesenkt und wird von den Resten des Griffels und dem beständigen Kelch überragt, der eine ringförmige Falte bildet. Das violette, fleischige Mesokarp umschließt 4 bis 5 Fächer, die zahlreiche (mehr als 10) kleine, braune, eiförmige Samen enthalten.
Prüfung auf Reinheit
Fremde Bestandteile (2.8.2):
höchstens 2 %; Früchte von Sambucus nigra dürfen nicht vorhanden sein.
Eine Verfälschung mit Sambucus nigra L. wird angezeigt durch das Vorhandensein glänzender, violett-schwarzer, eiförmiger Beeren ohne die vom Kelch stammende, ringförmige Falte, die nicht mehr als 4 Samen enthalten.
Trocknungsverlust (2.2.32): 80,0 bis 90,0 %, mit 5,000 g frisch zerstoßener Droge durch Trocknen im Trockenschrank bei 105 °C bestimmt
Arzneiformen
Herstellung
Urtinktur und flüssige Verdünnungen nach Vorschrift 3a
Eigenschaften
Die Urtinktur ist eine rötlich braune Flüssigkeit.
Prüfung auf Identität
Dünnschichtchromatographie (2.2.27)
Untersuchungslösung: die Urtinktur
Referenzlösung: 10 mg Hyperosid R und 10 mg Gallussäure R werden in 10 ml Methanol R gelöst.
Platte: DC-Platte mit Kieselgel R (5 bis 40 μm) [oder DC-Platte mit Kieselgel R (2 bis 10 μm)]
Fließmittel: Wasser R, Ameisensäure R, Ethylacetat R (10:10:80 V/V/V)
Auftragen: 50 µl [oder 10 µl] Untersuchungslösung und 10 µl [oder 2 µl] Referenzlösung; bandförmig 20 mm [oder 10 mm]
Laufstrecke: 10 cm [oder 6 cm]
Trocknen: im Warmluftstrom
Detektion: Nach Verdunsten des Fließmittels wird die Platte mit einer Lösung von Diphenylboryloxyethylamin R (10 g · l–1) in Methanol R und anschließend mit einer Lösung von Macrogol 400 R (50 g · l–1) in Methanol R behandelt. Die Auswertung erfolgt nach 30 Minuten im ultravioletten Licht bei 365 nm.
Ergebnis:
Die Zonenfolge in den Chromatogrammen von Referenzlösung und Untersuchungslösung ist aus den nachstehenden Angaben ersichtlich. Im Chromatogramm der Untersuchungslösung können weitere fluoreszierende Zonen vorhanden sein.
Prüfung auf Reinheit
Relative Dichte (2.2.5): 0,910 bis 0,930
Trockenrückstand (H 2.2.6): mindestens 3,0 %
Lagerung
Vor Licht geschützt
- 1
- Extrelutsäule-NT20-Fertigsäule
- 2
- Extrelutsäule-NT20-Fertigsäule
- 3
- Bisheriger wissenschaftlicher Name
- 4
- Traditioneller homöopathischer Name
- 5
- PVDF-Filter
- 6
- geeignet ist zum Beispiel eine Pursuit XRS C18 von VARIAN
- 7
- Bekanntmachung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) vom 1. März 2023 „zur Prüfung des Gehalts an Pyrrolizidinalkaloiden zur Sicherstellung der Qualität und Unbedenklichkeit von Arzneimitteln, die homöopathische Zubereitungen aus pflanzlichen Ausgangsstoffen als Wirkstoffe enthalten“
- 8
- „Public Statement on the use of herbal medicinal products containing toxic, unsaturated pyrrolizidine alkaloids (PAs), including recommendations regarding contamination of herbal medicinal products with PAs“ des HMPC vom 7. Juli 2021 (EMA/HMPC/893108/2011 Rev. 1)
- 9
- Bekanntmachung des BfArM vom 1. März 2023 „zur Prüfung des Gehalts an Pyrrolizidinalkaloiden zur Sicherstellung der Qualität und Unbedenklichkeit von Arzneimitteln, die homöopathische Zubereitungen aus pflanzlichen Ausgangsstoffen als Wirkstoffe enthalten“
- 10
- „Public Statement on the use of herbal medicinal products containing toxic, unsaturated pyrrolizidine alkaloids (PAs), including recommendations regarding contamination of herbal medicinal products with PAs“ des HMPC vom 7. Juli 2021 (EMA/HMPC/893108/2011 Rev. 1)
- 11
- Geeignet ist zum Beispiel eine Sep-pak- oder Bondelut-C18-Kartusche
- 12
- Bekanntmachung des BfArM vom 1. März 2023 „zur Prüfung des Gehalts an Pyrrolizidinalkaloiden zur Sicherstellung der Qualität und Unbedenklichkeit von Arzneimitteln, die homöopathische Zubereitungen aus pflanzlichen Ausgangsstoffen als Wirkstoffe enthalten“
- 13
- „Public Statement on the use of herbal medicinal products containing toxic, unsaturated pyrrolizidine alkaloids (PAs), including recommendations regarding contamination of herbal medicinal products with PAs“ des HMPC vom 7. Juli 2021 (EMA/HMPC/893108/2011 Rev. 1)
- 14
- Bekanntmachung des BfArM vom 1. März 2023 „zur Prüfung des Gehalts an Pyrrolizidinalkaloiden zur Sicherstellung der Qualität und Unbedenklichkeit von Arzneimitteln, die homöopathische Zubereitungen aus pflanzlichen Ausgangsstoffen als Wirkstoffe enthalten“
- 15
- „Public Statement on the use of herbal medicinal products containing toxic, unsaturated pyrrolizidine alkaloids (PAs), including recommendations regarding contamination of herbal medicinal products with PAs“ des HMPC vom 7. Juli 2021 (EMA/HMPC/893108/2011 Rev. 1)











Kommentar hinterlassen