Bundesministerium
für Umwelt, Naturschutz, nukleare Sicherheit
und Verbraucherschutz
Bekanntmachung
einer Stellungnahme der Strahlenschutzkommission
„Risikoabschätzung für Hautkrebs durch ionisierende Strahlung“
Nachfolgend wird die Stellungnahme der Strahlenschutzkommission (SSK), verabschiedet in der 329. Sitzung der Kommission am 7./8. Dezember 2023, bekannt gegeben.
S II 2 – 1702/004-2024.0001
Bundesministerium
für Umwelt, Naturschutz, nukleare Sicherheit
und Verbraucherschutz
Im Auftrag
Engelhardt
Risikoabschätzung für Hautkrebs
durch ionisierende Strahlung
Stellungnahme der Strahlenschutzkommission
Verabschiedet in der 329. Sitzung der Strahlenschutzkommission am 7./8. Dezember 2023
Inhalt
| Vorwort | |
| 1 | Einleitung |
| 2 | Datenbasis für die Ermittlung des Risikokoeffizienten für Hautkrebs aus ICRP-Publikation 103 |
| 3 | Material und Methoden (Beschreibung der semisystematischen Literaturrecherche) |
| 4 | Studien zu strahleninduziertem Hautkrebs |
| 4.1 | Life Span Study (LSS) |
| 4.2 | Therapeutisch exponierte Personen |
| 4.3 | Beruflich strahlenexponierte Personen in Nuklearanlagen und medizinischen Einrichtungen |
| 4.4 | Flugpersonal |
| 4.5 | Radonexponierte Bevölkerung |
| 4.6 | Zusammenfassung |
| 4.6.1 | Basalzellkarzinom |
| 4.6.2 | Plattenepithelkarzinom |
| 4.6.3 | Malignes Melanom |
| 4.6.4 | Kombinationen von Hautkrebstypen und andere Subtypen |
| 5 | Ermittlung des Detriments für Hautkrebs |
| 5.1 | Abschätzung des Nominellen Risikokoeffizienten |
| 5.2 | Dosis- und Dosisleistungseffektivitätsfaktor (DDREF) |
| 5.3 | Übertragung auf andere Bevölkerungsgruppen |
| 5.4 | Strahlungsunabhängige Parameter |
| 6 | Stellungnahmen |
| 7 | Abkürzungsverzeichnis |
| 8 | Glossar |
| 9 | Literatur |
| Anhang | |
| A-1 | Index-Liste mit 19 Übersichtsarbeiten und Berichten zu Hautkrebs und Strahlung aus den Jahren 1978 bis 2019 |
| A-2 | Liste mit 76 identifizierten, aber ausgeschlossenen Publikationen |
| A-3 | Übersicht aller identifizierten Studien mit Daten der LSS |
| A-4 | Tabellen mit Details des Studiendesigns (bezogen auf Personengruppen) |
| A-5 | Tabellen mit Ergebnissen (bezogen auf die Hautkrebs-Subtypen) |
| A-6 | Risikokoeffizienten und Detriment D auf der Basis von LSS |
Vorwort
Die Berücksichtigung von Hautkrebs durch ionisierende Strahlung spielt im Strahlenschutz eine besondere Rolle. In der Grundsatzempfehlung der ICRP-Publikation 103 (ICRP 2007) handelt es sich bei Hautkrebs um die Krebsart mit dem größten Unterschied zwischen Inzidenzrisiko und Mortalitätsrisiko. Bezüglich der Inzidenz ist ihr Beitrag zum Gesamtkrebsrisiko größer als der aller anderen Krebsarten zusammen, während die Mortalität weniger als 1 % zum Gesamtrisiko beiträgt.
Auch die Wahl der Parameter, die in die Berechnung des Detriments eingehen, sowie die Modellverfahren zur Übertragung von Risikoschätzungen auf andere Bevölkerungsgruppen weicht für Hautkrebs vom Verfahren für andere Krebsarten deutlich ab. Diese Modelle und die zugrunde liegenden Risikoschätzungen stützen sich auf eine Datenbasis, die noch aus den 1990er Jahren stammt.
Dieser Sachverhalt veranlasste das Bundesministerium für Umwelt, Naturschutz, nukleare Sicherheit und Verbraucherschutz (BMUV), die Strahlenschutzkommission (SSK) zu bitten, den aktuellen wissenschaftlichen Stand der Forschung darzustellen und zu überprüfen, ob die dem gegenwärtigen Strahlenschutz für Hautkrebs zugrunde liegenden Daten, Parameter und Modelle noch dem aktuellen Wissensstand entsprechen.
Die vorliegende Stellungnahme stellt das Ergebnis der Bearbeitung dieses Beratungsauftrags dar und wurde durch eine Arbeitsgruppe der SSK formuliert, der die folgenden Mitglieder angehörten:
- –
-
Prof. Dr. Joachim Breckow, Vorsitzender,
- –
-
Prof. Dr. Hans Drexler,
- –
-
Prof. Dr. Michael Hauptmann,
- –
-
Prof. Dr. Guido Hildebrandt,
- –
-
Dr. Heinz Otten,
- –
-
Dr. Beate Volkmer.
Unterstützt wurde die Arbeitsgruppe durch wesentliche Zuarbeit von Luca Caramenti M.Sc., der als Gast der Gruppe zugeordnet war.
| Prof. Dr. Joachim Breckow
Vorsitzender der Arbeitsgruppe |
Prof. Dr. Daniel Wollschläger
Vorsitzender des |
Prof. Dr. Ursula Nestle
Vorsitzende der |
1 Einleitung
Die Haut als größtes Organ des Menschen ist einer Vielzahl von Umweltnoxen ausgesetzt und spielt auch im Strahlenschutz eine besondere Rolle. So ist die weltweit hohe Inzidenz von Hautkrebs hauptsächlich auf die Exposition durch solare und künstliche UV-Strahlung zurückzuführen. Doch auch bei der Risikobewertung der Exposition durch ionisierende Strahlung findet die Haut besondere Berücksichtigung. Gegenwärtig wird davon ausgegangen, dass vor allem das Basalzellkarzinom (BCC) als ein Subtyp des Hautkrebses1 durch ionisierende Strahlung verursacht werden kann. Für das Auftreten des Plattenepithelkarzinoms (SCC) gibt es nur eine schwache Assoziation, während das maligne Melanom (MM) in Bezug auf ionisierende Strahlung als nicht induzierbar gilt. Im folgenden Text dieser Stellungnahme bezieht sich der Begriff „Strahlung“, wenn nicht anders angegeben, auf ionisierende Strahlung.
Bei der Bestimmung der effektiven Dosis wird der Beitrag des strahleninduzierten Hautkrebsrisikos zum gesamten stochastischen Risiko, wie für andere Organe auch, durch den Gewebe-Wichtungsfaktor wT ausgedrückt. Der Gewebe-Wichtungsfaktor wird vom Inzidenz-Risikokoeffizienten für das entsprechende Organ und der nachfolgenden Berechnung des Detriments (Schadensmaß) abgeleitet. Für fast alle Organe unterscheiden sich der Risikokoeffizient und das Detriment, in das vor allem die Letalität eingeht, um nicht mehr als einen Faktor 2. Hautkrebs dagegen hat nicht nur den mit Abstand größten Inzidenz-Risikokoeffizienten aller Organe (größer als alle anderen zusammen), sondern aufgrund der sehr geringen Letalität des dominierenden BCC nur ein sehr kleines Detriment. Dies führt zu einem Unterschied zwischen Detriment und Risikokoeffizient um den bemerkenswert hohen Faktor 250, das heißt mehr als das Hundertfache gegenüber den anderen Organen (ICRP-Publikation 103 (ICRP 2007, Annex A, Tabelle A.4.1)). Während der Beitrag des Haut-Risikokoeffizienten zum Gesamt-Risikokoeffizienten unter den getroffenen Annahmen von ICRP-Publikation 103 etwa 60 % beträgt, macht das Haut-Detriment zum Gesamt-Detriment lediglich 0,7 % aus. Dieser Umstand ist vor allem dann von weitreichender Bedeutung, wenn ein Vergleich des strahleninduzierten Risikos für Hautkrebs mit dem durch andere Agenzien verursachten Hautkrebsrisiko hergestellt werden soll. Das Detriment für Hautkrebs durch ionisierende Strahlung ist um den Faktor 250 niedriger als der Inzidenz-Risikokoeffizient (vergleiche Tabelle A.4.1, ICRP 2007). Bei der Risikobewertung von ionisierender Strahlung wird im Allgemeinen auf das Detriment Bezug genommen. Jedoch wird bei anderen Risikofaktoren, wie z. B. UV-Strahlung, dafür die Erhöhung der Inzidenz in Abhängigkeit von der Exposition herangezogen. Dieser Umstand führt bei einem Risikovergleich dazu, dass der ionisierenden Strahlung eine 250-fach geringere Bedeutung beigemessen wird als beispielsweise der UV-Strahlung, der keine Schadensgewichtung zugeordnet wird und die sich nur auf die Erhöhung der Inzidenz bezieht.
Die diesen Zusammenhängen zugrunde liegenden Daten gehen teilweise auf Untersuchungen aus den 1990er Jahren zurück. Aufgrund der oben erwähnten und von der ICRP herausgestellten besonderen Bedeutung von Hautkrebs unter allen strahleninduzierten Krebserkrankungen besteht der Bedarf, die wissenschaftliche Datenbasis zu aktualisieren und daraufhin zu überprüfen, ob die gegenwärtig angenommenen qualitativen und quantitativen Aussagen zum Hautkrebsrisiko nach wie vor zutreffend sind. In der vorliegenden Stellungnahme wird der Beratungsauftrag des BMUV vom 26. Juni 2020 bearbeitet, in dem die SSK um die Beantwortung der Fragen gebeten wird,
- –
-
was die aktuelle wissenschaftliche Datenlage zu strahleninduziertem Hautkrebs ist,
- –
-
ob die aktuellen internationalen Empfehlungen zum Schutz vor ionisierender Strahlung dieser Datenlage angemessen Rechnung tragen, insbesondere im Hinblick auf die Bewertung des Hautkrebsrisikos und -detriments,
- –
-
und welche Auswirkungen die gewonnenen Erkenntnisse gegebenenfalls auf die Gewebe-Wichtungsfaktoren der Haut und den Grenzwert für die Haut-Äquivalentdosis haben.
2 Datenbasis für die Ermittlung des Risikokoeffizienten für Hautkrebs aus ICRP-Publikation 103
Der in ICRP-Publikation 103 (ICRP 2007) angegebene Gewebe-Wichtungsfaktor wT = 0,01 für die Haut wird vom entsprechenden Risikokoeffizienten für Haut und der nachfolgenden Berechnung des Detriments abgeleitet. Der Inzidenz-Risikokoeffizient2 („Nominal Risk Coefficient“) ist mit 0,1 Sv-1 der mit Abstand größte Risikokoeffizient aller Gewebe beziehungsweise Organe. Das durch diesen Risikokoeffizienten ausgedrückte zusätzliche Erkrankungsrisiko pro Dosis bezieht sich auf die Inzidenz für das BCC, für das es eine klare Assoziation mit Strahlenexposition gibt. Für das SCC zeigt sich nach ICRP-Publikation 103 ein weniger starker Zusammenhang, während das MM als nicht strahleninduzierbar gilt.
Bei der Ermittlung der Risikokoeffizienten der einzelnen Gewebe beziehungsweise Organe stützt sich ICRP-Publikation 103 ganz wesentlich auf die Inzidenzstudien der Life Span Study (LSS) nach Preston et al. (2007). In dieser Arbeit und auch schon in Ron et al. (1998) finden sich detaillierte Angaben zum MM und zu den nicht-melanozytären Krebsarten BCC und SCC. ICRP-Publikation 103 ordnet diesen Daten jedoch eine zu geringe Aussagekraft zu, um daraus Risikokoeffizienten abzuleiten: „While the LSS studies do provide some information on skin cancer risks (Ron et al. 1998), it was judged that they may not be adequate for a general population because of differences in risk related to skin pigmentation“ (siehe Annex A 113).
Statt sich auf die damals neuen LSS-Inzidenzdaten zu stützen, wendet ICRP-Publikation 103 die unveränderten Risikokoeffizienten aus ICRP-Publikation 60 (ICRP 1991a) an, die sich wiederum auf die ICRP-Publikation 59 „The biological basis for dose limitation in the skin“ (ICRP 1991b) stützen. Hierzu heißt es in ICRP-Publikation 103: „Therefore, the Commission used the nominal skin cancer risk estimate of 0.1 per Gy from Publication 59 (ICRP, 1991a). This estimate was also used in Publication 60 (ICRP, 1991b)“ und: „… the nominal risk estimates for bone and skin are those used in Publication 60 (ICRP 1991b). These estimates are largely based on studies of groups with medical exposures“ (siehe Annex A 118).
Ferner verzichtet ICRP auf ein „Mischmodell“ zur Berücksichtigung des multiplikativen (excess relative risk [ERR] model) und des additiven (excess absolute risk [EAR] model) Anteils zum Hintergrundrisiko. Für die meisten Organe wendet ICRP-Publikation 103 eine Mischung von 50 % ERR zu 50 % EAR an. Für Hautkrebs dagegen kommt es zur ausschließlichen Anwendung von ERR: „Weights of 0.5 were used for all tissues except … skin for which only an ERR model was used.“ (siehe Annex A 140). Hintergrund dieser Wahl und auch der Entscheidung, nicht die LSS-Daten (Preston et al. 2007) anzuwenden, waren die großen Unsicherheiten bei der Übertragung auf andere Bevölkerungsgruppen. In Japan gibt es nur eine sehr niedrige Inzidenzrate für nicht-melanozytäre Hautkrebsformen (z. B. Präfektur Hiroshima, NMSC: 4,2/100 000, IARC 2021), während die Inzidenzraten insbesondere in Europa (z. B. Deutschland, NMSC: 137/100 000, GEKID 2021) außerordentlich hoch sind, sogar die höchsten aller Krebsarten überhaupt. Die Wahl des Anteils aus EAR und ERR in einem „Mischmodell“ hat großen Einfluss auf den ermittelten Risikokoeffizienten. Würde statt des in ICRP-Publikation 103 favorisierten ERR-Modells (100 % ERR zu 0 % EAR) das EAR-Modell (0 % ERR zu 100 % EAR) zur Anwendung kommen und dieses auf andere Bevölkerungsgruppen mit wesentlich höheren Hintergrundraten für Hautkrebs übertragen, so würde sich ein um Größenordnungen geringerer Wert für den Risikokoeffizienten der Haut ergeben. Diese Schwierigkeit bei der Übertragung auf andere Bevölkerungsgruppen mit sehr unterschiedlichen und zudem schwer zu bestimmenden Hintergrundraten für nicht-melanozytäre Hautkrebsarten hat ICRP veranlasst, die Risikoschätzungen in Publikation 103 gegenüber ICRP-Publikation 60 (ICRP 1991a) unverändert zu lassen.
Hautkrebs3 weist nach ICRP-Publikation 103 zwar einen außerordentlich großen Inzidenz-Risikokoeffizienten auf, zeichnet sich auf der anderen Seite jedoch durch eine sehr niedrige Letalität aus. Der Letalitätsfaktor (für Hautkrebs: 0,002) geht als wichtigste Größe in die Berechnung des Detriments ein. Allerdings enthält ICRP-Publikation 103 kaum Angaben über die Datenquellen beziehungsweise zum Verfahren zur Ermittlung des Letalitätsfaktors. Ein möglicherweise ähnliches Verfahren, das zu vergleichbaren Ergebnissen kommt, ist in Breckow et al. (2018) beschrieben.
Aufgrund der sehr geringen Letalität des BCC ergibt sich nach ICRP-Publikation 103 trotz des sehr großen Risikokoeffizienten nur ein sehr kleines Detriment von 4 · 10-4 Sv-1, was schließlich zu einem nur geringen Beitrag der Haut von 0,7 % zum Gesamtdetriment und dem kleinen Gewebe-Wichtungsfaktor für die Haut führt. Dem Hautkrebs, bestimmt durch den Subtyp BCC, wird durch Zuordnung der „minimalen Einschränkung der Lebensqualität“ qmin = 0 im Detriment nur eine sehr schwache Einschränkung der Lebensqualität beigemessen. Hautkrebs ist in ICRP-Publikation 103 das einzige Gewebe mit qmin = 0. Sollten neben dem BCC auch das SCC oder sogar das mit hoher Letalität verbundene MM eine höhere Bedeutung für strahleninduzierten Hautkrebs erlangen und somit in die Abschätzungen für das Hautkrebsrisiko einfließen, so würden sich deutliche Änderungen sowohl für die Einschränkung der Lebensqualität als auch für die Letalität ergeben. Dies könnte sich in einer veränderten Angabe für das Detriment und in der Folge einem veränderten Gewebe-Wichtungsfaktor für die Haut niederschlagen.
3 Material und Methoden (Beschreibung der semisystematischen Literaturrecherche)
Anstelle eines systematischen Reviews mit aufwändiger Suchstrategie in verschiedenen Datenbanken wurde eine semisystematische alternative Methode benutzt, die unter den Bezeichnungen „pearl growing“, „citation mining“ oder „snowballing“ bekannt ist (Badampudi et al. 2015). Es wurden zunächst 19 Übersichtsarbeiten und Berichte zu Hautkrebs und Strahlung aus den Jahren 1978 bis 2019 (siehe Anhang A-1) identifiziert, die der Autorenschaft dieser Stellungnahme bekannt waren. Mithilfe der Publikationsdatenbanken Pubmed und Web of Science (Stand: Mai 2021) wurden 1 508 Publikationen identifiziert, die in diesen 19 Artikeln zitiert werden oder diese zitieren. Anhand von Titel und Abstrakt wurden unter den 1 508 Publikationen solche identifiziert, die die folgenden Einschlusskriterien erfüllen:
- –
-
Endpunkt: BCC, SCC, MM oder nicht-epithelialer Hautkrebs (Sarkom), Inzidenz oder Mortalität, separat oder kombiniert,
- –
-
Exposition: jede Art von ionisierender Strahlung,
- –
-
strahlenbezogenes Risikomaß: Dosis-Wirkungs-Beziehung einschließlich Dosissurrogat,
- –
-
Originalarbeit mit Humandaten,
- –
-
kein Fallbericht,
- –
-
englische oder deutsche Sprache,
- –
-
ab 1990 publiziert.
Zu 100 Publikationen, die die Einschlusskriterien möglicherweise erfüllen, wurden im Verlauf der Auswertung sechs weitere Arbeiten hinzugefügt. Diese sechs Arbeiten waren der Autorenschaft dieser Stellungnahme bekannt und erschienen möglicherweise relevant, befanden sich aber nicht unter den 1 508 identifizierten Arbeiten. Drei dieser Arbeiten betrafen radonexponierte Personen und weitere drei die LSS. Der Volltext aller 106 Publikationen wurde herangezogen, um die Erfüllung der Einschlusskriterien nochmals zu prüfen. Im Fall von mehreren Arbeiten, die Ergebnisse zum selben Endpunkt anhand derselben Daten darstellen, wurde die aktuellste beziehungsweise die umfangreichste Studie berücksichtigt. Relevante Publikationen wurden, wenn vorhanden, durch neuere Folgepublikationen ersetzt. Auf diese Weise wurden schließlich 30 der 106 Publikationen zur weiteren Bewertung identifiziert. Die 76 ausgeschlossenen Arbeiten werden im Anhang A-2 aufgelistet.
Unter den 30 Publikationen befinden sich drei gepoolte Studien (Pukkala et al. 2002, Cardis et al. 1995, Cardis et al. 2007), die wiederum einzelne Kohorten der 30 ausgewählten Arbeiten enthalten. Zwei der 30 identifizierten Studien (Cardis et al. 1995, Haldorsen et al. 2000) wurden ausgeschlossen, da sie ganz oder überwiegend in einer der drei gepoolten Studien enthalten sind.
Im Einzelnen wurde die Studie von Haldorsen et al. (2000) ausgeschlossen, da sie in der gepoolten Studie von Pukkala et al. (2002) enthalten ist. Haldorsen et al. (2000) analysieren dieselbe norwegische Kohorte wie in Pukkala et al. (2002) enthalten mit demselben Follow-up, präsentieren allerdings nur Ergebnisse zum MM, während Pukkala et al. (2002) auch Resultate für BCC und SSC präsentieren. Die in Gudmundsdottir et al. (2017) analysierte Kohorte von 551 isländischen Piloten ist teilweise in Pukkala et al. (2002) enthalten. Allerdings ist die in Gudmundsdottir et al. (2017) ausgewertete Kohorte mehr als doppelt so groß als die isländische Kohorte in Pukkala et al. (2002) und hat ein längeres Follow-up (bis 2015 verglichen mit 1997). Deswegen wurde diese Studie beibehalten.
Weiter wurde die Drei-Länder-Studie von Cardis et al. (1995) ausgeschlossen. Diese Studie enthält 95 673 Personen einschließlich 6 638 Rocky-Flats-Arbeitern. Die 15-Länder-Studie von Cardis et al. (2007) schließt diese 95 673 Personen mit Ausnahme der 6 638 Rocky-Flats-Arbeiter ein.4 Cardis et al. (2007) enthält außerdem kanadische und französische Kohorten, die in Sont et al. (2001), Metz-Flamant et al. (2013) und Samson et al. (2011) zum Teil oder im Ganzen analysiert werden. Von den 191 133 kanadischen Arbeitern, deren Hautkrebsinzidenz bis 1988 Sont et al. (2001) analysieren, enthält Cardis et al. (2007) nur eine Subgruppe von 54 492 Arbeitern, einerseits mit längerem Follow-up bis 1994, andererseits nur für Hautkrebsmortalität. Die französische Kohorte von Metz-Flamant et al. (2013) ist in Cardis et al. (2007) komplett enthalten, Metz-Flamant et al. (2013) analysieren NMSC jedoch als weiteren Endpunkt mit längerem Follow-up als Cardis et al. (2007). Samson et al. (2011) analysieren eine Kohorte von 29 204 CEA-Cogema-Arbeitern mit externer und interner Exposition. Die Arbeiter mit interner und Neutronenstrahlen-Exposition wurden in Cardis et al. (2007) und Metz-Flamant et al. (2013) ausgeschlossen. Mit diesen Begründungen wurden Metz-Flamant et al. (2013), Sont et al. (2001) und Samson et al. (2011) in der Liste beibehalten. Nach dieser Bereinigung verblieben 28 Publikationen.
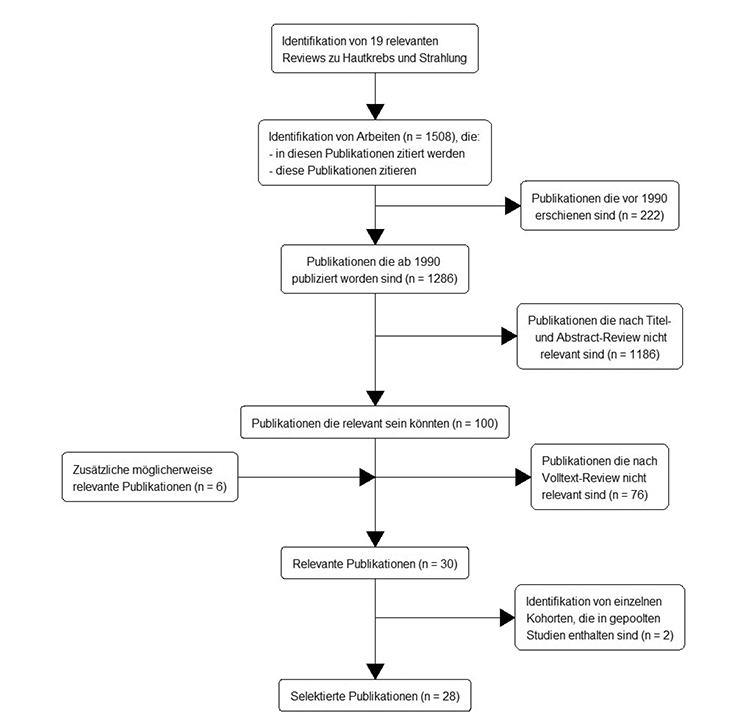
Abbildung 1: Übersicht über die Literaturrecherche (Autoren: Luca Caramenti, Michael Hauptmann)
Abbildung 1 zeigt eine Übersicht über die zugrunde liegende Literaturrecherche. Die identifizierten 28 Artikel können unterteilt werden in therapeutisch exponierte Personen (n = 7), Flugpersonal (n = 6), beruflich Strahlenexponierte in Nuklearanlagen und medizinischen Einrichtungen (n = 11), radonexponierte Bevölkerung (n = 3) sowie LSS (n = 1). Von sieben LSS-Arbeiten, die die Einschlusskriterien erfüllten und wegen ihrer generellen Bedeutung und wegen entsprechender Bezugnahme in anderen Studien weiter unten beschrieben werden, wurde nur die wichtigste jüngere Arbeit in Bezug zu Hautkrebs ausgewählt. Von den sechs nachträglich zugefügten Arbeiten befinden sich die drei Arbeiten über radonexponierte Personen unter den ausgewählten 28 Arbeiten, während keine der drei nachträglich zugefügten LSS-Arbeiten die Einschlusskriterien erfüllt, da entweder keine Ergebnisse zum Hautkrebs präsentiert wurden (eine Studie) oder es sich um Kinder von Atombombenüberlebenden handelte (zwei Studien).
Für jede der 28 ausgewählten Arbeiten wurden die wichtigsten Merkmale in den Tabellen im Anhang A-4 extrahiert und eine Einschätzung über die Stärke der Evidenz für einen kausalen Zusammenhang zwischen Strahlung und Hautkrebs entwickelt.
4 Studien zu strahleninduziertem Hautkrebs
4.1 Life Span Study (LSS)
Wie bereits erwähnt, stützt sich die ICRP in ihrer Publikation 103 (ICRP 2007) generell bei der Ermittlung der Risikokoeffizienten für die einzelnen Organe beziehungsweise Gewebe ganz wesentlich auf die Ergebnisse der Inzidenzstudien der Life Span Study (LSS) zu den Überlebenden der Atombombenabwürfe auf Hiroshima und Nagasaki. Hautkrebs bildete allerdings eine wichtige Ausnahme. Obwohl sich in einigen LSS-Arbeiten bis dahin durchaus Angaben zum MM und zu den nicht-melanozytären Krebsarten BCC und SCC fanden, waren diese nach Ansicht der ICRP zu wenig belastbar, um daraus Risikokoeffizienten für Hautkrebs zu ermitteln (siehe Kapitel 2).
Für die vorliegende Auswertung wurden insgesamt sieben Arbeiten mit Ergebnissen der LSS identifiziert, die die Einschlusskriterien erfüllen (Anhang Tabelle A-3). In Tabelle A-3 sind drei ältere Auswertungen der LSS-Kohorte (Thompson et al. 1994, Little und Charles 1997, Pierce et al. 1996) aufgelistet, die hier nicht näher beschrieben sind. In diesen werden Inzidenz- und Mortalitätsdaten für Hautkrebs eher qualitativ beziehungsweise nur grob quantitativ analysiert. Die Ergebnisse sind in den späteren, hier beschriebenen Arbeiten enthalten.
Ron et al. (1998) berichten in einer Analyse der LSS-Kohorte im Beobachtungszeitraum von 1958 bis 1987 von einer signifikanten Erhöhung des strahleninduzierten Inzidenzrisikos für BCC mit einem vermuteten („with some suggestion“) nicht-linearen Dosis-Wirkungs-Zusammenhang. Als Bezugsdosis („Hautdosis“) wird die individuelle DS86-Kerma5 verwendet, gewichtet als Summe der Gamma-Kerma plus zehnmal der Neutronen-Kerma. Die Einheit für die Hautdosis ist Sv. In der insgesamt 80 149 Personen umfassenden Kohorte werden n = 80 BCC-Fälle beobachtet. Verschiedene nicht-lineare Abhängigkeiten des ERR von der Dosis werden untersucht. Von diesen liefert ein linearer Spline (zwei aneinander anschließende lineare Abschnitte mit unterschiedlichen Steigungen) mit einem Knoten bei 1 Sv die beste Anpassung. Unterhalb von 1 Sv beträgt das ERR/Dosis in diesem Modell 0,7 Sv-1 (90 %-CI: < 0,1 – 2,8). Für eine rein lineare Abhängigkeit, allerdings mit schlechterer Anpassung, ergibt sich ein ERR/Dosis von 1,9 Sv-1 (90 %-CI: 0,6 – 4,3). Als absolutes Zusatzrisiko EAR/Dosis für BCC wird von der Autorenschaft ein Wert von 0,2 (104 PY Sv)-1 (95 %-CI: 0,05 – 0,5) angegeben. Für das SCC (n = 69) und MM (n = 10) werden keine statistisch signifikanten Abhängigkeiten gefunden.
Eine nachfolgende Auswertung von Kishikawa et al. (2005) der gleichen LSS-Kohorte hat vornehmlich die histologische Charakterisierung der Hautkrebstypen zum Thema, bezieht jedoch im Gegensatz zu Ron et al. (1998) zur Schätzung des ERR die Kohortengruppe „not in city“ (NIC) mit ein, so dass für BCC n = 106, für SCC n = 81 und für MM n = 14 Fälle zur Verfügung stehen. Für ein lineares Modell ohne Schwelle (LNT („Linear-No-Threshold“)-Modell) bleibt das ERR/Dosis mit 1,9 Sv-1 gegenüber Ron et al. (1998) unverändert. Um einen Vergleich mit einer UV-Exposition zu ermöglichen, wird das EAR auf die Hautoberfläche normiert (in Einheiten (105 m2 Sv)-1). Es zeigt sich, dass kein signifikanter Unterschied des EAR zwischen UV-exponierten und UV-abgeschirmten Hautpartien besteht.
In Preston et al. (2007) wird der Beobachtungszeitraum der LSS-Kohorte von 1958 bis 1998 erweitert. Als Bezugsdosis (Haut-Äquivalentdosis) wird die individuelle DS02-Kerma verwendet, ebenso wie in Ron et al. (1998) gewichtet als Summe der Gamma-Kerma plus zehnmal der Neutronen-Kerma. Als Einheit für die Haut-Äquivalentdosis wird jedoch Gy verwendet, um zu kennzeichnen, dass keine Gewichtung mit dem Gewebe-Wichtungsfaktor vorgenommen wird. Auch in dieser Studie werden Hinweise auf eine nicht-lineare Dosis-Wirkungs-Beziehung für Non Melanoma Skin Cancer (NMSC, ICD 10: C44) (n = 330) gesehen. Ein Spline-Modell mit einem Knoten bei 1 Gy ergibt die beste Anpassung an die Daten. Für dieses Modell findet sich ein ERR/Dosis von 0,17 Gy-1 (CI: 0,003 – 0,55) für Dosen unterhalb von 1 Gy. Eine weniger gute Anpassung anhand eines LNT-Modells führt zu einem ERR/Dosis von 0,48 Gy-1 (CI: 0,12 – 1,3). Auf der Grundlage der japanischen Hintergrundraten für Hautkrebs und eines LNT-Modells wird als EAR/Dosis ein Wert von 0,35 (104 PY Gy)-1 (CI: 0,0 – 1,1) angegeben. BCC und SCC werden auch separat ausgewertet. Beobachtet wurde eine starke Assoziation für BCC (ERR/Dosis = 0,57 Gy-1, 90 %-CI: 0,18 – 1,38; EAR/Dosis = 1,36 (104 PY Gy)-1, 90 %-CI: 0,6 – 2,4), aber nicht für SCC (ERR/Dosis = 0,17 Gy-1). Für MM wurden n = 17 Fälle beobachtet. Diese wurden jedoch nicht separat, sondern zusammen mit anderen soliden Tumoren analysiert. Obwohl sich ICRP in ihrer Publikation 103 in Bezug auf andere Krebsarten bereits auf die Auswertungen der LSS-Kohorte in Preston et al. (2007) bezieht, ist dies in Bezug auf Hautkrebs wie oben erwähnt nicht der Fall.
Die wichtigste jüngere Arbeit zur Auswertung der LSS-Kohorte in Bezug auf Hautkrebs ist von Sugiyama et al. (2014) für den Beobachtungszeitraum von 1958 bis 1996 (Anhang A-1). Daher werden die Ergebnisse dieser Studie, die ja auch die Daten aller vorangegangenen Studien enthält, hier herangezogen, um die Evidenz der LSS-Daten zum Hautkrebs zu begründen (Tabelle A-4.1). Die Dosimetrie entspricht der von Preston et al. (2007). Aus dem 80 158 Personen (NIC ausgeschlossen) umfassenden Kollektiv werden BCC (n = 123), SCC (n = 114), SCC in situ (n = 64) sowie MM (n = 10) separat identifiziert und pathologisch beziehungsweise histologisch untersucht. Für MM ergibt sich kein statistisch signifikanter Dosis-Wirkungs-Zusammenhang. Der Punktschätzer für das (nicht-invasive) SCC ist sogar negativ, allerdings ebenfalls statistisch nicht signifikant.
Für BCC werden verschiedene Modelle zur Anpassung einer Dosis-Wirkungs-Beziehung geprüft (siehe Abbildung 2). Für die Gruppe der 70-Jährigen, die im Alter von 30 Jahren exponiert wurden, wurde unter Berücksichtigung aller Effektmodifikationen gefunden:
- 1.
-
Spline-Funktionen mit einem Knoten zwischen 0,5 Gy und 1,5 Gy in Schritten von jeweils 0,01 Gy. Unter diesen erweist sich ein Knoten bei 0,63 Gy (95 %-CI: 0,3 – 0,9) als die beste Anpassung. Die Steigung oberhalb von 0,63 Gy ergibt ein ERR/Dosis von 2,0 Gy-1 (95 %-CI: < 0 – 4,3). Für Dosiswerte unterhalb von 0,63 Gy ist die Steigung negativ (-0,05 (95 %-CI: < -0,05 – 1,2)).
- 2.
-
Lineares Modell mit Schwellendosis: Dieses Modell liefert die beste Anpassung mit einem Schwellenwert von 0,63 Gy (95 %-CI: 0,32 – 0,89) und einer Steigung oberhalb davon von 2,0 Gy-1 (95 %-CI: 0,69 – 4,3).
- 3.
-
LNT-Modell: Die beste Anpassung mit diesem Modell liefert eine Steigung von 1,3 Gy-1 (95 %-CI: 0,44 – 2,8).
- 4.
-
Linear-quadratisches Modell: Die beste Anpassung ergibt einen linearen Term von 0,40 Gy-1 (95 %-CI:< 0 – 2,0).
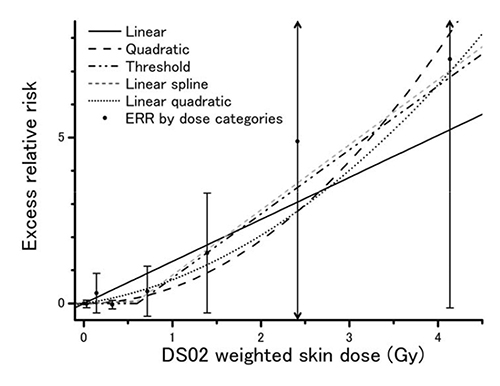
Abbildung 2: Dosis-Wirkungs-Beziehungen für das Basalzellkarzinom (BCC) in der LSS-Kohorte für verschiedene Anpassungsmodelle des zusätzlichen Relativen Risikos (ERR) (aus: Sugiyama et al. (2014), © Radiation Research Society).
Auch andere Modelle, darunter ein rein quadratisches Dosis-Wirkungs-Modell, werden untersucht. Insgesamt ist jedoch unter allen Modellen das lineare Schwellenmodell (Dosisschwelle: 0,63 Gy, Steigung 2 Gy-1) am besten geeignet, um die Dosis-Wirkungs-Beziehung für BCC anzupassen. Als hauptsächlicher Effektmodifikator wird das Alter bei Exposition identifiziert. Es wird eine stetige exponentielle Abnahme des ERR von 11 % pro Jahr nach Exposition angegeben. Auf der Grundlage der Hintergrundraten für BCC in der japanischen Bevölkerung wird mit dem Modell der besten Anpassung (linear mit Schwelle) auch ein EAR bei 1 Gy berechnet. Es ergibt sich dafür ein Wert von 0,059 (CI: < 0 – 0,3) Fälle pro 104 Personenjahre. Dieser Wert ist erheblich kleiner als in Preston et al. (2007). Der Grund hierfür ist die starke Veränderung der Bezugsgrößen im Hintergrundrisiko für BCC in der japanischen Bevölkerung (Preston et al. 2007, Ichihashi et al. 1995). Unterhalb der Schwelle von 0,63 Gy ist für dieses Modell EAR = 0.
Wie bereits in Kishikawa et al. (2005) untersuchen Sugiyama et al. (2014) für BCC auch die Interaktion von UV-Exposition und der Strahlenexposition durch die Atombomben. Die auf die Hautoberfläche normierten (in Einheiten (105 m2 Gy)-1) EAR-Werte zeigen Unterschiede zwischen den Hautpartien, die UV-exponiert waren und jenen, die vor UV abgeschirmt waren. Nach Ansicht der Autorinnen und Autoren lässt sich aufgrund der großen statistischen Unsicherheiten jedoch weder ein additiver noch ein multiplikativer Interaktionseffekt ausschließen.
Überraschend und schwer erklärbar ist die in Sugiyama et al. (2014) beschriebene statistisch signifikante Erhöhung des Risikos für SCC in situ, einer nicht-invasiven intra-epidermalen Art des SCC. Mit dem linearen Modell ohne Schwelle (LNT-Modell) ergibt sich hierfür ein ERR bei 1 Gy von 0,71 (CI: 0,063 – 1,9). Die Autorenschaft betont allerdings, dass die Evidenz für einen kausalen Zusammenhang mit einer Strahlenexposition unsicher sei.
Fazit:
Übereinstimmend konnten in allen bisherigen Auswertungen der LSS-Kohorte keine statistisch signifikanten Dosis-Wirkungs-Zusammenhänge für SCC und MM festgestellt werden.
Für BCC hingegen findet sich ebenso übereinstimmend ein statistisch signifikanter nicht-linearer und aufwärts gekrümmter Zusammenhang zwischen Risiko und Dosis. Die beste Anpassung an die LSS-Daten liefert in der jüngsten Auswertung ein lineares Dosis-Wirkungs-Modell mit Schwelle (Sugiyama et al. 2014). Konservativ betrachtet liegt die untere 95 %-Konfidenzgrenze der Schwellendosis mit 0,3 Gy in einem Dosisbereich oberhalb der meisten im praktischen Strahlenschutz auftretenden Expositionen. Ein reines LNT-Modell, allerdings mit schlechterer Anpassung, liefert eine sehr konservative Abschätzung mit einem Wert für das ERR/Dosis von 1,3 Gy-1. Die Anwendung eines Dosis- und Dosisleistungseffektivitätsfaktors (DDREF) von 2, wie ihn die ICRP auch für die anderen Krebsarten zur Anwendung bringt, würde zu einem ERR/Dosis von 0,65 Gy-1 führen. Der lineare Anteil einer linear-quadratischen Anpassung liefert mit 0,4 Gy-1 einen ähnlichen Wert.
Auch das absolute Risiko für BCC ist auf der Grundlage des Modells mit der besten Anpassung unterhalb einer Schwellendosis von 0,63 Gy nicht erhöht. Zieht man für eine sehr konservative Abschätzung den Wert für EAR bei 1 Gy heran, um linear bis zum Nullpunkt zu extrapolieren, so gelangt man zu einem EAR/Dosis von 0,059 (104 PY Gy)-1.
4.2 Therapeutisch exponierte Personen
Nach therapeutischer Strahlenexposition von Patientinnen und Patienten werden in der medizinischen Literatur der letzten vier Jahrzehnte nahezu ausschließlich BCC mit zumeist geringen spezifischen Inzidenzen von etwa 2 % bis 5 % beschrieben, während SCC sehr selten und MM allenfalls kasuistisch erwähnt werden. Eine Übersicht der selektierten relevanten Studien findet sich in Tabelle A-4.2.
Shore et al. (2002) berichten in ihrer aktualisierten Kohorten-Studie nach therapeutischer Strahlenexposition von Tinea capitis6-Patientinnen und -Patienten im Vergleich zu lediglich mit topischen Medikamenten behandelten nicht-bestrahlten Tinea capitis-Patientinnen und -Patienten im Kindesalter (mittleres Alter neun Jahre, n = 2 224, Kontrollgruppe n = 1 380). Mit bis zu 50 Jahren Nachbeobachtungszeit betrug das relative BCC-Risiko in der Kopf-/Halsregion für Personen mit heller Haut („caucasian“) 3,6 (95 %-CI: 2,3 – 5,9; mittlere Kopfhautdosis 4,8 Gy; 124 bestrahlte Fälle und 21 Kontrollfälle; in-field: ERR/Dosis = 1,7 Gy-1; Feldrand: ERR/Dosis = 0,6 Gy-1). Es wurden keine MM der Kopf-/Halsregion und nur wenige SCC beobachtet. Etwa 40 % der bestrahlten Fälle hatten mehrere BCCs, insgesamt wurden 328 BCCs beobachtet. Obwohl 25 % sowohl der bestrahlten als auch der Kontrollgruppe Personen mit dunkler Haut („afroamericans“) waren, wurden bei diesen nur drei BCCs in der bestrahlten und kein BCC in der nicht-bestrahlten Kontrollgruppe beobachtet. Heller Hauttyp, ausgeprägter Sonnenbrand und nordeuropäische Abstammung waren prädiktive Faktoren für das BCC-Risiko in der bestrahlten Gruppe, chronische Sonneneinstrahlung jedoch nicht. Nach therapeutischer Strahlenexposition im frühen Kindesalter zeigte sich das höchste BCC-Risiko (Alter null bis neun Jahre: ERR = 21; 90 %-CI: 4,1 – 73; Alter > 40 Jahre: ERR = 0,7; 90 %-CI: -0,05 – 2,2). Das relative BCC-Risiko war über die Zeit seit der Exposition ungefähr konstant, was darauf hindeutet, dass das Risiko wahrscheinlich ein Leben lang anhalten könnte.
Eine weitere Arbeit (Ron et al. 1991) analysiert das relative BCC-Risiko an über 10 000 therapeutisch exponierten Tinea capitis-Patientinnen und -Patienten (mittleres Alter sieben Jahre, mittlere Strahlendosis 7 Gy, mittlere Nachbeobachtungszeit 25 Jahre) im Vergleich zu etwa 16 000 Kontrollen in Israel. Insgesamt wurden 80 Hauttumoren im oder in unmittelbarer Nähe des bestrahlten Kopfhautbereichs beobachtet (bestrahlte/unbestrahlte Fälle: gesamt 58/22, BCC 41/13, SCC 0/2, ECC 1/0, MM 2/1, benigne Tumoren 14/6). Das relative NMSC-Risiko betrug 4,2 (95 %-CI: 2,3 – 7,6), das absolute Risiko war 1,2 pro 10 000 Personenjahre (person years, PY) (95 %-CI: 0,8 – 1,7) und unterschied sich nicht signifikant zwischen Männern oder Frauen oder über die Zeit seit der Exposition. Das Risiko war jedoch nach Expositionen in der frühen Kindheit am größten. Bereinigt um Geschlecht, ethnische Herkunft und erreichtes Alter betrug für BCC das geschätzte ERR/Dosis = 1,7 Gy-1 und das EAR/Dosis = 0,31 (10 000 PY Gy)-1. Vergleichbar zu Shore et al. (2002) bewegte sich das Risiko pro Dosis für BCC zwischen dem erhöhten Risiko bei Personen mit heller Haut („caucasian“) und keinem Risiko bei Personen mit dunkler Haut („afroamerican“) und weist erneut auf die mögliche Rolle einer UV-Exposition als Kofaktor für ein strahleninduziertes BCC hin.
Landthaler et al. (1995) analysierten retrospektiv das Auftreten radiogener Ulzera und Hauttumoren an 522 Patientinnen und Patienten mit 612 Bestrahlungsarealen nach Röntgenoberflächentherapie primärer Hautläsionen (mittlere Hautdosis 80 Gy (56 Gy – 184 Gy), minimale Gesamtdosis ≥ 12 Gy, Nachbeobachtungszeit ≥ 10 Jahre). Die Autorenschaft betrachtete epitheliale Hauttumoren als radiogen induziert, wenn sie nach einem Zeitintervall von mehr als zehn Jahren im primär bestrahlten Hautareal auftraten. Es wurden zwölf BCC (2 %), neun SCC (1,5 %) und 58 Ulzera (9,4 %) beobachtet. Es gab keinen Zusammenhang zwischen der Gesamtdosis und der Häufigkeit von sekundären Hauttumoren. Im Gegensatz dazu nahmen radiogene Ulzera mit einer höheren Gesamtdosis zu und traten häufiger bei Patientinnen und Patienten auf, die zum Zeitpunkt der Bestrahlung jünger waren.
Schwartz et al. (2009) untersuchten das BCC-Risiko nach erfolgreicher hämatopoetischer Stammzelltransplantation (HCT) in Bezug auf das Alter bei der Transplantation, das erreichte Alter seit der Transplantation, die ethnische Herkunft, eine durchgeführte Ganzkörperbestrahlung (TBI, Gesamtdosis 7,5 Gy bis 18,4 Gy, 90 % – 95 % Hautdosis in 1 mm bis 3 mm Gewebetiefe) zur Konditionierung und deren Strahlenfraktionierung bei 6 306 Patientinnen und Patienten (mit/ohne TBI: 3 870/2 436, Alter: null bis 65 Jahre, Nachbeobachtung: 100 Tage bis 36,2 Jahre nach HCT). Die altersspezifischen BCC-Inzidenzen bei Patientinnen und Patienten ohne TBI waren höher als die natürlichen Inzidenzen der Normalbevölkerung, die allgemeinen Merkmale waren ähnlich: Die Inzidenzen stiegen mit dem erreichten Alter und waren bei nicht-weißen Patientinnen und Patienten achtmal niedriger. Nach Anpassung an diese Effekte variierte das Risiko bei Patientinnen und Patienten ohne TBI nicht signifikant mit dem Alter bei HCT. Das zusätzliche BCC-Risiko bei Patientinnen und Patienten mit TBI war bei den jüngsten Strahlenexpositionsaltern am größten, wobei die RRs für diejenigen, die im Alter unter zehn Jahren transplantiert wurden, 20 überstiegen und mit zunehmendem Alter bei der Exposition bis zum Alter von 40 Jahren abnahmen. Für Patientinnen und Patienten > 40 Jahre wurde kein erhöhtes Risiko festgestellt. Das relative BCC-Risiko in Abhängigkeit von der Gesamtdosis betrug für TBI vs. keine TBI: 0 Gy vs. 7,5 Gy – 11,99 Gy ergibt ein RR = 48,2; 12,0 Gy – 12,99 Gy ergibt ein RR = 143,5; 13,0 Gy – 14,99 Gy ergibt ein RR = 41,1; 15,0 Gy – 19,0 Gy ergibt ein RR = 29,1; jede Dosis TBI ergibt ein RR = 62,7 (95 %-CI: 28,4 – 109,4). Das RR für Patientinnen und Patienten mit TBI variierte nicht signifikant mit dem erreichten Alter, der Dosisfraktionierung oder der ethnischen Herkunft. Die Risiken pro Dosis bei HCT-Patientinnen und -Patienten waren vergleichbar mit denen anderer Populationen, die im klinischen Umfeld mit ähnlichen Strahlendosen therapeutisch exponiert wurden.
Guérin et al. (2003) untersuchten retrospektiv mögliche therapiebedingte Risikofaktoren für die Entstehung eines MM nach Krebs im Kindesalter. Die Kohorte umfasst 4 401 mindestens Drei-Jahres-Überlebende von 25 120 in den Krebsregistern erfassten Patientinnen und Patienten (Alter unter 20 Jahre) aus acht französischen und britischen Zentren nach Behandlung des Primärtumors. 16 Patientinnen und Patienten entwickelten ein MM als sekundäre maligne Neoplasie. In einer Fall-Kontrollstudie wurden diese 16 Fälle mit drei bis fünf Kontrollen in ihrer jeweiligen Kohorte nach Geschlecht, Alter bei Primärtumor, dem Kalenderjahr des Auftretens des Primärtumors und Nachbeobachtungszeit abgeglichen. Eine primäre Strahlentherapie mit lokalen Dosen (> 15 Gy) schien das MM-Risiko zu erhöhen (OR: 13; 95 %-CI: 0,94 – 174). Nach primärer Chemotherapie mit alkylierenden Substanzen und Spindelinhibitoren lag ebenfalls ein erhöhtes sekundäres MM-Risiko vor (OR: 2,7; 95 %-CI: 0,5 – 14). Kinder, die wegen eines primären gonadalen Tumors behandelt wurden, wiesen ein höheres sekundäres MM-Risiko auf (OR: 8,7; 95 %-CI: 0,9 – 86). Gemeinsame genetische Ursachen von gonadalen Tumoren und MM werden von der Autorenschaft als wahrscheinlich angesehen. Die adjustierte OR/Dosis für die lokale Strahlendosis betrug 1,07 Gy-1 (95 %-CI: 1,00 – 1,15), so dass eine primäre Strahlentherapie möglicherweise zu einem erhöhten sekundären MM-Risiko beitragen kann, jedoch nur bei sehr hohen lokalen Dosen (> 15 Gy) weit oberhalb des für den Strahlenschutz relevanten Bereichs.
Haddy et al. (2012) untersuchten retrospektiv therapiebedingte Risikofaktoren für die Entstehung eines MM nach der primären Behandlung eines Hämangioms. Die Kohorte umfasst 4 620 Patientinnen und Patienten, die vor dem sechzehnten Lebensjahr wegen eines kutanen Hämangioms in Frankreich behandelt wurden und von denen 13 Patientinnen und Patienten ein MM entwickelten. In einer Fall-Kontrollstudie wurden diese 13 Fälle mit je fünf Kontrollen der Kohorte verglichen, die bezüglich Geschlecht, Alter bei Hämangiomtherapie, Kalenderjahr des Auftretens des Hämangioms und Nachbeobachtungszeit übereinstimmte. Die Strahlendosis, die an der Lokalisation des MM bei Fällen und an derselben Lokalisation bei Kontrollen appliziert wurde, wurde geschätzt und als „lokale Dosis“ bezeichnet. Während einer durchschnittlichen Nachbeobachtungszeit von 35 Jahren wurden insgesamt 13 MM registriert, wobei das RR für MM nach einer Hämangiombehandlung in der gesamten Kohorte (n = 4 620) im Vergleich zur Allgemeinbevölkerung 2,5-fach höher war (95 %-CI: 1,4 – 4,1). Bei Patientinnen und Patienten ohne Strahlentherapie (n = 896) betrug das RR = 0,8 (95 %-CI: 0,05 – 3,6) und bei Patientinnen und Patienten mit Strahlentherapie (n = 3 724) 3,0 (95 %-CI: 1,6 – 5,1). Nach Adjustierung für Geschlecht, Alter und Jahr der Behandlung sowie Nachbeobachtungsdauer war das MM-Risiko bei Patientinnen und Patienten, die eine Strahlentherapie erhielten (Ytrium-90) 11,9-mal höher (95 %-CI: 1,4 – 123) als bei Patientinnen und Patienten, die keine Strahlentherapie erhielten. Allerdings war das MM-Risiko in der Fall-Kontrollstudie nicht mit der lokalen Strahlendosis assoziiert, sondern der Anstieg des MM-Risikos wurde bereits bei sehr niedrigen lokalen Dosen beobachtet (< 0,001 Gy: 3,9 (95 %-CI: 0,5 – 32); > 0,01 Gy: 6,9 (95 %-CI: 0,5 – 99)). Die Analyse legt zwar nahe, dass die Strahlentherapie eines kutanen Hämangioms das sekundäre MM-Risiko erhöht, konnte aber keinen Zusammenhang mit der lokalen Dosis nachweisen.
Karlsson et al. (1998) untersuchten in einer Fall-Kontrollstudie unter anderem das sekundäre Risiko nicht-epithelialer Hauttumoren (Sarkome) nach der Behandlung von Patientinnen mit Brustkrebs. Die Kohorte umfasst alle Frauen mit Brustkrebs (n = 122 991), die im Zeitraum von 1958 bis 1992 im schwedischen Krebsregister erfasst wurden. Insgesamt wurden 116 sekundäre Sarkome registriert (SIR7: 1,9; 95 %-CI: 1,5 – 2,2). Das beobachtete absolute Risiko betrug 1,3 pro 10 000 PY (erwartet: 0,7 pro 10 000 PY). Beobachtet wurden 40 kutane Angiosarkome und 76 Weichteilsarkome anderer Subtypen. Die Sarkome waren überwiegend (63 %) in der Brustregion oder am ipsilateralen Arm lokalisiert (67/106). Um den Einfluss der Strahlentherapie, die über den Studienzeitraum mit sehr verschiedenen Behandlungsprotokollen (vor allem konventionelle Röntgentherapie) appliziert wurde, zu untersuchen, berechnete die Autorenschaft die insgesamt absorbierte Energie („integrale Dosis“, Körpergewicht (kg) x Energiedosis (J kg-1)). Ein Zusammenhang zwischen dem sekundären Angiosarkom-Risiko und der integralen Dosis der primären Strahlentherapie bestand nicht. Es wurde lediglich eine signifikante Korrelation des Angiosarkom-Risikos mit einem behandlungsassoziierten chronischen Lymphödem des Arms beobachtet (OR: 9,5; 95 %-CI: 3,2 – 28,0). Für sekundäre Weichteilsarkome anderer Subtypen lag ein Zusammenhang mit der integralen Dosis der primären Strahlentherapie vor. Die Dosis-Wirkungs-Beziehung zeigte, dass das Risiko für sekundäre Weichteilsarkome mit der integralen Dosis linear bis auf 150 J – 200 J anstieg und sich bei höheren integralen Dosen stabilisierte. Für eine integrale Dosis von 50 J, was in etwa der therapeutischen Strahlenexposition der betroffenen Brust nach brusterhaltender Operation entspricht, betrug das OR = 2,4 (95 %-CI: 1,4 – 4,2). Somit korrelierte nur das behandlungsassoziierte chronische Lymphödem des Arms mit dem sekundären kutanen Angiosarkom-Risiko. Für sekundäre Weichteilsarkome anderer Subtypen war die integrale Dosis der Strahlentherapie ein Prädiktor für das Sarkom-Risiko.
Neben den eingeschlossenen ab 1990 publizierten Arbeiten zu therapeutischer Strahlenexposition und sekundären Hauttumoren gibt es noch einige weitere Publikationen, die ebenfalls zeigen, dass ionisierende Strahlung ein sekundäres BCC verursachen kann, aber keine sichere dosisabhängige Zunahme von SCC oder MM (Literatur im Anhang A-2: Lichter et al. 2000, Perkins et al. 2005, Levi et al. 2006, Karagas et al. 2007). Sie zeigen des Weiteren, dass das sekundäre BCC-Risiko nach Strahlenexposition in jungem Lebensalter höher ist als in höheren Lebensjahren (Literatur im Anhang A-2: Karagas et al. 2007) und dass ethnische Unterschiede bestehen (sehr selten BCC bei bestrahlten Personen mit dunkler Haut im Vergleich zu Personen mit heller Haut bei Exposition mit vergleichbarer Dosis), so dass eine mögliche Rolle einer UV-Exposition als Kofaktor für ein strahleninduziertes BCC nicht auszuschließen ist (Shore et al. 2002, Ron et al. 1991). Diese Arbeiten lassen aber keine ergänzenden Aussagen zu einem möglichen Dosisschwellenwert und/oder Dosisabhängigkeit des sekundären BCC-Risikos in Ergänzung zu den Daten der LSS zu und wurden deshalb nicht weiter berücksichtigt.
Wenige Kohorten-Studien nach Primärtherapie von Krebspatientinnen und -patienten berichten erhöhte MM-Risiken, ohne nachweisen zu können, ob ein dosisabhängiger Zusammenhang zwischen ionisierender Strahlenexposition und erhöhtem sekundären MM-Risiko besteht (Guérin et al. 2003, Haddy et al. 2012).
Schließlich werden sekundäre Sarkome nach therapeutischer Strahlenexposition von Brustkrebspatientinnen beschrieben, insbesondere Angiosarkome mit einer Inzidenz von etwa 0,5 % und einer mittleren Latenzzeit von 6,0 Jahren (zwei Jahre bis 57 Jahre), ohne dass bisher eine dosisabhängige Assoziation sicher nachgewiesen werden konnte (Karlsson et al. 1998).
4.3 Beruflich strahlenexponierte Personen in Nuklearanlagen und medizinischen Einrichtungen
Hier werden Studien zu allen beruflich strahlenexponierten Gruppen außer Flugpersonal beschrieben (Tabelle A-4.3). Studien bei Piloten und anderen Besatzungsmitgliedern werden im Abschnitt 4.4 zusammengefasst. Da es sich bei den hier beschriebenen Studien häufig um große Kohorten mit ausschließlich Mortalitätsendpunkten handelt, betreffen die Ergebnisse bezüglich Hautkrebs überwiegend das MM.
In einer Fall-Kontrollstudie zum Melanom von Moore et al. (1997) unter Beschäftigten des Lawrence Livermore National Laboratory wurden zu 69 prävalenten Fällen, die im Zeitraum 1969 bis 1989 diagnostiziert wurden, 69 Kontrollen gematched nach Geschlecht, Alter, Datum Einstellung, Schul- und Ausbildungsjahre, Dauer der Anstellung und Ruhestand ja/nein. Die kumulative Exposition durch Gamma-, Neutronen- und Tritium-, Hand- und Hautdosis wurde aus Dosimeterwerten individuell geschätzt. Der Durchschnitt der Summe der fünf Expositionen betrug 7,6 mSv unter den Fällen und 7,1 mSv unter den Kontrollen. Ergebnisse eines formellen Vergleichs zwischen Fällen und Kontrollen wurden nicht berichtet.
In einer Fall-Kontrollstudie unter Beschäftigten des Lawrence Livermore National Laboratory (Austin und Reynolds 1997) mit 31 MM-Fällen zwischen 1969 und 1980 und 110 individuell gematchten Kontrollen ergab sich ein OR von 2,3 (95 %-CI: 1,0 – 7,6) für den Vergleich von strahlenexponierten mit anderen Personen und ein OR von 1,12 pro exponiertem Jahr Arbeit (p = 0,017), adjustiert für Ausbildung, Muttermale, familiäre Vorbelastung mit Hautkrebs, frühere NMSC-Diagnosen, Exposition gegenüber flüchtigen fotografischen Chemikalien, Alter, Ethnizität und Geschlecht.
Sont et al. (2001) evaluierten die MM-Inzidenz unter 191 333 Beschäftigten von Kernanlagen im National Dose Registry of Canada. Zwischen 1969 und 1988 wurde laut Krebsregister bei 222 Personen ein MM diagnostiziert. Mithilfe von individuellen Dosimeterwerten aus dem Zeitraum 1951 bis 1988 wurde die kumulative Ganzkörperdosis berechnet (mit einem Lag von zehn Jahren), die im Durchschnitt bei 6,64 mSv lag. Adjustiert für Alter, Geschlecht und Geburtsjahr ergab eine Poisson-Regression ein ERR pro Dosis von 0,43 pro 100 mGy (90 %-CI: < 0 – 1,96).
Freedman et al. (2003) beschrieben die MM-Inzidenz unter 68 588 radiologisch-technischen Assistentinnen und Assistenten in den USA. Zwischen 1926 und 1998 traten 207 MM-Fälle während eines durchschnittlichen Follow-up von 10,2 Jahren auf. Als Surrogat für die erhaltene Strahlendosis am Arbeitsplatz, die nicht quantifiziert wurde, diente die anhand von selbstberichteten Arbeitsanamnesen rekonstruierte Beschäftigungsdauer in verschiedenen Zeiträumen. Aufgrund externer Evidenz gab es im Zeitraum vor 1950 das größte Potenzial für relevante Expositionen am Arbeitsplatz, während die Exposition danach durch Arbeitsschutzmaßnahmen deutlich reduziert wurde. Adjustiert für Hauttyp, Augen- und Haarfarbe, NMSC-Diagnosen in der Vergangenheit, familiäre Belastung mit MM und Sonnenlichtexposition am Wohnort wurde für eine mehr als fünfjährige Beschäftigungsdauer vor 1950 ein RR von 2,4 (95 %-CI: 0,7 – 8,7) berechnet verglichen mit weniger als fünf Jahren (p-Trend = 0,03). Für nachfolgende Zeiträume wurde keine Assoziation beobachtet.
In der 15-Länder-Studie von Cardis et al. (2007) wurden unter 407 391 Beschäftigten von Kernanlagen aus 15 Ländern während durchschnittlich 12,7 Jahren Follow-up 87 Todesfälle mit MM als Ursache auf dem Totenschein beobachtet. Die anhand von Dosimeterwerten rekonstruierte kumulative Ganzkörperdosis betrug durchschnittlich 19,4 mSv. Das ERR/Dosis wurde mit Poisson-Regression berechnet und adjustiert für Geschlecht, Alter, Kalenderjahr, sozioökonomischen Status und Kernanlage und betrug -0,72 Sv-1 (90 %-CI: < 0 – 1,93).
In zwei Kohorten von Beschäftigten französischer Kernanlagen, 14 796 mit ausschließlich externer und 14 408 mit externer und interner Exposition, untersuchten Samson et al. (2011) die auf Basis von Totenscheinen erhobene MM-Mortalität (vier und zwölf Todesfälle im Zeitraum 1968 bis 1994). Schätzungen der kumulativen effektiven Dosis gingen auf individuelle Dosimeterwerte zurück. Die durchschnittliche Dosis betrug 3,7 mSv (Kohorte mit ausschließlich externer Exposition) und 12,9 mSv (Kohorte mit externer und interner Exposition). Mittels Poisson-Regression und einer Anpassung von elf Kategorien der kumulativen effektiven Dosis als stetige Variable wurde kein signifikanter Dosis-Wirkungs-Zusammenhang beobachtet, adjustiert für Alter, Geschlecht, Kalenderjahr, sozioökonomischen Status und Dauer des Arbeitsverhältnisses. Numerische Ergebnisse wurden nicht präsentiert.
Muirhead et al. (2009) werteten Mortalitätsdaten von 174 541 Beschäftigten aus dem National Registry for Radiation Workers (NRRW) in Großbritannien aus. Während eines mittleren Follow-up von 22 Jahren erkrankten laut Krebsregister zwischen 1976 und 2001 261 Personen an einem MM und 326 an NMSC. Individuelle Dosimeterangaben ergaben eine mittlere kumulative effektive Dosis von 24,9 mSv. Adjustiert für Alter, Geschlecht, Kalenderjahr, Jobkategorie und ersten Arbeitgeber ergab sich ein lineares ERR/Dosis von 1,39 Sv-1 (95 %-CI: -0,65 – 5,6) für MM und von 1,50 Sv-1 (95 %-CI: 0,05 – 3,85) für NMSC.
Metz-Flamant et al. (2013) untersuchten 59 021 Beschäftigte der French Atomic Energy Commission and Nuclear Fuel Company mit einem mittleren Follow-up von 25,9 Jahren und beobachteten 68 Todesfälle durch MM und sieben durch NMSC im Zeitraum 1968 bis 2004, basierend auf Totenscheinen. Die durch individuelle Dosimeterwerte rekonstruierte Ganzkörperdosis betrug im Durchschnitt 22,5 mSv unter den Exponierten. Adjustiert für Geschlecht, Alter, Kalenderperiode, Firma und sozioökonomischen Status ergab eine Poisson-Regression mit loglinearem Dosisterm ein ERR/Dosis für NMSC von 126,5 Sv-1 (90 %-CI: 7,03 – 1916), für MM ergab sich ein negatives ERR/Dosis mit einem p-Wert von 0,72.
Unter 22 377 Beschäftigten der Plutonium-Produktionsanlage Mayak in Russland wurden zwischen 1948 und 2013 anhand von medizinischen Patientenakten und Archiven durch Azizova et al. (2018) 60 inzidente MM-Fälle und 294 Fälle von NMSC beobachtet während eines durchschnittlichen Follow-up von 25,5 Jahren (MM) und 25,2 Jahren (NMSC). Die mittels der Arbeitshistorie geschätzte kumulative Hautdosis betrug im Mittel 0,54 Sv. Adjustiert für Geschlecht, Alter, Kalenderjahr und Neutronendosis ergab sich mit Poisson-Regression ein ERR/Dosis für NMSC von 0,51 Sv-1 (95 %-CI: 0,22 – 0,93) und für MM von 0,15 Sv-1 (95 %-CI: -0,41 – 1,31).
In derselben Kohorte, aber mit Krebsinzidenz bis 2018 (Azizova et al. 2021) traten 295 BCC und 48 SCC auf (mittleres Follow-up 26,3 Jahre für BCC und 26,4 Jahre für SCC). Die mittlere kumulative Hautdosis für Gammastrahlung betrug 0,50 Gy. Adjustiert für Geschlecht, Alter und Kalenderjahr ergab sich mit Poisson-Regression ein ERR/Dosis von 0,57 Gy-1 (95 %-CI: 0,27 – 1,03) für BCC und 0,14 Gy-1 (95 %-CI: -0,23 – 0,91) für SCC.
In derselben Kohorte wie Freedman et al. (2003), radiologisch-technische Assistentinnen und Assistenten in den USA, untersuchten Lee et al. (2015) das Risiko für ein BCC unter 65 719 Personen, von denen 3 615 während des durchschnittlichen Follow-up von 17 Jahren zwischen 1983 und 2005 eine BCC-Diagnose erhielten. Anhand von Dosimetern und Information über den Arbeitsplatz wurde die absorbierte Hautdosis geschätzt. Diese lag im Mittel bei 55,8 mGy. Das geschätzte ERR/Dosis betrug -0,01 Gy-1 (95 %-CI: -0,43 – 0,52) und war adjustiert für Ausbildung, Einkommen, Rauchen, Alkoholkonsum, BMI, körperliche Aktivität, Augenfarbe, Hautfarbe, Sonnenbrände, Zahnröntgenaufnahmen, solare UV-Exposition, Geschlecht, Alter und Kalenderjahr.
Die hier dargestellten Studien sind überwiegend sehr aufwändige und große Kohortenstudien. Die Information zur beruflichen Strahlenexposition geht weitgehend auf individuelle und gemessene Werte zurück. Die mittlere Strahlendosis lag, soweit angegeben, deutlich unter 100 mSv (beziehungsweise mGy) bis auf die beiden Studien der Mayak-Kohorte mit mittleren Dosen von ca. 0,5 Gy (Azizova et al. 2018, 2021). In den Risikoanalysen wurde in aller Regel für unterschiedliche Confounder adjustiert. UV-Strahlung wurde allerdings nur in den beiden Studien unter radiologisch-technischen Assistentinnen und Assistenten in den USA als möglicher Confounder berücksichtigt (Freedman et al. (2003), Lee et al. (2015)), und diese beiden Studien benutzten keine individuellen Dosisschätzungen, sondern die Beschäftigungsdauer. In mehreren Studien waren ausschließlich Mortalitätsdaten verfügbar. In der Regel beschränkte sich die Analyse dann aber auf das MM. Zusammenfassend gab es unter den hier beschriebenen Studien eine Studie bezüglich SCC (Azizova et al. 2021) und aus dieser Studie ergibt sich keine Evidenz für eine Dosis-Wirkungs-Beziehung. Zu BCC gab es zwei Studien, eine mit starker (Azizova et al. 2021) und eine ohne Evidenz für eine Dosis-Wirkungs-Beziehung (Lee et al. 2015). Die Kombination von SCC und BCC (NMSC) wurde in zwei Studien untersucht mit einmal starker (Azizova et al. 2018) und einmal schwacher Evidenz für eine Dosis-Wirkungs-Beziehung (Muirhead et al. 2009). Keine der neun Studien zum MM ergab einen Hinweis auf eine Dosis-Wirkungs-Beziehung.
4.4 Flugpersonal
Die beruflich bedingte Strahlenexposition durch ionisierende Strahlung wird in Deutschland im deutschen Strahlenschutzregister erfasst. Aus diesen Daten wurde ermittelt, dass Flugpersonal während des Fluges, insbesondere in großen Höhen und bei Polnähe, mit 2 mSv bis 6 mSv pro Jahr einer erhöhten Exposition durch kosmische Strahlung ausgesetzt ist (Frasch et al. 2015). Im Gegensatz zur Exposition durch ionisierende Strahlung wird die Exposition durch UV-Strahlung der Sonne stark vom Verhalten des Individuums beeinflusst. Dies gilt insbesondere in der Freizeit und für Beschäftigte im Freien auch für den beruflichen Alltag. Um hier die UV-Exposition zu minimieren, besteht eine Angebotsvorsorge des Arbeitgebers. Die beruflich bedingte UV-Exposition von Flugpersonal wird nicht regelmäßig erfasst. Für Flugpersonal ist eine eher geringe UV-Exposition während des Fluges zu erwarten. Während eine frühere Studie keine UV-Exposition für das Flugpersonal berichtet (Diffey 1999), beschreibt eine aktuelle Studie, in der die UVA-Exposition während des Fluges gemessen wurde, eine erythemgewichtete Bestrahlung von 0,1 SED (Standard Erythemdosis) für Piloten auf innereuropäischen Flügen. Die beruflich bedingte, kumulierte Dosis ionisierender Strahlung und UV-Strahlung hängt generell von der Beschäftigungszeit und damit oft vom Lebensalter ab.
Um mögliche arbeitsbedingte Risiken in Bezug auf die Exposition durch ionisierende Strahlung aufzudecken, wurden zahlreiche Studien aufgelegt, die das Krebsrisiko von Flugpersonal untersuchen. Häufig schließen diese Studien auch das Hautkrebsrisiko ein, so dass als Ergebnis Hinweise auf die Induktion von Hautkrebs durch ionisierende Strahlung erwartet werden können. Die in Kapitel 3 beschriebene, selektive Literaturrecherche identifizierte sechs Veröffentlichungen zu diesem Thema (Tabelle A-4.4). Die Untersuchung des standardisierten Mortalitätsverhältnisses (SMR) oder des SIR zeigte bei den meisten Krebsentitäten kein erhöhtes Risiko. Eine Ausnahme bildete fast immer das Hautkrebsrisiko, das oft, wenn auch nicht immer statistisch signifikant, erhöht war. Alle Studien beziehen Daten für das MM ein, drei Studien umfassen darüber hinaus Daten zu nicht-melanozytärem Hautkrebs (NMSC), davon werten drei Studien getrennt Daten zum BCC aus. Als Grund für das erhöhte MM-Risiko wird zum Teil neben der Belastung durch kosmische Strahlung auch eine Störung des zirkadianen Rhythmus diskutiert. In allen Studien wird allerdings eine erhöhte UV-Exposition in der Freizeit beziehungsweise in den Pausenzeiten zwischen den Flügen angenommen und in den meisten Studien als sehr wahrscheinlich angesehen. In einer Studie von Rafnsson et al. (2003) zeigte eine Befragung, dass Flugpersonal im Vergleich zur Normalbevölkerung eine höhere Prävalenz für sonnige Urlaube hat. Das erhöhte NMSC-Risiko wird ebenfalls am ehesten einer erhöhten UV-Exposition zugeschrieben. Eine Studie diskutiert einen möglichen Dosiseffekt für das BCC im Zusammenhang mit der erhöhten Exposition durch ionisierende Strahlung.
Ein Großteil der Kohorten stammt aus Skandinavien (Dänemark, Finnland, Island, Norwegen, Schweden), eine große Kohorte stammt aus Deutschland, beschrieben werden außerdem Daten aus Italien und den USA. Es sei darauf hingewiesen, dass die Daten der Einzelkohorten häufig in gepoolte Auswertungen eingeflossen sind. Darüber hinaus wurden Daten aus den Einzelkohorten auch getrennt ausgewertet und veröffentlicht. Im Folgenden werden die Ergebnisse der einzelnen Studien detaillierter beschrieben.
Dreger et al. (2020) berichten über eine große retrospektive Kohortenstudie (Deutsche Kohorte) zur Krebsmortalität von Flugpersonal im Zusammenhang mit der Exposition durch kosmische Strahlung. Die Studie berücksichtigt Daten in einem Zeitraum von 1960 bis 2014 und schließt 26 846 Personen (Cockpit- und Kabinenpersonal) ein. Eine große Stärke dieser Studie ist die Nutzung von individuellen Expositionsdaten von 2004 bis 2014, die im deutschen Strahlenschutzregister erfasst wurden. Die Expositionsdaten von 1960 bis 2003 konnten auf Grundlage dieser Daten abgeschätzt werden. So konnte eine mediane kumulative effektive Dosis von 34,2 mSv ermittelt werden. Für fast alle untersuchten Krebsentitäten ergab sich ein SMR < 1. Nur für männliche Piloten wurde für das MM ein nicht signifikant erhöhtes SMR von 1,88 (95 %-CI: 0,78 – 3,85) ermittelt. Ein signifikanter dosis-assoziierter Anstieg des SMR konnte für keine der untersuchten Krebsentitäten beobachtet werden. Das gilt auch für das leicht erhöhte relative Risiko pro Dosis von 1,29 pro 10 mSv (95 %-CI: 0,78 – 2,4) für das MM unter männlichen Piloten. Der Einfluss einer erhöhten UV-Exposition in den Pausenzeiten, die den erhöhten SMR und RR-Werten zugrunde liegen könnte, wird von der Autorenschaft nicht ausgeschlossen.
Pinkerton et al. (2018) berichten über eine retrospektive Kohortenstudie (USA Kohorte) zur Krebsinzidenz (MM, Schilddrüsenkrebs und gynäkologische Krebsentitäten) in 6 095 Flugbegleiterinnen. Die Daten wurden per Fragebogen erhoben. Die Expositionsdaten wurden anhand der Flugpläne kalkuliert. Ein Zusammenhang der MM-Inzidenz mit den ermittelten Messwerten der kumulativen Exposition durch kosmische Strahlung wurde nicht beobachtet. Eine positive, nicht statistisch signifikante Assoziation wurde für das MM-Risiko (Hazard Ratio HR = 1,08 95 %-CI: 0,95 – 1,21) in Zusammenhang mit Langstreckenflügen („SSI travel“, Flüge mit einem standardisierten Schlafinterval) gefunden. Die Autorenschaft diskutiert hierzu den Einfluss eines gestörten zirkadianen Rhythmus oder eine erhöhte UV-Exposition in den Pausenzeiten.
Gudmundsdottir et al. (2017) berichten über eine Kohortenstudie (Island-Kohorte), in die 551 männliche Piloten eingeschlossen wurden. Davon waren 286 bei Icelandair angestellt und haben regelmäßig Transatlantikflüge durchgeführt (ein Teil der Kohorte ist in der Studie von Pukkala et al. (2002) enthalten). Die übrigen 265 Piloten waren bei anderen Fluggesellschaften tätig und führten keine Transatlantikflüge durch. Die individuelle kosmische Exposition wurde aus den Flugstunden der Piloten und den Dosisleistungen, modelliert für typische Flugrouten bestimmter Flugzeugtypen, ermittelt. Für die Piloten von Icelandair ergab sich eine mediane kumulative Dosis von 22,55 (0,28 – 83,20) mSv. Die Studie berücksichtigt Daten in einem Zeitraum von 1955 bis 2015. Für die Gesamtheit der untersuchten Krebsentitäten ergab sich ein SIR von 0,9 (95 %-CI: 0,71 – 1,11). Bezogen auf alle 551 Piloten ergab sich für das MM ein SIR von 3,31 (95 %-CI: 1,33 – 6,81) und für das BCC ein SIR von 2,49 (95 %-CI: 1,69 – 3,54). In einer weiteren Auswertung der Daten wurde das relative Risiko für die Icelandair-Piloten im Vergleich zu den übrigen Piloten (Referenz) in Abhängigkeit von der kumulativen Dosis bestimmt. Hierbei ergab sich für das MM ein Anstieg des RR von 5,07 (95 %-CI: 0,14 – 201,23) bei einer Exposition durch < 25 mSv auf 9,88 (95 %-CI: 1,57 – 86,61) bei einer Exposition durch > 25 mSv, (p-Trend 0,009). Für das BCC ergab sich für die gleiche Strahlenexposition ein Anstieg des RR von 1,92 (95 %-CI: 0,49 – 7,23) auf 3,61 (95 %-CI: 1,64 – 8,84, p-Trend 0,0005). Ein ähnliches Freizeitverhalten von Piloten und der übrigen Bevölkerung zugrunde legend (Rafnsson et al. 2003) sieht die Autorenschaft eine erhöhte UV-Exposition der Piloten in der Freizeit nicht als einzigen Grund für das erhöhte MM-Risiko. In Bezug auf das BCC zieht die Autorenschaft aufgrund der starken dosisabhängigen Trends und der Tatsache, dass ein Teil der Karzinome am Rumpf auftrat, einen Zusammenhang mit der erhöhten Strahlenexposition in Betracht.
Pukkala et al. (2012) berichten über eine Kohortenstudie zur Krebsinzidenz (Kohorten aus Finnland, Island, Norwegen und Schweden) in die 8 507 Flugbegleiterinnen und 1 559 Flugbegleiter aus einem Zeitraum von 1947 bis 1997 eingeschlossen wurden. Die kosmische Exposition wurde aus den Flugprofilen und den Dosisraten unter Verwendung der EPCARD Software abgeschätzt. Für die Flugbegleiterinnen ergab sich eine signifikant erhöhte Inzidenz für das MM (SIR = 1,85; 95 %-CI: 1,41 – 2,38) und eine erhöhte Inzidenz für das BCC (Daten nur aus Finnland und Island) (SIR = 2,39; 95 %-CI: 1,80 – 3,10). Für die Flugbegleiter ergab sich eine signifikant erhöhte Inzidenz für das MM (SIR = 3,00; 95 %-CI: 1,78 – 4,74) und für nicht-melanozytären Hautkrebs (außer BCC) (SIR = 2,47; 95 %-CI: 1,18 – 4,53). Ein dosisabhängiger Trend konnte für keine der untersuchten Krebsentitäten ermittelt werden, auch eine auf Basis der Daten durchgeführte Fall-Kontrollstudie zeigte keine Hinweise auf den Einfluss kosmischer Strahlung. Dies gilt auch für weitere Krebsentitäten mit einer signifikant erhöhten Inzidenzrate: Brustkrebs und Leukämie (Flugbegleiterinnen), Kaposi-Sarkom, Kehlkopfkrebs und Rachenkrebs (Flugbegleiter). Die Autorenschaft diskutiert, dass das erhöhte Hautkrebsrisiko der Belastung durch UV-Strahlung zuzurechnen ist.
Langner et al. (2004) berichten über eine große europäische retrospektive Kohortenstudie (ESCAPE) (Einzelkohorten aus Skandinavien, Deutschland und Italien) zur Krebsmortalität im Zusammenhang mit der Exposition durch kosmische Strahlung, in die 19 184 männliche Piloten (in einem Zeitraum von 1921 bis 1997) eingeschlossen wurden. Die mittlere Lebenszeitdosis wird mit 15,3 mSv angegeben, ermittelt aus den Flugstunden der Piloten und den Dosisraten, modelliert für typische Flugrouten bestimmter Flugzeugtypen. Für fast alle untersuchten Krebsentitäten wurde ein SMR signifikant < 1 ermittelt, mit einem negativen Trend mit steigender Dosis. Für MM wurden SMRs > 1 (1,51; 95 %-CI: 0,48 – 3,6; 1,38; 95 %-CI: 0,28 – 4,19; 2,37; 95 %-CI: 0,77 – 5,7 und 0,66; 95 %-CI: 0,02 – 3,91) für die Dosisbereiche 0 mSv bis 4,99 mSv, 5 mSv bis 14,99 mSv, 15 mSv bis 24,99 mSv und ≥ 25,0 mSv ermittelt, allerdings ohne statistische Signifikanz. In Bezug auf SMR und RR wurde für das MM kein dosisabhängiger Trend beobachtet. Eine erhöhte UV-Exposition der Piloten als Grund für die Tendenz zu einem erhöhten SMR wurde von der Autorenschaft nicht ausgeschlossen. Die parallele Erfassung von UV-Expositionsdaten wäre für eine Klärung notwendig.
Pukkala et al. (2002) berichten über eine retrospektive Kohortenstudie zur Krebsinzidenz in 10 032 männlichen Piloten aus skandinavischen Ländern (Dänemark, Finnland, Island, Norwegen, Schweden). Ausgewertet wurden Daten der nationalen Krebsregister von 1943 bis 1997. Die kosmische Exposition wurde aus den Flugstunden der Piloten und den Dosisraten, modelliert für typische Flugrouten bestimmter Flugzeugtypen, ermittelt. Mit Ausnahme von Hautkrebs konnte kein erhöhtes Krebsrisiko im Zusammenhang mit einer erhöhten Exposition durch kosmische Strahlung ermittelt werden. Da Piloten der gut situierten Bevölkerung zugeordnet werden, wurden für die Bestimmung des SIR Daten aus der Bevölkerungsgruppe mit einem hohen sozialen Status zugrunde gelegt. Für das MM ergab sich dadurch ein statistisch signifikantes SIR von 2,29 (95 %-CI: 1,73 – 2,98), für das BCC ein SIR von 2,46 (95 %-CI: 1,88 – 3,16) und für sonstigen Hautkrebs ein SIR von 2,08 (95 %-CI: 1,74 – 2,79). Das relative Risiko steigt für alle Hautkrebsentitäten mit der ermittelten kumulativen Dosis an (MM: p-Trend 0,008; BCC: p-Trend 0,09; sonstiger Hautkrebs: p-Trend 0,08). Für das MM sieht die Autorenschaft einen Zusammenhang mit erhöhter UV-Exposition durch Sonnenbaden, der Einfluss durch eine Störung des zirkadianen Rhythmus wird ebenfalls in Erwägung gezogen. Für das BCC und sonstigen Hautkrebs wird dies nicht diskutiert.
Die Studien zeigen zusammengenommen in Bezug auf SMR oder SIR für die meisten einbezogenen Krebsentitäten kein erhöhtes Risiko für Flugpersonal. Die Daten zu Hautkrebs, die hauptsächlich für das MM erhoben wurden, weisen dagegen häufig auf ein, wenn auch nicht immer, signifikant erhöhtes Risiko hin. Um diesen Effekt einzuordnen, muss berücksichtigt werden, dass sowohl epidemiologische Studien (Arnold et al. 2018, Armstrong und Kricker 2001) als auch molekularbiologische Daten (Ramasamy et al. 2017) UV-Strahlung als Hauptrisikofaktor für Hautkrebs identifiziert haben. Ein erhöhtes Hautkrebsrisiko durch eine erhöhte UV-Exposition in der Freizeit und insbesondere in den Pausenzeiten des Flugpersonals in Ländern mit einer hohen UV-Belastung ist deshalb sehr wahrscheinlich. Eine personendosimetrische Erfassung der UV-Exposition des Flugpersonals in der Freizeit würde zu einer weiteren Klärung beitragen.
4.5 Radonexponierte Bevölkerung
In ihrer Studie zur Assoziation von Radon-Exposition mit der Inzidenz von Nicht-Lungenkrebsarten untersuchten Kulich et al. (2011) das Relative Risiko (RR) in einer Fall-Kontrollstudie bei 22 816 Uranbergarbeitern in der Tschechischen Republik, die zwischen 1949 und 1975 beschäftigt waren. Für das MM (n = 23) ergab sich eine nicht-signifikante positive Assoziation mit RR = 2,92 (95 %-CI: 0,91 – 9,42) bei einer Exposition von über 180 Working Level Month (WLM)8 zu einer Exposition unter 3 WLM.
Bräuner et al. (2015) untersuchten in einer prospektiven ökologischen Studie das Auftreten von Hautkrebs durch häusliche Radon-Exposition in Dänemark zwischen 1993 und 1997 an 57 053 Personen. Auf der Grundlage der geocodierten Adressen der Personen wurden ortsabhängige Radon-Aktivitätskonzentrationen errechnet und Inzidenzratenverhältnisse (Inzidenz Rate Ratio IRR) ermittelt. Es ergab sich eine schwach positive statistisch signifikante Assoziation für BCC (n = 3 243) mit IRR = 1,14 pro 100 Bq m-3 (95 %-CI: 1,03 – 1,27) und keine statistisch signifikanten Assoziationen für SCC (n = 317) mit IRR = 0,90 pro 100 Bq m-3 (95 %-CI: 0,70 – 1,37) und für MM (n = 329) mit IRR = 1,08 pro 100 Bq m-3 (95 %-CI: 0,77 – 1,50).
In einer Schweizer Studie zur Hautkrebs-Mortalität durch häusliche Radon-Exposition mit Daten der Schweizer Nationalen Kohorte wurden 5,2 Millionen Erwachsene einbezogen (Vienneau et al. 2017). Ortsabhängige und adressenbezogene Radon-Konzentrationswerte wurden berechnet und insgesamt 2 989 Hautkrebs-Todesfällen zugeordnet. Unter diesen wurde eine positive statistisch signifikante Assoziation für MM (n = 1 900) mit einem adjustierten Hazard Ratio (bezogen auf ein Alter von 60 Jahren) von HR = 1,16 pro 100 Bq m-3 (95 %-CI: 1,04 – 1,29). Als wesentlicher Risikofaktor für MM wurde in der Studie ebenfalls die UV-Exposition erfasst. Die ungenaue Abschätzung sowohl der UV-Exposition als auch der Radon-Exposition und deren Interaktion lassen jedoch unklar, ob das beobachtete erhöhte MM-Mortalitätsrisiko ursächlich auf die langjährige Radonexposition zurückgeht. Darüber hinaus spiegelt das Sterberisiko durch MM das Erkrankungsrisiko für alle Hautkrebsarten nur sehr eingeschränkt wider.
Insgesamt liefert eine der drei Studien zum Hautkrebsrisiko durch Radon schwache Evidenz für eine positive Beziehung zum MM (Vienneau et al. 2017) und eine andere Studie schwache Evidenz für eine Beziehung zu BCC (Bräuner et al. 2015). Insgesamt liefern die Studien zum Hautkrebsrisiko durch Radon jedoch wenig Beleg dafür, dass Radon, insbesondere die Radon-Exposition in Wohnräumen, das Hautkrebsrisiko erhöht, auch wenn eine Erhöhung des Hautkrebsrisikos nicht gänzlich ausgeschlossen werden kann.
Details der relevanten Studien sind in Tabelle A-4.5 dargestellt.
4.6 Zusammenfassung
4.6.1 Basalzellkarzinom
Von den ausgewählten Studien berichten elf Ergebnisse zur Inzidenz des BCC (Tabelle A-5.1). Die Fallzahlen reichen von zwölf bis 3 615. Sechs Studien geben ein ERR bei 100 mGy an, das in fünf Studien statistisch signifikant positiv ist. Die Ergebnisse dieser fünf Studien (Azizova et al. 2021, Sugiyama et al. 2014, Ron et al. 1991, Shore et al. 2002, Schwartz et al. 2009) werden als deutlicher Hinweis auf eine kausale Beziehung interpretiert. In drei dieser fünf Studien lag eine medizinisch therapeutische Exposition mit einer mittleren Dosis im Bereich mehrerer Gy vor (Ron et al. 1991, Shore et al. 2002, Schwartz et al. 2009). Obwohl die mittlere Dosis in den beiden anderen Studien unter Mayak-Beschäftigten (Azizova et al. 2021) und Atombombenüberlebenden (Sugiyama et al. 2014) niedriger war, lassen diese beiden Studien die Frage nach einem Zusammenhang mit Dosen unter 100 mGy offen, denn die mittlere Dosis in der Mayak-Studie (Azizova et al. 2021) betrug etwa 500 mGy und die Analyse der LSS-Daten von Sugiyama et al. (2014) ergab als bestes Modell einen Schwellenwert bei 630 mGy und darunter keine Evidenz einer Assoziation. In zwei Studien mit Radonexposition (Bräuner et al. 2015) oder deutlich niedrigerer Dosis durch kosmische Strahlung (Gudmundsdottir et al. 2017) zeigten sich ebenfalls Hinweise auf eine Dosis-Wirkungs-Beziehung, während es bei vier Studien (Pukkala et al. 2002, Lee et al. 2015, Landthaler et al. 1995, Pukkala et al. 2012) keinen Hinweis auf eine Dosis-Wirkungs-Beziehung gab. Zu bemerken ist, dass von den beiden einzigen Studien, deren Ergebnisse für den Effekt der UV-Strahlung korrigiert sind, eine einen Hinweis auf eine Kausalbeziehung gibt (Bräuner et al. 2015) und die andere nicht (Lee et al. 2015). Diese beiden Studien sind gleichzeitig mit jeweils über 3 000 Fällen die bei Weitem größten Studien zu dieser Entität.
Zusammenfassend ergibt sich starke epidemiologische Evidenz für einen Kausalzusammenhang zwischen Strahlung und BCC aufgrund einer größeren Zahl von Studien mit signifikanter Dosis-Wirkungs-Beziehung, ausreichenden Fallzahlen und detaillierter Expositionscharakterisierung. Unklarheiten bestehen jedoch bezüglich der Assoziation im Dosisbereich unter 100 mGy sowie bezüglich des Confoundings durch UV-Strahlung.
4.6.2 Plattenepithelkarzinom
Von den fünf ausgewählten Studien mit Ergebnissen zum SCC zeigt keine einen Hinweis auf eine Dosis-Wirkungs-Beziehung (Tabelle A-5.2). Die größte Studie mit 317 Fällen (Bräuner et al. 2015) findet einen nicht-signifikanten negativen Trend nach Radonexposition. Nur diese Studie adjustiert für UV-Strahlung.
Zusammenfassend geben die betrachteten Studien keine epidemiologische Evidenz, die eine kausale Beziehung zwischen Strahlung und Plattenepithelkarzinom nahelegt.
4.6.3 Malignes Melanom
Insgesamt berichteten 21 Studien Ergebnisse zu einer möglichen Dosis-Wirkungs-Beziehung zwischen ionisierender Strahlung und MM (Tabelle A-5.3). Davon betrachteten 15 Studien die Inzidenz (14) oder Prävalenz (1) und sechs Studien die Mortalität. Die Anzahl der Fälle bewegte sich zwischen sieben und 1 900. Bei 16 Studien (Freedman et al. 2003, Langner et al. 2004, Dreger et al. 2020, Austin et al. 1997, Samson et al. 2011, Bräuner et al. 2015, Moore et al. 1997, Sugiyama et al. 2014, Pinkerton et al. 2018, Azizova et al. 2018, Haddy et al. 2012, Cardis et al. 2007, Sont et al. 2001, Muirhead et al. 2009, Metz-Flamant et al. 2013, Pukkala et al. 2012) wurde keine Evidenz für einen Zusammenhang gefunden. In diesen Studien war die Exposition beruflich. Die durchschnittlichen Dosiswerte lagen dabei überwiegend unter 100 mSv mit Ausnahme einer Studie nach therapeutischer Exposition mit lokalen Dosen > 15 Gy (Guerin et al. 2003). Bei vier Studien (Vienneau et al. 2017, Guerin et al. 2003, Kulich et al. 2011, Gudmundsdottir et al. 2017) zeigte sich eine Andeutung einer positiven Assoziation (zwei davon nach Radonexposition) und bei einer Studie ein starker Hinweis auf eine mögliche Dosis-Wirkungs-Beziehung (Pukkala et al. 2002). Diese Studie unter Flugzeugpiloten mit 56 inzidenten Fällen beobachtete einen positiven signifikanten Trend (p = 0,007) der relativen Risiken über Dosiskategorien. Die Ergebnisse waren allerdings nur für Alter und Kalenderzeit adjustiert. Confounding durch UV-Strahlung kann nicht ausgeschlossen werden.
Zusammenfassend zeigen die zahlreichen und teilweise großen Studien zum MM ganz überwiegend keinerlei Evidenz für eine Dosis-Wirkungs-Beziehung. Der Einfluss von Confounding durch UV-Strahlung ist unklar. Allerdings wird es als sehr unwahrscheinlich angesehen, dass die negativen Ergebnisse im Fall einer Kausalbeziehung auf Confounding zurückgehen. Deshalb wird die vorhandene Datenlage als Evidenz gegen eine Kausalbeziehung interpretiert.
4.6.4 Kombinationen von Hautkrebstypen und andere Subtypen
Die Ergebnisse für nicht-melanozytären Hautkrebs zeigten eine signifikante Dosis-Wirkungs-Beziehung in zwei der vier Studien zu diesem kombinierten Endpunkt (Tabelle A-5.4), nämlich der Mayak-Studie von Azizova et al. (2018) mit 294 inzidenten Fällen und der NRRW-Studie von Muirhead et al. (2009) mit 261 Fällen. Dabei war die mittlere Dosis unter den Mayak-Beschäftigten um einen Faktor 20 größer als unter NRRW-Arbeitern. Die mit 838 Fällen größte Studie von Vienneau et al. (2017) nach Radonexposition, die als einzige in dieser Gruppe für UV-Strahlung adjustierte, zeigte keine Assoziation mit NMSC.
Eine einzelne Studie fand einen deutlichen Zusammenhang zwischen Strahlenexposition durch Radiotherapie und Sarkomen von Bindegewebe, Brust und Haut (116 inzidente Fälle) (Tabelle A-5.6).
5 Ermittlung des Detriments für Hautkrebs
5.1 Abschätzung des Nominellen Risikokoeffizienten
Der hauptsächliche Eingangsparameter für die Bestimmung des Detriments ist der Nominelle Risikokoeffizient nach ICRP-Publikation 103 (2007). Dabei handelt es sich um das über alle Geschlechter, alle Alters- und alle Bevölkerungsgruppen gemittelte zusätzliche absolute Lebenszeit-Inzidenzrisiko pro Dosis, gegebenenfalls unter Anwendung eines DDREF. In dieser ICRP-Publikation wird für Hautkrebs ein Nomineller Risikokoeffizient von 1 000 (104 Sv)-1 angegeben.
Die folgenden quantitativen Abschätzungen stützen sich vor allem auf die neuesten Auswertungen der LLS-Kohorte zu Hautkrebs (Sugiyama et al. 2014). Wie auch aus den anderen älteren und neueren Studien hervorgeht, gibt es für MM und SCC keine Evidenz für eine kausale Assoziation mit ionisierender Strahlung. Risikokoeffizienten für Hautkrebs beziehen sich also nahezu ausschließlich, zumindest aber hauptsächlich auf BCC: Ausgangspunkt für Risikoschätzungen sind in der Regel entweder Angaben zum zusätzlichen relativen Risiko (ERR) oder zum zusätzlichen absoluten Risiko (EAR). Beide Größen sind über die Inzidenz-Hintergrundraten, in diesem Fall für BCC, miteinander verknüpft. Liegen für die Bevölkerungsgruppe, an der die Untersuchungen durchgeführt wurden, solche Hintergrundraten vor, so können die beiden Risikogrößen ERR und EAR leicht und eindeutig ineinander umgerechnet werden. Wird hingegen eine der Größen auf eine andere Bevölkerungsgruppe übertragen und dann eine Umrechnung durchgeführt, so wirken sich etwaige Unterschiede in den Hintergrundraten auf die Umrechnung aus (siehe unten).
Eine Risikoabschätzung auf der Grundlage der LSS-Daten ergibt folgendes Bild: In Preston et al. (2007) wird für BCC ein ERR/Dosis von 0,57 Sv-1 für ein lineares Modell und 0,48 Sv-1 für ein nicht-lineares Modell (für < 1 Sv) angegeben9. In Sugiyama et al. (2014) wird beim Vergleich der verschiedenen Anpassungsmodelle als Anpassungsgüte das AIC-Kriterium (Akaike information criterion) herangezogen, aus dem eine Rangfolge der Anpassungsgüte hervorgeht. Wird aus Sugiyama et al. (2014) das LNT-Modell (AIC = 1 089,6) zugrunde gelegt, so folgt daraus eine konservative Schätzung für ERR/Dosis von 1,3 Sv-1. Ein linear-quadratisches Modell (AIC = 1 088,8) liefert für den linearen Term 0,4 Sv-1. Unter Berücksichtigung von Effektmodifikation zeigt das LSS-Modell mit der besten Anpassung (lineares Modell mit Schwelle, AIC = 1 084,3) keine Dosis-Wirkungs-Abhängigkeit im Bereich kleiner und mittlerer Dosen bis zum Schwellenwert von 0,63 Sv, das heißt, es gilt ERR = 0 und EAR = 0 für D < 0,63 Sv. Für eine realistische Abschätzung zum Risikokoeffizienten kann je nach den zugrunde liegenden Annahmen ein Wertebereich von etwa 0,4 Sv-1 bis 1 Sv-1 abgeleitet werden.
Das LNT-Modell, angewendet auf das EAR pro Dosis und pro Zeit, führt zu einem Wert von 0,059 (104 PY Sv)-1 für die japanische Bevölkerung, auf die sich die Untersuchungen beziehen (Sugiyama et al. 2014, vergleiche Abschnitt 4.1). Mit einer angenommenen mittleren Lebenserwartung von 80 Jahren ergibt sich hieraus ein Risikokoeffizient von etwa 5 (104 Sv)-1.
Zieht man als Grundlage für eine Risikoschätzung das Modell mit der besten Anpassung heran, so ergibt sich ebenso wie für MM und SCC auch für BCC keine Erhöhung des Risikos unterhalb einer Dosisschwelle von 0,63 Gy. Das bedeutet, dass unter dieser Annahme in einem für den Strahlenschutz relevanten Dosisbereich Hautkrebs generell nicht als strahleninduzierbar einzuschätzen wäre.
5.2 Dosis- und Dosisleistungseffektivitätsfaktor (DDREF)
Fast alle Studien, die eine Aussage über den (qualitativen) Verlauf der Dosis-Wirkungs-Beziehung für BCC erlauben, zeigen deutliche Hinweise auf eine vom reinen LNT-Verlauf abweichende Form. Dies zeigt sich in Abhängigkeiten, die eine Schwellendosis nahelegen, einen quadratischen Term beinhalten oder eine andere aufwärts gekrümmte Form aufweisen. Das bedeutet, dass Schätzungen, die auf einer linearen Extrapolation von hohen Dosen in den Bereich kleiner Dosen beruhen, zu einer Überschätzung des Risikos führen. Darüber hinaus führen Nicht-Linearitäten auch zu einer Abhängigkeit des Risikos von der Dosisleistung. Um diesem Umstand Rechnung zu tragen, hat die ICRP einen Dosis- und Dosisleistungseffektivitätsfaktor (DDREF) eingeführt, der in ICRP-Publikation 103 (ICRP 2007) für fast alle Organe beziehungsweise Gewebe gleich 2 gesetzt wurde. Zu diesem Vorgehen hat die SSK ausführlich Stellung genommen (SSK 2014).
Der nicht-lineare Dosis-Wirkungs-Zusammenhang für BCC ist ausgeprägter als für viele andere Krebsarten (vergleiche Abbildung 2). Daher erscheint die Anwendung eines DDREF für diesen Fall besonders gerechtfertigt. Vor dem Hintergrund, dass das LSS-Modell mit der besten Anpassung einen Dosisschwellenwert von 0,63 Sv aufweist, das Risiko unterhalb dieser Dosis also gleich null ist, sind lineare Modelle auch bei Verwendung eines DDREF noch sehr konservativ. Dies würde selbst dann noch zutreffen, wenn der DDREF erheblich größer als 2 wäre.
Bei Anwendung eines DDREF = 2 ergeben sich für das ERR/Dosis Werte im Bereich von 0,2 Sv-1 bis 0,5 Sv-1. Für das EAR/Dosis ergibt sich ein Wert im Bereich von etwa 2,5 (104 Sv)-1 für die japanische Bevölkerung. Dieser Wert ist um einen Faktor 400 kleiner als der Nominelle Risikokoeffizient in ICRP-Publikation 103.
5.3 Übertragung auf andere Bevölkerungsgruppen
Wie in Kapitel 2 dargestellt, wendet die ICRP in Publikation 103 (ICRP 2007) zur Übertragung der japanischen Daten auf eine Weltbevölkerung für fast alle Organe beziehungsweise Gewebe ein „Mischmodell“ mit einem Anteil von 50 % ERR und 50 % EAR an. Für Hautkrebs dagegen wird ausschließlich das ERR auf andere Bevölkerungsgruppen übertragen (100 % ERR zu 0 % EAR). In Japan gibt es nur eine sehr kleine Hintergrund-Inzidenzrate für BCC (und auch für die anderen Hautkrebsarten), während die Inzidenzraten insbesondere in Europa und den USA außerordentlich hoch sind, sogar die höchsten aller Krebsarten überhaupt. Das führt dazu, dass sich die Nominellen Risikokoeffizienten je nach Wahl des Übertragungsmodells sehr stark unterscheiden.
Für eine Übertragung auf andere Bevölkerungsgruppen ist die Kenntnis der für diese Gruppen gültigen Inzidenz-Hintergrundraten für BCC notwendig. Die Hintergrundraten für die nicht-melanozytären Hautkrebsarten, also auch für BCC, sind häufig nur schwer zu bestimmen, da viele internationale Krebsregister aufgrund der schwierigen Registrierungsbedingungen (Mehrfachdiagnosen, unsichere Zuordnung usw.) keine nicht-melanozytären Hautkrebsarten registrieren. Beispielsweise weisen die SEER-Tables des US Dept. Health and Human Services (z. B. NIH NCI 2021) für BCC und SCC keine Inzidenzraten aus (im Gegensatz zu Mortalitätsdaten). Für Deutschland kann mit Daten des Krebsregisters Schleswig-Holstein die Anzahl der Hautkrebs-Neuerkrankungen hochgerechnet werden. Für BCC erhält man auf dieser Grundlage eine Schätzung von etwa 160 000 Neuerkrankungen für 2020 (Katalinic 2022). Mit einer Lebenserwartung von 80 Jahren und einer Gesamtbevölkerungszahl von 80 Millionen ergibt das eine Lebenszeit-Erkrankungswahrscheinlichkeit von etwa 0,15. Dies kann als Hintergrundrisiko für BCC in Deutschland angenommen werden.
Multipliziert man auf der Grundlage eines 100 %-ERR-Übertragungsmodells das ermittelte Inzidenz-Hintergrundrisiko von 0,15 mit dem ERR/Dosis (einschließlich DDREF = 2) von 0,2 Sv-1 bis 0,5 Sv-1 ergibt dies ein EAR/Dosis und damit einen Risikokoeffizienten von 0,03 Sv-1 bis 0,08 Sv-1. Damit liegt der in ICRP-Publikation 103 angegebene Wert von 0,1 Sv-1 für Hautkrebs etwas oberhalb des für Deutschland aufgrund dieser Abschätzung ermittelten Bereichs für BCC.
Würde auf der anderen Seite ein 100 %-EAR-Modell zur Übertragung auf die Weltbevölkerung Anwendung finden, würde der Risikokoeffizient für Hautkrebs mit einem Wert von 0,00025 Sv-1 vernachlässigbar klein sein und Hautkrebs könnte für stochastische Wirkungen im Strahlenschutz völlig unberücksichtigt bleiben.
Ein von der ICRP für die anderen Krebsarten herangezogenes Mischmodell (50 % ERR zu 50 % EAR) würde bei Anwendung auch für Hautkrebs für Deutschland zu einem Risikokoeffizienten im Bereich von 0,015 Sv-1 bis 0,04 Sv-1 führen, etwa dreifach geringer als der Wert aus ICRP-Publikation 103.
5.4 Strahlungsunabhängige Parameter
Das ICRP-Detriment-Konzept dient dem Zweck, einen quantitativen Vergleich des stochastischen Strahlenschadens für die verschiedenen Organe zu ermöglichen. Dazu werden die organspezifischen Nominellen Risikokoeffizienten mit einer Funktion gewichtet, die die Schadenshöhe beziehungsweise den Schweregrad einer Erkrankung ausdrücken soll. In diese Funktion gehen eine Vielzahl von Variablen ein, die nicht von Strahlungsparametern abhängen, sondern von Merkmalen der Erkrankung selbst. Dazu zählen die Letalität der Erkrankung (Letalitätsfaktor k), die dadurch verursachte Einschränkung der Lebensqualität q, der minimale Verlust an Lebensqualität qmin sowie der Verlust an Lebenserwartung L.
Die Modellierung der Schadenshöhe d(k) mithilfe dieser strahlungsunabhängigen Parameter geschieht nach ICRP-Publikation 103 (ICRP 2007) durch folgenden Zusammenhang:
| d(k) = [(1 – qmin) ⋅ (2k – k2) + qmin] ⋅ L | (1) |
Das Detriment (Einheit: Sv-1) wird schließlich für jede Krebsart einzeln durch die Multiplikation des zugeordneten Nominellen Risikokoeffizienten (Einheit: Sv-1) mit der entsprechenden Schadenshöhe d (einheitenlos) für diese Krebsart ermittelt. Nähere Einzelheiten zu diesem Verfahren finden sich in SSK (2018) oder in Breckow (2020).
Letalitätsfaktor
Hautkrebs weist nach ICRP-Publikation 103 mit 0,1 Sv-1 zwar einen außerordentlich großen Nominellen Risikokoeffizienten auf (größer als für alle anderen Krebsarten zusammen), zeichnet sich auf der anderen Seite jedoch durch eine sehr kleine Letalität aus. Der Letalitätsfaktor k geht als wichtigste Größe in die Berechnung des Detriments ein. Für Hautkrebs wird in dieser Publikation ein Wert von 0,002 angegeben. Allerdings werden kaum Angaben über die Datenquellen beziehungsweise zum Verfahren zur Ermittlung des Letalitätsfaktors gemacht.
Breckow et al. (2018) untersuchen den zeitlichen Verlauf der strahlenunabhängigen Parameter nach Gl. (1) für alle Krebsarten in den USA und in Deutschland im Zeitraum von 1980 bis 2012. Für Hautkrebs im Jahr 2012 wird beispielsweise für die USA ein Letalitätsfaktor von k = 0,0023 angegeben, was annähernd dem Wert aus ICRP-Publikation 103 entspricht. Für Deutschland im Jahr 2012 wird in dem der Arbeit von Breckow et al. (2018) zugrunde liegenden Bericht (Emami und Breckow 2016) ein Wert von k = 0,03 und eine Schadenshöhe von d = 0,05 genannt, was etwa um einen Faktor 10 höher liegt als der ICRP-Wert.
Minimale Einschränkung der Lebensqualität
Mit dem Parameter für die „minimale Einschränkung der Lebensqualität“ qmin in der Beziehung Gl. (1) soll zum Ausdruck gebracht werden, dass auch für eine gänzlich nicht-tödlich verlaufende Krebserkrankung (k = 0) die Lebensqualität auf einen Anteil qmin (≠ 0) herabgesetzt sein kann.
Dem Hautkrebs wird in ICRP-Publikation 103 durch Zuordnung der minimalen Einschränkung der Lebensqualität qmin = 0 im Detriment nur eine sehr schwache Einschränkung der Lebensqualität beigemessen (gemäß Gl. (1) ist für qmin = 0 und k ≠ 0 die Schadenshöhe d(k) klein, aber nicht null). Hautkrebs ist das einzige Gewebe mit qmin = 0. Für die Wahl dieses Werts finden sich in dieser Publikation kaum Begründungen. Es kann jedoch davon ausgegangen werden, dass dem die Einschätzung zugrunde liegt, dass mit der guten und wenig belastenden Behandelbarkeit kaum Einschränkungen der Lebensqualität verbunden sind. Genau genommen bedeutet qmin = 0 jedoch, dass bei einer Letalität, die gegen null geht, überhaupt keine Einschränkung der Lebensqualität unterstellt wird.
Die Wahl des Werts für qmin wirkt sich bei niedriger Letalität stark auf die Schadenshöhe d und damit auch auf das zu ermittelnde Detriment aus. Für eine Krebsart mit sehr geringer Sterblichkeit k, so wie es für Hautkrebs gilt, würde die Annahme qmin = 0 bedeuten, dass auch die Schadenshöhe und damit auch das Detriment gegen null geht. Würde auf der anderen Seite qmin = 0,1 wie für fast alle anderen Krebsarten (Ausnahme Schilddrüsenkrebs) auch für Hautkrebs gelten, so würde mit den übrigen Werten aus ICRP-Publikation 103 Hautkrebs nach Lungenkrebs zur zweitwichtigsten strahleninduzierbaren einzelnen Krebsart werden.
Relativer Verlust an Lebenserwartung
Der relative Verlust an Lebenserwartung L ist der absolute Verlust an Lebenserwartung bei Erkrankung an einer Krebsart bezogen auf den über alle Krebsarten gemittelten Wert, also dem mittleren Verlust an Lebenserwartung durch die Gesamtheit aller Krebsarten. Dieser Faktor wirkt sich im Vergleich zur Letalität k und zur minimalen Einschränkung der Lebensqualität qmin nur in geringem Maße auf die Berechnung des Detriments aus. Für die vorliegende Stellungnahme ist dieser Faktor daher nur von untergeordneter Bedeutung und wird nicht weiter diskutiert.
Fazit
Im gegenwärtigen System der organspezifischen Detriment-Werte nach ICRP-Publikation 103 (ICRP 2007) ergibt sich aufgrund der sehr geringen Letalität von BCC trotz des sehr großen Nominellen Risikokoeffizienten von 0,1 Sv-1 ein nur sehr kleines Detriment von 4 · 10-4 Sv-1, was schließlich zu einem nur geringen Beitrag der Haut von 0,7 % zum Gesamtdetriment und dem kleinen Gewebe-Wichtungsfaktor für die Haut führt. Auf der Grundlage eines LNT-Anpassungsmodells sowie unter Anwendung eines DDREF = 2, eines 100 %-ERR-Übertragungsmodells und unter Beibehaltung aller strahlungsunabhängigen Parameter würde sich auch im Lichte der nach ICRP-Publikation 103 erschienenen Literatur nichts Wesentliches ändern. Diese Aussage trifft auch für den Fall zu, wenn auch für Hautkrebs wie für alle anderen Krebsarten ein Mischmodell 50 % ERR zu 50 % EAR zur Anwendung käme.
Unter folgenden Annahmen ergeben sich jedoch aufgrund der neueren Literatur erhebliche Änderungen mit teilweise weit reichenden Konsequenzen:
- –
-
Eine Änderung der minimalen Einschränkung der Lebensqualität von qmin = 0 auf qmin = 0,1 bei Beibehaltung aller anderen Parameter bedeutet ein 25-fach erhöhtes Detriment. Damit wäre Hautkrebs die nach Lungenkrebs wichtigste einzelne strahleninduzierbare Krebsart.
- –
-
Die Anwendung eines Dosisschwellenmodells, das die beste Anpassung an die LSS-Daten liefert, führt hingegen dazu, dass die Haut gänzlich aus der Liste der Organe, für die Gewebe-Wichtungsfaktoren angegeben werden, entfallen könnte. Dies könnte weitreichende Konsequenzen für das Detriment-Modell insgesamt haben (vergleiche Kapitel 6).
6 Stellungnahmen
Im Zeitraum von 1990 bis 2021 sind insgesamt 106 Publikationen erschienen, die die Einschlusskriterien als Grundlage für die weitere Betrachtung erfüllten (vergleiche Nummer 3). Von diesen wurden 28 Arbeiten als relevant und ausreichend belastbar für Aussagen in dieser Stellungnahme betrachtet. Gemessen an dem Zeitraum von über 30 Jahren ist dies eine erstaunlich geringe Anzahl von Arbeiten, auf die man Aussagen zum strahleninduzierbaren Hautkrebs stützen kann. In Bezug auf die verschiedenen Hautkrebsarten lässt sich diesen Arbeiten qualitativ Folgendes entnehmen:
Stellungnahme 1:
Es zeigt sich keine wissenschaftlich belastbare Evidenz, dass das MM oder das SCC durch ionisierende Strahlung verursacht wird. Die einzige Hautkrebsart mit Evidenz für eine Kausalbeziehung ist das BCC. Allerdings bezieht sich diese Evidenz im Wesentlichen auf Expositionen oberhalb von etwa 0,5 Gy. Dies deckt sich mit den auch bisher angenommenen Erkenntnissen. Wenn also von strahleninduzierbarem „Hautkrebs“ gesprochen wird, beziehen sich diesbezügliche Aussagen ausschließlich auf das BCC.
Quantitative Aussagen zu Dosis-Wirkungs-Zusammenhängen, das heißt also Angaben zum Risikokoeffizienten, lassen sich hauptsächlich den Publikationen zu Auswertungen an den Atombombenüberlebenden von Hiroshima und Nagasaki, dem LSS-Kollektiv, entnehmen. Auswertungen aus medizinischer Exposition und der Exposition des Flugpersonals liefern hingegen nur wenige quantitative Aussagen. Die Studien zu Hautkrebs und Radon zeigen keine Evidenz, dass eine Radon-Exposition das Hautkrebsrisiko erhöht. Über die Kombinationswirkung von ionisierender Strahlung und UV-Strahlung (dem Hauptrisikofaktor für die Induktion von Hautkrebs) lassen sich anhand der vorliegenden Studien keine Aussagen machen. Da diese Kombination jedoch der realen Strahlenexposition der Bevölkerung entspricht, sind sowohl epidemiologische Studien als auch strahlenbiologische Untersuchungen notwendig.
Stellungnahme 2:
Im Gegensatz zu den meisten anderen Krebsarten beziehungsweise Organen stützt die ICRP in Publikation 103 (ICRP 2007) ihre Aussagen zu strahleninduzierbarem Hautkrebs nicht auf Auswertungen der LSS, sondern zieht dafür Studien aus den frühen 90er Jahren an medizinisch exponierten Gruppen heran. Auf der Grundlage zwischenzeitlich erschienener Arbeiten lassen sich nunmehr auch zu Hautkrebs quantitative Aussagen zu Dosis-Wirkungs-Beziehungen sowie zu Risikokoeffizienten aus den LSS-Auswertungen treffen. Die wichtigste einschlägige LSS-Arbeit ist die Auswertung von Sugiyama et al. (2014) für den Beobachtungszeitraum von 1958 bis 1996.
Für BCC werden in Sugiyama et al. (2014) verschiedene Modelle zur Anpassung einer Dosis-Wirkungs-Beziehung geprüft (vergleiche Abbildung 2). Untersuchte Modelle sind Spline-Funktionen mit Knoten von 0,5 Gy bis 5 Gy in Schritten von jeweils 0,01 Gy, ein lineares Modell mit Schwellendosis, ein lineares Modell ohne Schwellendosis (LNT) sowie ein linear-quadratisches Modell. Aber auch andere Modelle, darunter ein rein quadratisches Dosis-Wirkungs-Modell, werden untersucht. Insgesamt ist jedoch unter allen Modellen das lineare Schwellenmodell (Dosisschwelle: 0,63 Gy, Steigung ERR/Dosis = 2 Gy-1) am besten geeignet, um die Dosis-Wirkungs-Beziehung für BCC anzupassen. Die Schwellendosis liegt mit 0,63 Gy in einem Dosisbereich oberhalb der meisten im praktischen Strahlenschutz auftretenden Expositionen. Ein reines LNT-Modell, allerdings mit schlechterer Anpassung, liefert eine sehr konservative Abschätzung mit einem Wert für ERR/Dosis von 1,3 Gy-1. Die Anwendung eines Dosis- und Dosisleistungseffektivitätsfaktors (DDREF) von 2, wie ihn die ICRP in Publikation 103 auch für die anderen Krebsarten zur Anwendung bringt, würde zu einem ERR pro Dosis von 0,65 Gy-1 führen. Der lineare Anteil einer linear-quadratischen Anpassung liefert mit 0,4 Gy-1 einen ähnlichen Wert.
Stellungnahme 3:
Die Wahl des Anpassungsmodells zur Beschreibung des Dosis-Wirkungs-Zusammenhangs ist von entscheidender Bedeutung. Wird das lineare Modell mit Schwellendosis, das die beste Anpassung liefert, zugrunde gelegt, so spielt das BCC in Dosisbereichen, die für den Strahlenschutz relevant sind, keine Rolle. Wird hingegen das LNT-Modell wie für die meisten anderen Krebsarten beziehungsweise Organe auch für BCC herangezogen, so ergibt sich ein deutlicher Risikobeitrag auch für BCC.
Aufgrund der großen Unterschiede zwischen den Hintergrundraten für BCC in verschiedenen Bevölkerungsgruppen, insbesondere zwischen europäischer und asiatischer Bevölkerung, wirkt sich die Anwendung bestimmter Modelle zur Übertragbarkeit der Ergebnisse aus den japanischen Daten auf andere Bezugsbevölkerungen außerordentlich stark aus. Von ähnlich großem Einfluss ist die Wahl der Parameter, die in die Ermittlung des Detriments eingehen. In ICRP-Publikation 103 weichen sowohl die Wahl des Übertragungsmodells als auch die Detriment-Parameter erheblich von denen für die anderen Krebsarten beziehungsweise Organe ab. In dieser Hinsicht bilden sie eine spezifische Ausnahme im Vergleich zu allen anderen Krebsarten.
| Dosis-Wirkungs-Modell | ERR/EAR-Mischmodell | RI / (10 000 ⋅ Sv)-1 | D / (10 000 ⋅ Sv)-1 |
|---|---|---|---|
| LNT ERR/D = 0,2/Sv … 0,5/Sv |
0:100 | 2,5 | 0,01 |
| 50:50 wie alle anderen Krebsarten |
150 … 400 | 0,6 … 1,6 | |
| 100:0 | 300 … 800 | 1,2 … 3,2 | |
| Linear mit Schwellendosis bei 0,63 Gy beste Anpassung | Jedes beliebige Verhältnis |
0 | 0 |
| Zum Vergleich: | |||
| ICRP-Publikation 103 | 100:0 | 1 000 | 4 |
Tabelle 1: Inzidenz-Risikokoeffizienten RI und Detriment D für Hautkrebs auf der Basis von LSS (Sugiyama et al. 2014) unter Verwendung eines DDREF = 2 sowie des Letalitätsfaktors k = 0,002 und qmin = 0 aus (ICRP 2007, Tab. A.4.1)
In Tabelle 1 sind für die verschiedenen Modelle und Parameterkonstellationen die resultierenden Detriment-Werte zusammengefasst. Würde beispielsweise ein LNT-Modell mit DDREF = 2, kombiniert mit einem 100:0-Mischmodell sowie einem qmin = 0 wie für Hautkrebs in ICRP-Publikation 103, zur Anwendung kommen, so würde ein nur geringfügig reduziertes Detriment gegenüber ICRP-Publikation 103 resultieren (Tabelle 1). In einem 50:50-Mischmodell würde das Detriment um mehr als einen Faktor 2 herabgesetzt, während ein 0:100-Mischmodell sogar eine Reduktion um das 400-Fache bedeuten würde. Würde das gleiche LNT-Modell mit DDREF = 2, allerdings in Kombination mit einem qmin = 0,1, so wie für alle anderen Krebsarten beziehungsweise Organe, zur Anwendung kommen, würde sich ein mehr als zehnfach höheres Detriment ergeben (Tabelle A-6.1). In noch anderer Kombination könnte für BCC ein Detriment resultieren, das nach Lungenkrebs das zweitgrößte im Vergleich zu allen anderen Krebsarten beziehungsweise Organen wäre.
Auf der anderen Seite würde im Fall der Anwendung des LSS-Dosis-Wirkungs-Modells mit der besten Anpassung (lineares Schwellenmodell) BCC vernachlässigbar klein sein. In diesem Fall würde „Hautkrebs“ insgesamt im für den Strahlenschutz relevanten Dosisbereich nicht mehr als durch ionisierende Strahlung induzierbar gelten können.
Stellungnahme 4:
Je nach Wahl der Kombination aus Dosis-Wirkungs-Modell, Übertragungsmodell und Detriment-Parameter ergibt sich ein außerordentlich breites Spektrum möglicher Detriment-Werte (ICRP 2022) und damit auch der Gewebe-Wichtungsfaktoren. Der Bereich spannt sich auf zwischen der Einschätzung, dass Hautkrebs im für den Strahlenschutz relevanten Dosisbereich keinerlei Beitrag zum Strahlenrisiko liefert, und der, dass Hautkrebs nach Lungenkrebs den zweitgrößten Beitrag zum Gesamt-Detriment liefert. Damit verbunden wären Gewebe-Wichtungsfaktoren zwischen wT = 0 (gleichbedeutend mit der Herausnahme der Haut aus der Liste der Gewebe-Wichtungsfaktoren) und wT = 0,12 (Gruppe der größten Gewebe-Wichtungsfaktoren). Dadurch wäre nicht nur der Gewebe-Wichtungsfaktor für Haut, sondern auch alle anderen Gewebe-Wichtungsfaktoren betroffen.
Die vorliegende Literatur zum strahleninduzierten Hautkrebs gibt nur wenig Anhaltspunkte dafür, welches Dosis-Wirkungs-Modell, welches Übertragungsmodell und welche Detriment-Parameter zu präferieren sind. Die Wahl des Dosis-Wirkungs-Modells, das nach Sugiyama et al. (2014) die beste Anpassung liefert, würde wie oben erläutert zu der sehr weitreichenden Aussage führen, dass Hautkrebs überhaupt nicht als strahleninduzierbar gilt. Die vorliegende Literatur kann allerdings für eine solch weitreichende Aussage nur unzureichend belastbare Evidenz liefern. In noch stärkerem Ausmaß trifft dies auf die Wahl des Übertragungsmodells und der Detriment-Parameter zu. Für diese liefert die Literatur kaum Anhaltspunkte, so dass die Argumentation für oder gegen bestimmte Modelle oder Parameter sich aus anderen Quellen speisen muss, beispielsweise aus Plausibilitätsannahmen zu additiven oder multiplikativen Risikomodellen, aus Überlegungen zur Quantifizierung von Einschränkung der Lebensqualität oder aus grundsätzlichen Überlegungen zur Konzeption des Strahlenschutzes.
Stellungnahme 5:
Auf der Basis der vorliegenden Literatur zu strahleninduziertem BCC kann vor allem im Dosisbereich unterhalb von 0,5 Gy keine ausreichend belastbare Entscheidung für ein bestimmtes Dosis-Wirkungs-Modell getroffen werden. Die Wahl eines bestimmten Übertragungsmodells und anderer Detriment-Parameter, wie insbesondere die minimale Lebensqualität qmin, muss auf noch anderer Grundlage geschehen. Es muss einer international geführten Diskussion überlassen bleiben, wie mit der ungeklärten Situation zur Einschätzung des Beitrags des Hautkrebsrisikos zum gesamten stochastischen Risiko umgegangen werden soll.
7 Abkürzungsverzeichnis
| BCC | Basal Cell Carcinoma |
| CI | Confidence Interval |
| DDREF | Dose and dose rate effectiveness factor |
| EAR | Excess Absolute Risk |
| ERR | Excess Relative Risk |
| EPCARD | European Program Package for the Calculation of Aviation Route Dose |
| SED | Standard-Erythemdosis |
| HCT | Hematopoietic Stem Cell Transplantation |
| HR | Hazard Ratio |
| ICD | International Statistical Classification of Diseases and Related Health Problems |
| IRR | Inzidenz Rate Ratio |
| LNT | Linear-no-threshold |
| LSS | Life Span Study |
| MM | Malignant melanoma |
| NIC | Not in city – Kohortengruppe der LSS |
| NMSC | Non-melanoma skin cancer |
| OR | Odds Ratio |
| PY | Person Years |
| RR | Relative Risk |
| SMR | Standardized Mortality Ratio |
| SEER | Surveillance, Epidemiology and End Results Program of the National Cancer Institute (NCI) |
| SIR | Standardized Incidence Ratio |
| SCC | Squamous Cell Carcinoma |
| TBI | Total Body Irradiation |
8 Glossar
| Äquivalentdosis | Die ICRP und die ICRU haben für Strahlenschutzzwecke Wichtungsfaktoren festgesetzt, welche es erlauben, die unterschiedliche biologische Wirksamkeit verschiedener Strahlungsarten und -energien und die unterschiedliche Strahlenempfindlichkeit der verschiedenen Körperorgane und -gewebe in der Dosisangabe zu berücksichtigen. Dementsprechend hat der im Strahlenschutz verwendete Dosisbegriff „Äquivalentdosis“ die allgemeine Bedeutung eines Produkts aus einer Energiedosis und dem von der ICRP beziehungsweise der ICRU definierten Strahlungs-Wichtungsfaktor beziehungsweise Funktion des Qualitätsfaktors. Von dem Begriff „Äquivalentdosis“ wird sowohl bei den von der ICRP definierten, auf den Körper bezogenen Dosisgrößen mit dem Strahlungs-Wichtungsfaktor als auch bei den von der ICRU definierten Messgrößen der Orts- und Personendosimetrie mit dem Qualitätsfaktor Gebrauch gemacht. Die Einheit der Äquivalentdosis ist wie die der Energiedosis J kg-1. Um deutlich zu machen, dass es sich um eine gewichtete Dosisgröße handelt, wird wie bei der effektiven Dosis anstelle von Gray (Gy) die Einheit Sievert (Einheitenzeichen Sv) verwendet. |
| Beruflich strahlenexponierte Person/Beschäftigte | Beruflich exponierte Person ist eine Person, die eine berufliche Exposition aus Tätigkeiten erhalten kann, die |
Berufliche Expositionen aus Notfallexpositionssituationen werden dabei nicht berücksichtigt. Eine Person, die eine berufliche Exposition ausschließlich in einer Notfallexpositionssituation oder einer anderen Gefahrenlage erhält, ist keine beruflich exponierte Person. Definition aus StrlSchG 2017 § 5 Absatz 7 (Gesetz zum Schutz vor der schädlichen Wirkung ionisierender Strahlung (Strahlenschutzgesetz – StrlSchG) vom 27. Juni 2017 (BGBl. I S. 1966), das zuletzt durch Artikel 11 des Gesetzes vom 12. Dezember 2019 (BGBl. I S. 2510) geändert worden ist). |
|
| Dosis- und Dosisleistungseffektivitätsfaktor (DDREF) | DDREF Dose and dose-rate effectiveness factor (Dosis- und Dosisleistungseffektivitätsfaktor). Der DDREF ist ein Bewertungsfaktor, der eine bei einigen Strahleneffekten geringere biologische Wirksamkeit (pro Dosis) der Strahlenexposition bei niedrigen Dosen und niedrigen Dosisleistungen berücksichtigen soll. Es handelt sich um den Faktor, um den ein zu beschreibender Dosis-Wirkungszusammenhang vom LNT-Modell abweicht. Diskutiert wird, ob er weiterhin bei malignen Prozessen zu berücksichtigen ist. |
| Detriment | Das Detriment wird auch als „schadensgewichtetes Risiko“ bezeichnet. Das Detriment ist das Produkt aus Nominellem Risikokoeffizient und Schadensqualität. Die Einheit ist Sv-1. Das Detriment hängt von einer Vielzahl von Einflussparametern ab. In die Berechnung gehen für jedes Organ oder Gewebe insbesondere ein: die Inzidenzwahrscheinlichkeit, der Letalitätsfaktor, der Verlust an Lebensqualität sowie der relative Verlust an Lebenserwartung. |
| Effektive Dosis | Die effektive Dosis ist die Summe der mit den zugehörigen, von der ICRP empfohlenen und in der Strahlenschutzverordnung festgelegten Gewebe-Wichtungsfaktoren wT multiplizierten Organ-Äquivalentdosen HT in relevanten Organen und Geweben |
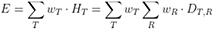 |
|
| HT ist die Organ-Äquivalentdosis in einem Gewebe oder Organ T; wT ist der Gewebe-Wichtungsfaktor, wR der Strahlungs-Wichtungsfaktor. Die Einheit der effektiven Dosis ist J kg-1. Um deutlich zu machen, dass es sich um eine gewichtete Dosisgröße handelt, wird wie bei der Äquivalentdosis anstelle von Gray (Gy) die Einheit Sievert (Sv) verwendet. | |
| Erythemgewichtete Bestrahlung |
Die erythemgewichtete Bestrahlung Her dient dem Vergleich der Erythemwirksamkeit von UV-Strahlungsquellen, bezogen auf die „Erythemale Referenzwirkungsfunktion und standardisierte Erythemdosis“.
ISO/CIE 17166:2019-05 Erythemale Referenzwirkungsfunktion und standardisierte Erythemdosis 2019-05 |
| Excess Absolute Risk (EAR) | Das absolute zusätzliche Risiko (englisch: excess absolute risk, EAR) ist ein Risikomaß, das auf der Annahme berechnet wird, dass das durch die Strahlenexposition bedingte zusätzliche Risiko ein zugrunde liegendes Basis- oder Hintergrundrisiko um einen dosisabhängigen, vom Hintergrundrisiko unabhängigen, Wert erhöht. Das absolute zusätzliche Risiko wird häufig als additive Rate pro Gy oder pro Sv ausgedrückt, sowohl für Inzidenz als auch für Mortalität.
http://icrpaedia.org/Excess_absolute_risk |
| Excess Relative Risk (ERR) (= zusätzliches relatives Risiko) | Das zusätzliche relative Risiko (excess relative risk, ERR) ist der um 1 verminderte Quotient aus dem Risiko eines Ereignisses (z. B. Krankheit oder Tod) in einer exponierten Population und dem Risiko in einer nicht exponierten Population. Das zusätzliche relative Risiko kann in strahlenepidemiologischen Studien aus dem um 1 verminderten Quotienten der Ereignisraten in beiden Gruppen geschätzt werden. In der Literatur wird dieser Zusammenhang oft nicht dargestellt und das „Excess Relative Risk“ mit dem um 1 verminderten Quotienten der Ereignisraten gleichgesetzt. |
| Gewebe-Wichtungsfaktor | Die Gewebe-Wichtungsfaktoren wT beschreiben näherungsweise den Anteil des Strahlenrisikos, der sich bei homogener Ganzkörperbestrahlung aus der Bestrahlung eines Gewebes oder Organs T für das Gesamtrisiko ergibt. Die Gewebe-Wichtungsfaktoren stellen Mittelwerte dar, gemittelt über Menschen beider Geschlechter und aller Altersgruppen, und beziehen sich somit nicht auf die Eigenschaften einzelner Personen. Durch die Gewebe-Wichtungsfaktoren werden die einzelnen Organ-Äquivalentdosen HT zur Berechnung der effektiven Dosis E gewichtet. Diese Faktoren wT spiegeln die unterschiedliche Empfindlichkeit der verschiedenen Organe, Gewebe und Körperteile T gegenüber stochastischen Strahlenwirkungen (Krebsinduktion, Auslösung von Erbschäden) wider. |
| Kerma | Kerma (Kinetic Energy released in matter oder Kinetic Energy released per unit mass) bezeichnet die Summe der kinetischen Anfangsenergien aller Sekundärelektronen, die im bestrahlten Medium in einem Volumenelement freigesetzt werden. Es ist eine vom bestrahlten Medium abhängige physikalische Größe. Im Gegensatz zur Energiedosis, die für die vom Material aufgenommene Energie definiert ist, bezieht sich die Kerma auf die dort abgegebene Energie.
In Folge der Wechselwirkung von indirekt ionisierender Strahlung mit einem Medium werden geladene Teilchen (Sekundärelektronen) ausgelöst. Sekundärelektronen geben ihre Energie an Atome und Moleküle des Materials ab. Bei Dosismessungen wird nur die Energie erfasst, die im Messvolumen wirksam ist. Sekundärelektronengleichgewicht bezeichnet den Zustand, wenn die Teilbeträge der Elektronenenergien, die außerhalb des Messvolumens abgegeben werden, gleich denen sind, die von Elektronen aus der Umgebung in das Messvolumen eingebracht werden. Im Fall des Sekundärelektronengleichgewichtes ist der Wert für die Kerma annähernd gleich dem der Energiedosis. Der Name der Einheit der Kerma ist Gray (Gy). |
| Letalitätsfaktor | Der Letalitätsfaktor kT ist Bestandteil des ICRP-Modells für das Detriment zur Schadensgewichtung von Krebserkrankungen oder Erbschäden. Er kennzeichnet den Anteil einer tödlich verlaufenden Erkrankung (Mortalität) für ein Organ T in Bezug zur Gesamtwahrscheinlichkeit für das Auftreten der Erkrankung (Inzidenz). Die Bezugsgrößen sind das Lebenszeit-Mortalitätsrisiko rM,T und das Lebenszeit-Inzidenzrisiko rI,T in einer bestimmten Bevölkerungsgruppe für das Organ T. Sind Beobachtungszeitraum und Bezugsgruppen für beide Größen identisch, kann der Letalitätsfaktor kT durch die entsprechenden Werte für die Anzahl von Sterbefällen nM,T und Anzahl von Erkrankungsfällen nI,T angenähert werden: |
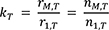 |
|
| Der Letalitätsfaktor umfasst den Wertebereich von 0 bis 1. Hierbei bedeutet kT = 0, dass die betrachtete Erkrankung im Organ T stets nicht-tödlich verläuft und keine Person an dieser Erkrankung stirbt, während kT = 1 eine stets tödlich verlaufende Erkrankung bedeutet. | |
| Life Span Study (LSS) | Die LSS Life Span Study (Langzeit-Kohortenstudie) ist eine epidemiologische Studie über gesundheitliche Folgen bei den Atombombenüberlebenden von Hiroshima und Nagasaki.
Epidemiologische Auswertungen über diese Kohorte haben eine zentrale Bedeutung für die Strahlenepidemiologie, Schätzungen des dosisabhängigen Krebsrisikos aus dieser Studie sind in die Grundlagen des derzeitigen Systems des Strahlenschutzes eingeflossen, etwa in die Festsetzung von Grenzwerten. |
| LNT-Modell | Linear-No-Threshold Model. Dieses Modell beschreibt die im Strahlenschutz gemachte Annahme, dass die Häufigkeit eines stochastischen Effekts, die im mittleren bis hohen Dosisbereich (etwa 0,1 bis 5 Gy) beobachtet wird, linear bis zur Dosis null (also ohne Schwellendosis) extrapoliert werden kann. |
| Nominal Risk Coefficient (= Nomineller Risikokoeffizient) |
Der Nominelle Risikokoeffizient ist eine über Geschlecht und Expositionsalter gemittelte Abschätzung des Lebenszeitrisikos pro Dosis für eine repräsentative Bevölkerungsgruppe. Das Lebenszeitrisiko bezeichnet die absolute Wahrscheinlichkeit pro Dosis, im Verlauf des Lebens an Krebs oder Leukämie zu erkranken (Inzidenzrisiko) oder daran zu sterben (Mortalitätsrisiko). Nominelle Risikokoeffizienten werden z. B. zur Festlegung der Gewebe-Wichtungsfaktoren verwendet. |
| Odds Ratio (OR) | Quotient aus zwei Odds, in der Strahlenforschung oft der Odds bei Strahlenexposition und ohne Strahlenexposition. |
| Risikokoeffizient | Der Risikokoeffizient im Strahlenschutz ist ein Koeffizient zur Berechnung der Wahrscheinlichkeit für das Auftreten eines stochastischen Effekts pro Dosis. Ein Risikokoeffizient kann für die zusätzliche relative Rate, die zusätzliche absolute Rate oder auch für kumulierte Risiken definiert werden. Die betrachtete Größe erhält man aus dem Produkt des Risikokoeffizienten mit der Dosis. Die Einheit ist Sv-1. |
| Standard-Erythemdosis (SED) | Die Standard-Erythemdosis (SED) wird als Maßeinheit für die erythemgewichtete Bestrahlung Her benutzt:
Her = 100 J m-2 = 1 SED. Die SED ist unabhängig von der individuellen Erythemempfindlichkeit der menschlichen Haut. |
| Strahlenexposition | Strahlenexposition ist die Einwirkung ionisierender Strahlung auf den menschlichen Körper. Ganzkörperexposition ist die Einwirkung ionisierender Strahlung auf den ganzen Körper. Teilkörperexposition ist die Einwirkung ionisierender Strahlung auf einzelne Organe, Gewebe oder Körperteile. Äußere Strahlenexposition ist die Einwirkung durch Strahlungsquellen außerhalb des Körpers. Innere Strahlenexposition ist die Einwirkung durch Strahlungsquellen innerhalb des Körpers. |
| Hinweis
In diesem Glossar werden Expositionen mit ionisierender Strahlung entsprechend dem gängigen Sprachgebrauch als Strahlenexposition bezeichnet. Im Strahlenschutzrecht werden Expositionen mit ionisierender Strahlung dagegen aufgrund des eindeutigen Kontexts lediglich als Expositionen bezeichnet. |
9 Literatur
| Armstrong und Kricker 2001 | Armstrong BK, Kricker A. The epidemiology of UV induced skin cancer. J Photochem Photobiol B. 2001;63(1-3):8-18, doi: 10.1016/s1011-1344(01)00198-1 |
| Arnold et al. 2018 | Arnold M, de Vries E, Whiteman DC, Jemal A, Bray F, Parkin DM, Soerjomataram I. Global burden of cutaneous melanoma attributable to ultraviolet radiation in 2012. Int J Cancer. 2018 Sep 15;143(6):1305-14, doi: 10.1002/ijc.31527, Epub 20180507 |
| Austin und Reynolds 1997 | Austin DF, Reynolds P. Investigation of an excess of melanoma among employees of the Lawrence Livermore National Laboratory. Am J Epidemiol. 1997 Mar 15;145(6):524-31, doi: 10.1093/oxfordjournals.aje.a009140 |
| Azizova et al. 2018 | Azizova TV, Bannikova MV, Grigoryeva ES, Rybkina VL. Risk of malignant skin neoplasms in a cohort of workers occupationally exposed to ionizing radiation at low dose rates. PLoS One. 2018;13(10):e0205060, doi: 10.1371/journal.pone.0205060, Epub 20181005 |
| Azizova et al. 2021 | Azizova TV, Bannikova MV, Grigoryeva ES, Rybkina VL. Risk of skin cancer by histological type in a cohort of workers chronically exposed to ionizing radiation. Radiat Environ Biophys. 2021 Mar;60(1):9-22, doi: 10.1007/s00411-020-00883-6, Epub 20210103 |
| Baczynska et al. 2020 | Baczynska KA, Brown S, Chorley AC, O’Hagan JB, Khazova M, Lyachev A, Wittlich M. In-Flight UV-A Exposure of Commercial Airline Pilots. Aerosp Med Hum Perform. 2020 Jun 1;91(6):501-510. doi: 10.3357/AMHP.5507.2020 |
| Badampudi et al. 2015 | Badampudi D, Wohlin C, Petersen K. Experiences from using snowballing and database searches in systematic literature studies. Proceedings of the 19th International Conference on Evaluation and Assessment in Software Engineering, Article 17. 2015, doi: 10.1145/2745802.2745818 |
| BfS 2015 | Frasch, G., Kammerer, L., Karofsky, R. Die berufliche Strahlenexposition in Deutschland 2012-2014: Bericht des Strahlenschutzregisters. Bundesamt für Strahlenschutz 2015 |
| Bräuner et al. 2015 | Bräuner EV, Loft S, Sørensen M, Jensen A, Andersen CE, Ulbak K, Hertel O, Pedersen C, Tjønneland A, Krüger Kjær S, Raaschou-Nielsen O. Residential Radon Exposure and Skin Cancer Incidence in a Prospective Danish Cohort. PLoS One. 2015;10(8):e0135642, doi: 10.1371/journal.pone.0135642, Epub 20150814 |
| Breckow et al. 2018 | Breckow J, Emami S, Amalhaf S, Beshgard A, Buermeyer J, Spruck K. Impact of updating the non-radiation parameters in the ICRP 103 detriment model. Radiat Environ Biophys. 2018 May;57(2):89-98, doi: 10.1007/s00411-018-0731-z, Epub 2018/01/25 |
| Breckow 2020 | Breckow J. Do we really need the „detriment“ for radiation protection? Radiat Environ Biophys. 2020 Aug;59(3):343-8, doi: 10.1007/s00411-020-00861-y, Epub 20200624 |
| Cardis et al. 1995 | Cardis E, Gilbert ES, Carpenter L, Howe G, Kato I, Armstrong BK, Beral V, Cowper G, Douglas A, Fix J, Fry SA, Kaldor J, Lavé C, Salmon L, Smith PG, Voelz GL, Wiggs LD. Effects of low doses and low dose rates of external ionizing radiation: cancer mortality among nuclear industry workers in three countries. Radiat Res. 1995;142:117-32 |
| Cardis et al. 2007 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Bernar J, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklof M, Engels H, Engholm G, Gulis G, Habib RR, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. The 15-Country Collaborative Study of Cancer Risk among Radiation Workers in the Nuclear Industry: estimates of radiation-related cancer risks. Radiat Res. 2007 Apr;167(4):396-416, doi: 10.1667/RR0553.1, Epub 2007/03/29 |
| Diffey BL et al. 1990 | Diffey BL, Roscoe AH: Exposure to solar ultraviolet radiation in flight. Aviat Space Environ Med 1990, 61(11):1032-1035. |
| Dreger et al. 2020 | Dreger S, Wollschläger D, Schafft T, Hammer GP, Blettner M, Zeeb H. Cohort study of occupational cosmic radiation dose and cancer mortality in German aircrew, 1960-2014. Occup Environ Med. 2020 May;77(5):285-91, doi: 10.1136/oemed-2019-106165, Epub 20200219 |
| Emami und Breckow 2016 | Emami S, Breckow J. Untersuchung und Bewertung des Detrimentbegriffs im Strahlenschutz. Abschlussbericht des BfS-Vorhabens (FKZ) 3615S72264. https://www.bmuv.de/fileadmin/Daten_BMU/Pools/Forschungsdatenbank/fkz_3615_s_72264_ detrimentbegriff_untersuchung_bf.pdf, zuletzt aufgerufen am 21. Juli 2022 |
| Freedman et al. 2003 | Freedman DM, Sigurdson A, Rao RS, Hauptmann M, Alexander B, Mohan A, Morin Doody M, Linet MS. Risk of melanoma among radiologic technologists in the United States. Int J Cancer. 2003 Feb 10;103(4):556-62, doi: 10.1002/ijc.10854 |
| GEKID 2021 | Zentrum für Krebsregisterdaten im Robert Koch-Institut (RKI, GEKID). Krebs in Deutschland für 2017/2018. 13. Ausgabe, Robert Koch-Institut (Hrsg), Berlin |
| Gudmundsdottir et al. 2017 | Gudmundsdottir EM, Hrafnkelsson J, Rafnsson V. Incidence of cancer among licenced commercial pilots flying North Atlantic routes. Environ Health. 2017 Aug 16;16(1):86. doi: 10.1186/s12940-017-0295-4. PMID: 28814301; PMCID: PMC5559846. |
| Guérin et al. 2003 | Guérin S, Dupuy A, Anderson H, Shamsaldin A, Svahn-Tapper G, Moller T, Quiniou E, Garwicz S, Hawkins M, Avril MF, Oberlin O, Chavaudra J, de Vathaire F. Radiation dose as a risk factor for malignant melanoma following childhood cancer. Eur J Cancer. 2003 Nov;39(16):2379-86, doi: 10.1016/s0959-8049(03)00663-4 |
| Haddy et al. 2012 | Haddy N, Mousannif A, Paoletti C, Dondon MG, Shamsaldin A, Doyon F, Avril MF, Fragu P, Labbé M, Lefkopoulos D, Chavaudra J, Robert C, Diallo I, de Vathaire F. Radiotherapy as a risk factor for malignant melanoma after childhood skin hemangioma. Melanoma Res. 2012 Feb;22(1):77-85, doi: 10.1097/CMR.0b013e32834dcff1 |
| Haldorsen et al. 2000 | Haldorsen T, Reitan JB, Tveten U. Cancer incidence among Norwegian airline pilots. Scand J Work Environ Health. 2000 Apr;26(2):106-11, doi: 10.5271/sjweh.519 |
| Ichihashi et al. 1995 | Ichihashi M, Naruse K, Harada S, Nagano T, Nakamura T, Suzuki T, Wadabayashi N, Watanabe S. Trends in nonmelanoma skin cancer in Japan. Recent Results Cancer Res.139:263-73, doi: 10.1007/978-3-642-78771-3_20 |
| ICRP 1991a | International Commission on Radiological Protection (ICRP). 1990 Recommendations of the International Commission on Radiological Protection. ICRP Publication 60. Ann. ICRP 21(1-3), Pergamon Press, Oxford, 1991a, ISBN 0080411444 |
| ICRP 1991b | International Commission on Radiological Protection (ICRP). The biological basis for dose limitation in the skin. A report of a Task Group of Committee 1 of the International Commission on Radiological Protection. ICRP Publication 59. Ann ICRP 22:1-104, 1991b, ISBN 0146-6453 (Print), 0146-6453 |
| ICRP 2007 | International Commission on Radiological Protection (ICRP). The 2007 Recommendations of the International Commission on Radiological Protection. ICRP Publication 103. Ann ICRP 37(2-4):1-332, Elsevier, Oxford, 2007, ISBN 9780702030482, doi: 10.1016/j.icrp.2007.10.003 |
| IARC 2021 | IARC-Publication Cancer Incidence in Five Continents, Vol. XI, IARC Scientific Publication 166, Lyon, 2021 |
| ICRP 2022 | (ICRP). Radiation Detriment Calculation Methodology. ICRP Publication 152:. Ann ICRP 51:9-103, 2022, ISBN 1872-969X (Electronic); doi: 10.1177/01466453221080101 |
| Karlsson et al. 1998 | Karlsson P, Holmberg E, Samuelsson A, Johansson KA, Wallgren A. Soft tissue sarcoma after treatment for breast cancer–a Swedish population-based study. Eur J Cancer. 1998 Dec;34(13):2068-75, doi: 10.1016/s0959-8049(98)00319-0 |
| Katalinic 2022 | Katalinic A. Update – Prognose und Zahlen zu Hautkrebs in Deutschland. https://www.krebsregister-sh.de/wp-content/uploads/2022/04/Zahlen_Hautkrebs_2022-1.pdf, zuletzt aufgerufen am 29. August 2022 |
| Kishikawa et al. 2005 | Kishikawa M, Koyama K, Iseki M, Kobuke T, Yonehara S, Soda M, Ron E, Tokunaga M, Preston DL, Mabuchi K, Tokuoka S. Histologic characteristics of skin cancer in Hiroshima and Nagasaki: background incidence and radiation effects. Int J Cancer. 2005 Nov 10;117(3):363-9, doi: 10.1002/ijc.21156, Epub 2005/05/19 |
| Kulich et al. 2011 | Kulich M, Reřicha V, Reřicha R, Shore DL, Sandler DP. Incidence of non-lung solid cancers in Czech uranium miners: a case-cohort study. Environ Res. 2011 Apr;111(3):400-5, doi: 10.1016/j.envres.2011.01.008, Epub 20110121 |
| Landthaler et al. 1995 | Landthaler M, Hagspiel HJ, Braun-Falco O. Late irradiation damage to the skin caused by soft X-ray radiation therapy of cutaneous tumors. Arch Dermatol. 1995 Feb;131(2):182-6 |
| Langner et al. 2004 | Langner I, Blettner M, Gundestrup M, Storm H, Aspholm R, Auvinen A, Pukkala E, Hammer GP, Zeeb H, Hrafnkelsson J, Rafnsson V, Tulinius H, De Angelis G, Verdecchia A, Haldorsen T, Tveten U, Eliasch H, Hammar N, Linnersjö A. Cosmic radiation and cancer mortality among airline pilots: results from a European cohort study (ESCAPE). Radiat Environ Biophys. 2004 Feb;42(4):247-56, doi: 10.1007/s00411-003-0214-7, Epub 20031128 |
| Lee et al. 2015 | Lee T, Sigurdson AJ, Preston DL, Cahoon EK, Freedman DM, Simon SL, Nelson K, Matanoski G, Kitahara CM, Liu JJ, Wang T, Alexander BH, Doody MM, Linet MS, Little MP. Occupational ionising radiation and risk of basal cell carcinoma in US radiologic technologists (1983-2005). Occup Environ Med. 2015 Dec;72(12):862-9, doi: 10.1136/oemed-2015-102880, Epub 20150908 |
| Little und Charles 1997 | Little MP, Charles MW. The risk of non-melanoma skin cancer incidence in the Japanese atomic bomb survivors. Int J Radiat Biol. 1997 May;71(5):589-602, doi: 10.1080/095530097143923 |
| Metz-Flamant et al. 2013 | Metz-Flamant C, Samson E, Caër-Lorho S, Acker A, Laurier D. Solid cancer mortality associated with chronic external radiation exposure at the French atomic energy commission and nuclear fuel company. Radiat Res. 2011 Jul;176(1):115-27. doi: 10.1667/RR2528.1. Epub 2011 Apr 8. PMID: 21476856. |
| Moore et al. 1997 | Moore DH, 2nd, Patterson HW, Hatch F, Discher D, Schneider JS, Bennett D, Mendelsohn ML. Case-control study of malignant melanoma among employees of the Lawrence Livermore National Laboratory. Am J Ind Med. 1997 Oct;32(4):377-91, doi: 10./(sici)1097-0274(199710)32:4<377::aid-ajim9>3.0.co;2-r |
| Muirhead et al. 2009 | Muirhead CR, O’Hagan JA, Haylock RG, Phillipson MA, Willcock T, Berridge GL, Zhang W. Mortality and cancer incidence following occupational radiation exposure: third analysis of the National Registry for Radiation Workers. Br J Cancer. 2009 Jan 13;100(1):206-12. doi: 10.1038/sj.bjc.6604825. PMID: 19127272; PMCID: PMC2634664. |
| NIH│NCI 2021 | National Institutes of Health │ National Cancer institute (NIH│NCI). Surveillance, Epidemiology, and End Results Program. SEER*Explorer. https://seer.cancer.gov/statistics-network/explorer/application.html, zuletzt aufgerufen am 21. Juli 2022 |
| Pierce et al. 1996 | Pierce DA, Shimizu Y, Preston DL, Vaeth M, Mabuchi K. Studies of the mortality of atomic bomb survivors. Report 12, Part I. Cancer: 1950-1990. Radiat Res. 1996 Jul;146(1):1-27, Epub 1996/07/01 |
| Pinkerton et al. 2018 | Pinkerton LE, Hein MJ, Anderson JL, Christianson A, Little MP, Sigurdson AJ, Schubauer-Berigan MK. Melanoma, thyroid cancer, and gynecologic cancers in a cohort of female flight attendants. Am J Ind Med. 2018 Jul;61(7):572-81, doi: 10.1002/ajim.22854, Epub 20180424 |
| Preston et al. 2007 | Preston DL, Ron E, Tokuoka S, Funamoto S, Nishi N, Soda M, Mabuchi K, Kodama K. Solid cancer incidence in atomic bomb survivors: 1958-1998. Radiat Res. 2007 Jul;168(1):1-64, doi: 10.1667/RR0763.1, Epub 2007/08/29 |
| Pukkala et al. 2002 | Pukkala E, Aspholm R, Auvinen A, Eliasch H, Gundestrup M, Haldorsen T, Hammar N, Hrafnkelsson J, Kyyrönen P, Linnersjö A, Rafnsson V, Storm H, Tveten U. Incidence of cancer among Nordic airline pilots over five decades: occupational cohort study. Bmj. 2002 Sep 14;325(7364):567, doi: 10.1136/bmj.325.7364.567 |
| Pukkala et al. 2012 | Pukkala E, Helminen M, Haldorsen T, Hammar N, Kojo K, Linnersjö A, Rafnsson V, Tulinius H, Tveten U, Auvinen A. Cancer incidence among Nordic airline cabin crew. Int J Cancer. 2012 Dec 15;131(12):2886-97. doi: 10.1002/ijc.27551. Epub 2012 Apr 16. PMID: 22447246. |
| Rafnsson et al. 2000 | Rafnsson V, Hrafnkelsson J, Tulinius H. Incidence of cancer among commercial airline pilots. Occup Environ Med. 2000 Mar;57(3):175-9, doi: 10.1136/oem.57.3.175 |
| Ramasamy et al. 2017 | Ramasamy K, Shanmugam M, Balupillai A, Govindhasamy K, Gunaseelan S, Muthusamy G, Robert B, Nagarajan R. Ultraviolet radiation-induced carcinogenesis: Mechanisms and experimental models. Journal of Radiation and Cancer Research. 2017;8(1), doi: 10.4103/0973-0168.199301 |
| Ron et al. 1991 | Ron E, Modan B, Preston D, Alfandary E, Stovall M, Boice JD, Jr. Radiation-induced skin carcinomas of the head and neck. Radiat Res. 1991 Mar;125(3):318-25 |
| Ron et al. 1998 | Ron E, Preston DL, Kishikawa M, Kobuke T, Iseki M, Tokuoka S, Tokunaga M, Mabuchi K. Skin tumor risk among atomic-bomb survivors in Japan. Cancer Causes Control. 1998 Aug;9(4):393-401, doi: 10.1023/a:1008867617415, Epub 1998/10/30 |
| Samson et al. 2011 | Samson E, Telle-Lamberton M, Caër-Lorho S, Bard D, Giraud JM, Metz-Flamant C, Neron MO, Quesne B, Acker A, Tirmarche M, Hill C. Cancer mortality among two different populations of French nuclear workers. Int Arch Occup Environ Health. 2011 Aug;84(6):627-34, doi: 10.1007/s00420-011-0636-5, Epub 20110411 |
| Schwartz et al. 2009 | Schwartz JL, Kopecky KJ, Mathes RW, Leisenring WM, Friedman DL, Deeg HJ. Basal cell skin cancer after total-body irradiation and hematopoietic cell transplantation. Radiat Res. 2009 Feb;171(2):155-63, doi: 10.1667/rr1469.1 |
| Shore et al. 2002 | Shore RE, Moseson M, Xue X, Tse Y, Harley N, Pasternack BS. Skin cancer after X-ray treatment for scalp ringworm. Radiat Res. 2002 Apr;157(4):410-8, doi: 10.1667/0033-7587(2002)157[0410:scaxrt]2.0.co;2 |
| Sont et al. 2001 | Sont WN, Zielinski JM, Ashmore JP, Jiang H, Krewski D, Fair ME, Band PR, Létourneau EG. First analysis of cancer incidence and occupational radiation exposure based on the National Dose Registry of Canada. Am J Epidemiol. 2001 Feb 15;153(4):309-18, doi: 10.1093/aje/153.4.309 |
| SSK 2014 | Strahlenschutzkommission (SSK). Dosis- und Dosisleistungs-Effektivitätsfaktor (DDREF). Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung, verabschiedet in der 268. Sitzung der Strahlenschutzkommission am 13./14. Februar 2014. urn:nbn:de:101:1-201604043407. Bekanntmachung vom 17. November 2015 (BAnz AT 03.05.2016 B4) |
| SSK 2018 | Strahlenschutzkommission (SSK). Grundlagen zur Begründung von Grenzwerten für beruflich strahlenexponierte Personen. Empfehlung der Strahlenschutzkommission mit wissenschaftlicher Begründung, verabschiedet im Umlaufverfahren am 7. September 2018. Bekanntmachung vom 13. August 2019 (BAnz AT 14.11.2019 B5) |
| Sugiyama et al. 2014 | Sugiyama H, Misumi M, Kishikawa M, Iseki M, Yonehara S, Hayashi T, Soda M, Tokuoka S, Shimizu Y, Sakata R, Grant EJ, Kasagi F, Mabuchi K, Suyama A, Ozasa K. Skin cancer incidence among atomic bomb survivors from 1958 to 1996. Radiat Res. 2014 May;181(5):531-9, doi: 10.1667/rr13494.1, Epub 20140422 |
| Thompson et al. 1994 | Thompson DE, Mabuchi K, Ron E, Soda M, Tokunaga M, Ochikubo S, Sugimoto S, Ikeda T, Terasaki M, Izumi S, et al. Cancer incidence in atomic bomb survivors. Part II: Solid tumors, 1958-1987. Radiat Res. 1994 Feb;137(2 Suppl):S17-67 |
| Vienneau et al. 2017 | Vienneau D, de Hoogh K, Hauri D, Vicedo-Cabrera AM, Schindler C, Huss A, Röösli M. Effects of Radon and UV Exposure on Skin Cancer Mortality in Switzerland. Environ Health Perspect. 2017 Jun 16;125(6):067009, doi: 10.1289 /ehp825, Epub 20170616 |
Anhang
A-1 Index-Liste mit 19 Übersichtsarbeiten und Berichten zu Hautkrebs und Strahlung aus den Jahren 1978 bis 2019
| Armstrong und Kricker 1995 | Armstrong BK, Kricker A. Skin cancer. Dermatol Clin. 1995 Jul;13(3):583-94 |
| Ballard et al. 2000 | Ballard T, Lagorio S, De Angelis G, Verdecchia A. Cancer incidence and mortality among flight personnel: a meta-analysis. Aviat Space Environ Med. 2000 Mar;71(3):216-24 |
| Boice et al. 2000 | Boice JD, Jr., Blettner M, Auvinen A. Epidemiologic studies of pilots and aircrew. Health Phys. 2000 Nov;79(5):576-84, doi: 10.1097/00004032-200011000-00016 |
| Burns 1989 | Burns FJ. Cancer risk associated with therapeutic irradiation of skin. Arch Dermatol. 1989 Jul;125(7):979-81 |
| Cuperus et al. 2013 | Cuperus E, Leguit R, Albregts M, Toonstra J. Post radiation skin tumors: basal cell carcinomas, squamous cell carcinomas and angiosarcomas. A review of this late effect of radiotherapy. Eur J Dermatol. 2013 Nov-Dec;23(6):749-57, doi: 10.1684/ejd.2013.2106 |
| Everall und Dowd 1978 | Everall JD, Dowd PM. Influence of environmental factors excluding ultra violet radiation on the incidence of skin cancer. Bull Cancer. 1978;65(3):241-7 |
| Fink und Bates 2005 | Fink CA, Bates MN. Melanoma and ionizing radiation: is there a causal relationship? Radiat Res. 2005 Nov;164(5):701-10, doi: 10.1667/rr3447.1 |
| Gawkrodger 2004 | Gawkrodger DJ. Occupational skin cancers. Occup Med (Lond). 2004 Oct;54(7):458-63, doi: 10.1093/occmed/kqh098 |
| Hammer et al. 2009 | Hammer GP, Blettner M, Zeeb H. Epidemiological studies of cancer in aircrew. Radiat Prot Dosimetry. 2009 Oct;136(4):232-9, doi: 10.1093/rpd/ncp125, Epub 20090716 |
| Li und Athar 2016 | Li C, Athar M. Ionizing Radiation Exposure and Basal Cell Carcinoma Pathogenesis. Radiat Res. 2016 Mar;185(3):217-28, doi: 10.1667/rr4284.S1, Epub 20160301 |
| Little 2009 | Little MP. Cancer and non-cancer effects in Japanese atomic bomb survivors. J Radiol Prot. 2009 Jun;29(2A):A43-59, doi: 10.1088/0952-4746/29/2A/S04, Epub 2009/05/21 |
| Miura et al. 2019 | Miura K, Olsen CM, Rea S, Marsden J, Green AC. Do airline pilots and cabin crew have raised risks of melanoma and other skin cancers? Systematic review and meta-analysis. Br J Dermatol. 2019 Jul;181(1):55-64, doi: 10.1111/bjd.17586, Epub 20190318 |
| Sanlorenzo et al. 2015 | Sanlorenzo M, Wehner MR, Linos E, Kornak J, Kainz W, Posch C, Vujic I, Johnston K, Gho D, Monico G, McGrath JT, Osella-Abate S, Quaglino P, Cleaver JE, Ortiz-Urda S. The risk of melanoma in airline pilots and cabin crew: a meta-analysis. JAMA Dermatol. 2015 Jan;151(1):51-8. Doi: 10.1001/jamadermatol.2014.1077. PMID: 25188246; PMCID: PMC4482339. |
| Shantha et al. 2015 | Shantha E, Lewis C, Nghiem P. Why Do Airline Pilots and Flight Crews Have an Increased Incidence of Melanoma? JAMA Oncol. 2015 Sep;1(6):829-30, doi: 10.1001/jamaoncol.2015.0933 |
| Shore 1990 | Shore RE. Overview of radiation-induced skin cancer in humans. Int J Radiat Biol. 1990 Apr;57(4):809-27, doi: 10.1080/09553009014550951 |
| Shore 2001 | Shore RE. Radiation-induced skin cancer in humans. Med Pediatr Oncol. 2001 May;36(5):549-54, doi: 10.1002/mpo.1128 |
| Sigurdson und Ron 2004 | Sigurdson AJ, Ron E. Cosmic radiation exposure and cancer risk among flight crew. Cancer Invest. 2004;22(5):743-61, doi: 10.1081/cnv-200032767 |
| Wilkinson 1997 | Wilkinson GS. Invited commentary: are low radiation doses or occupational exposures really risk factors for malignant melanoma? Am J Epidemiol. 1997 Mar 15;145(6):532-5, doi: 10.1093/oxfordjournals.aje.a009141 |
| Zielinski et al. 2008 | Zielinski JM, Shilnikova NS, Krewski D. Canadian National Dose Registry of radiation workers: overview of research from 1951 through 2007. Int J Occup Med Environ Health. 2008;21(4):269-75, doi: 10.2478/v10001-008-0037-5 |
A-2 Liste mit 76 identifizierten, aber ausgeschlossenen Publikationen
| Alfonso et al. 2021 | Alfonso JH, Martinsen JI, Weiderpass E, Pukkala E, Kjaerheim K, Tryggvadottir L, Lynge E. Occupation and cutaneous melanoma: a 45-year historical cohort study of 14·9 million people in five Nordic countries. Br J Dermatol. 2021;184(4):672-680. |
| Antunes et al. 2020 | Antunes L, Bento MJ, Sobrinho-Simões M, Soares P, Boaventura P. Cancer incidence after childhood irradiation for tinea capitis in a Portuguese cohort. Br J Radiol. 2020;93(1105):20180677. |
| Blettner et al. 2003 | Blettner M, Zeeb H, Auvinen A, Ballard TJ, Caldora M, Eliasch H, Gundestrup M, Haldorsen T, Hammar N, Hammer GP, Irvine D, Langner I, Paridou A, Pukkala E, Rafnsson V, Storm H, Tulinius H, Tveten U, Tzonou A. Mortality from cancer and other causes among male airline cockpit crew in Europe. Int. J. Cancer 2003;106: 946-952. |
| Ballard et al. 2000 | Ballard T, Lagorio S, De Angelis G, Verdecchia A. Cancer incidence and mortality among flight personnel: a meta-analysis. Aviat Space Environ Med. 2000;71(3):216-24. Erratum in: Aviat Space Environ Med 2000;71(12):1262. |
| Buja et al. 2005 | Buja A, Lange JH, Perissinotto E, Rausa G, Grigoletto F, Canova C, Mastrangelo G. Cancer incidence among male military and civil pilots and flight attendants: an analysis on published data. Toxicology and Industrial Health. 2005;21(10):273-282. |
| Cardis et al. 2005 | Cardis E, Vrijheid M, Blettner M, Gilbert E, Hakama M, Hill C, Howe G, Kaldor J, Muirhead CR, Schubauer-Berigan M, Yoshimura T, Bermann F, Cowper G, Fix J, Hacker C, Heinmiller B, Marshall M, Thierry-Chef I, Utterback D, Ahn YO, Amoros E, Ashmore P, Auvinen A, Bae JM, Solano JB, Biau A, Combalot E, Deboodt P, Diez Sacristan A, Eklof M, Engels H, Engholm G, Gulis G, Habib R, Holan K, Hyvonen H, Kerekes A, Kurtinaitis J, Malker H, Martuzzi M, Mastauskas A, Monnet A, Moser M, Pearce MS, Richardson DB, Rodriguez-Artalejo F, Rogel A, Tardy H, Telle-Lamberton M, Turai I, Usel M, Veress K. Risk of cancer after low doses of ionising radiation: retrospective cohort study in 15 countries. BMJ. 2005;331(7508):77. |
| Charles 2000 | Charles M. UNSCEAR report 2000: sources and effects of ionizing radiation. United Nations Scientific Committee on the Effects of Atomic Radiation. J Radiol Prot. 2001;21(1):83-6. |
| Charles 2007 | Charles MW. Radon exposure of the skin: II. Estimation of the attributable risk for skin cancer incidence. J Radiol Prot. 2007;27(3):253-74. |
| Cuperus et al. 2013 | Cuperus E, Leguit R, Albregts M, Toonstra J. Post radiation skin tumors: basal cell carcinomas, squamous cell carcinomas and angiosarcomas. A review of this late effect of radiotherapy. Eur J Dermatol. 2013;23(6):749-57. |
| Curtis et al. 1997 | Curtis RE, Rowlings PA, Deeg HJ, Shriner DA, Socíe G, Travis LB, Horowitz MM, Witherspoon RP, Hoover RN, Sobocinski KA, Fraumeni JF Jr, Boice JD Jr. Solid cancers after bone marrow transplantation. N Engl J Med. 1997;336(13):897-904. |
| De Angelis et al. 2001 | De Angelis G, Caldora M, Santaquilani M, Scipione R, Verdecchia A. Health risks from radiation exposure for civilian aviation flight personnel: a study of Italian airline crew members. Radiat Res. 2001;156(5 Pt 2):689-94. |
| De Angelis et al. 2001 | De Angelis G, Caldora M, Santaquilani M, Scipione R, Verdecchia A. Radiation-induced biological effects on crew members: a combined analysis on atmospheric flight personnel. Phys Med. 2001;17 Suppl 1:173-4. |
| Faggiano et al. 1997 | Faggiano F, Partanen T, Kogevinas M, Boffetta P. Socioeconomic differences in cancer incidence and mortality. IARC Sci Publ. 1997;(138):65-176. |
| Fink und Bates 2005 | Fink CA, Bates MN. Melanoma and ionizing radiation: is there a causal relationship? Radiat Res. 2005;164(5):701-10. |
| Fortes und Vries 2008 | Fortes C, de Vries E. Nonsolar occupational risk factors for cutaneous melanoma. Int J Dermatol. 2008;47(4):319-28. |
| Gunderstrup und Storm 1999 | Gundestrup M, Storm HH. Radiation-induced acute myeloid leukaemia and other cancers in commercial jet cockpit crew: a population-based cohort study. Lancet. 1999;354(9195):2029-31. |
| Green and Olsen 2017 | Green AC, Olsen CM. Cutaneous squamous cell carcinoma: an epidemiological review. Br J Dermatol. 2017;177(2):373-381. |
| Hammar et al. 2002 | Hammar N, Linnersjö A, Alfredsson L, Dammström BG, Johansson M, Eliasch H. Cancer incidence in airline and military pilots in Sweden 1961-1996. Aviation, Space, and Environmental Medicine. 2002;73(1):2-7. |
| Hammer et al. 2009 | Hammer GP, Blettner M, Zeeb H. Epidemiological studies of cancer in aircrew. Radiat Prot Dosimetry. 2009;136(4):232-9. |
| Hammer et al. 2012 | Hammer GP, Blettner M, Langner I, Zeeb H. Cosmic radiation and mortality from cancer among male German airline pilots: extended cohort follow-up. Eur J Epidemiol. 2012;27(6):419-29. |
| Hammer et al. 2014 | Hammer GP, Auvinen A, De Stavola BL, Grajewski B, Gundestrup M, Haldorsen T et al. Mortality from cancer and other causes in commercial airline crews: A joint analysis of cohorts from 10 countries. Occupational and Environmental 2014;71(5):313-322. |
| Hodgson et al. 2007 | Hodgson NC, Bowen-Wells C, Moffat F, Franceschi D, Avisar E. Angiosarcomas of the breast: a review of 70 cases. Am J Clin Oncol. 2007;30(6):570-3. |
| Howe et al. 2004 | Howe GR, Zablotska LB, Fix JJ, Egel J, Buchanan J. Analysis of the mortality experience amongst U.S. nuclear power industry workers after chronic low-dose exposure to ionizing radiation. Radiat Res. 2004;162(5):517-26. |
| ICRP 2007 | The 2007 Recommendations of the International Commission on Radiological Protection. ICRP publication 103. Ann ICRP. 2007;37(2-4):1-332. |
| ICRP 1990 | 1990 Recommendations of the International Commission on Radiological Protection. Ann ICRP. 1991;21(1-3):1-201. |
| Karagas et al. 2007 | Karagas M R, Nelson HH, Zens MS, Linet M, Stukel TA, Spencer S, Applebaum KM, Mott L, Mabuchi K. Squamous cell and basal cell carcinoma of the skin in relation to radiation therapy and potential modification of risk by sun exposure. Epidemiology 2007; 18(6): 776-784. |
| Kishikawa et al. 2005 | Kishikawa M, Koyama K, Iseki M, Kobuke T, Yonehara S, Soda M, Ron E, Tokunaga M, Preston DL, Mabuchi K, Tokuoka S. Histologic characteristics of skin cancer in Hiroshima and Nagasaki: background incidence and radiation effects. Int J Cancer. 2005;117(3):363-9. |
| Kricker et al. 1991 | Kricker A, Armstrong BK, English DR, Heenan PJ. Pigmentary and cutaneous risk factors for non-melanocytic skin cancer–a case-control study. Int J Cancer. 1991;48(5):650-62. |
| Levi et al. 2006 | Levi F, Moeckli R, Randimbison L, Te VC, Maspoli M, La Vecchia C. Skin cancer in survivors of childhood and adolescent cancer. European Journal of Cancer 2006; 42(5):656-659 |
| Lichter et al. 2000 | Lichter MD, Karagas MR, Mott LA, Spencer SK, Stukel TA, Greenberg ER. Therapeutic ionizing radiation and the incidence of basal cell carcinoma and squamous cell carcinoma. The New Hampshire Skin Cancer Study Group. Arch Dermatol. 2000;136(8):1007-11. |
| Linnersjö et al. 2004 | Linnersjö A, Hammar N, Dammström BG, Johansson M, Eliasch H. Cancer incidence in airline cabin crew: experience from Sweden. Occup Environ Med. 2003;60(11):810-4. Erratum in: Occup Environ Med. 2004;61(1):94. |
| Little 2012 | Little MP. Heterogeneity of variation of relative risk by age at exposure in the Japanese atomic bomb survivors. Radiat Environ Biophys. 2009;48(3):253-62. Erratum in: Radiat Environ Biophys. 2012;51(2):223. |
| Little und Charles 1997 | Little MP, Charles MW. The risk of non-melanoma skin cancer incidence in the Japanese atomic bomb survivors. Int J Radiat Biol. 1997;71(5):589-602. |
| Lochard et al. 2016 | Lochard J, Bartlett DT, Rühm W, Yasuda H, Bottollier-Depois JF; Authors on behalf of ICRP. ICRP Publication 132: Radiological Protection from Cosmic Radiation in Aviation. Ann ICRP. 2016;45(1):5-48. |
| Lutsky et al. 2018 | Lutsyk M, Ben-Yosef R, Bergman R, Kuten A, Bar-Sela G. Total Skin Electron Irradiation and Sequential Malignancies in Mycosis Fungoides Patients: Longitudinal Study. Clin Oncol (R Coll Radiol). 2018;30(10):618-624. |
| Maalej et al. 2004 | Maalej M, Frikha H, Kochbati L, Bouaouina N, Sellami D, Benna F, Gargouri W, Dhraief S, Nasr C, Daoud J, Hajji M, Fazaa B, Souissi R, Mokhtar I, Kamoun MR. Radio-induced malignancies of the scalp about 98 patients with 150 lesions and literature review. Cancer Radiother. 2004;8(2):81-7. |
| Martin et al. 2016 | Martin MT, Vulin A, Hendry JH. Human epidermal stem cells: Role in adverse skin reactions and carcinogenesis from radiation. Mutat Res Rev Mutat Res. 2016;770(Pt B):349-368. |
| Miura et al. 2019 | Miura K, Olsen CM, Rea S, Marsden J, Green AC. Do airline pilots and cabin crew have raised risks of melanoma and other skin cancers? Systematic review and meta-analysis. Br J Dermatol. 2019;181(1):55-64. |
| Morrissey et al. 1998 | Morrissey WM Jr, Murphy RX Jr, Scarlato M. Nonmelanomatous skin cancer following exposure to atomic radiation in the United States. Plast Reconstr Surg. 1998;101(2):431-3. |
| Murihead et al. 1999 | Muirhead, CR, Goodill A, Haylock RGE, Vokes J, Little MP, Jackson DA, O’Hagan JA, Thomas JM, Kendall GM, Silk T, Bingham D, Berridge GLC. Occupational radiation exposure and mortality: second analysis of the National Registry for Radiation Workers. J Radiol Prot. 1999; 19(3-26). |
| Murihead et al. 2003 | Muirhead CR, Bingham D, Haylock RG, O’Hagan JA, Goodill AA, Berridge GL, English MA, Hunter N, Kendall GM. Follow up of mortality and incidence of cancer 1952-98 in men from the UK who participated in the UK’s atmospheric nuclear weapon tests and experimental programmes. Occup Environ Med. 2003;60(3):165-72. |
| NRC 1990 | National Research Council (US) Committee on the Biological Effects of Ionizing Radiation (BEIR V). Health Effects of Exposure to Low Levels of Ionizing Radiation: BEIR V. Washington (DC): National Academies Press (US); 1990. |
| NRC 2006 | National Research Council. Health Risks from Exposure to Low Levels of Ionizing Radiation: BEIR VII Phase 2. Washington, DC: The National Academies Press (US); 2006. |
| Ozasa et al. 2013 | Ozasa K, Shimizu Y, Suyama A, Kasagi F, Soda M, Grant EJ, Sakata R, Sugiyama H, Kodama K. Studies of the mortality of atomic bomb survivors, Report 14, 1950-2003: an overview of cancer and noncancer diseases. Radiat Res. 2012;177(3):229-43. Erratum in: Radiat Res. 2013;179(4):e40-1. |
| Parkin und Darby 2011 | Parkin DM, Darby SC. 12. Cancers in 2010 attributable to ionising radiation exposure in the UK. Br J Cancer. 2011;105 Suppl 2(Suppl 2):S57-65. |
| Parkin et al. 2011 | Parkin DM, Boyd L, Walker LC. 16. The fraction of cancer attributable to lifestyle and environmental factors in the UK in 2010. Br J Cancer. 2011;105 Suppl 2(Suppl 2):S77-81. |
| Perkins et al. 2005 | Perkins JL, Liu Y, Mitby PA, Neglia JP, Hammond S, Stovall M, Meadows AT, Hutchinson R, Dreyer ZE, Robison LL, Mertens AC. Nonmelanoma skin cancer in survivors of childhood and adolescent cancer: a report from the childhood cancer survivor study. J Clin Oncol. 2005;23(16):3733-41. |
| Pierce and Preston 2000 | Pierce DA, Preston DL. Radiation-Related Cancer Risks at Low Doses among Atomic Bomb Survivors. Radiat Res. 2000;154(2):178–186. |
| Pierce et al. 2012 | Pierce DA, Shimizu Y, Preston DL, Vaeth M, Mabuchi K. Studies of the mortality of atomic bomb survivors. Report 12, part I. Cancer: 1950-1990. 1996. Radiat Res. 2012;178(2):AV61-87. |
| Preston et al. 2003 | Preston DL, Shimizu Y, Pierce DA, Suyama A, Mabuchi K. Studies of mortality of atomic bomb survivors. Report 13: Solid cancer and noncancer disease mortality: 1950-1997. Radiat Res. 2003;160(4):381-407. |
| Preston et al. 2007 | Preston DL, Ron E, Tokuoka S, Funamoto S, Nishi N, Soda M, Mabuchi K, Kodama K. Solid cancer incidence in atomic bomb survivors: 1958-1998. Radiat Res. 2007;168(1):1-64. |
| Preston et al. 2008 | Preston DL, Cullings H, Suyama A, Funamoto S, Nishi N, Soda M, Mabuchi K, Kodama K, Kasagi F, Shore RE. Solid cancer incidence in atomic bomb survivors exposed in utero or as young children. J Natl Cancer Inst. 2008;100(6):428-36. |
| Pukkala et al. 2003 | Pukkala E, Aspholm R, Auvinen A, Eliasch H, Gundestrup M, Haldorsen T, Hammar N, Hrafnkelsson J, Kyyrönen P, Linnersjö A, Rafnsson V, Storm H, Tveten U. Cancer incidence among 10,211 airline pilots: a Nordic study. Aviat Space Environ Med. 2003;74(7):699-706. |
| Rafnsson et al. 2000 | Rafnsson V, Hrafnkelsson J, Tulinius H. Incidence of cancer among commercial airline pilots. Occup Environ Med. 2000;57(3):175-9. |
| Rajaraman et al. 2016 | Rajaraman P, Doody MM, Yu CL, Preston DL, Miller JS, Sigurdson AJ, Freedman DM, Alexander BH, Little MP, Miller DL, Linet MS. Cancer Risks in U.S. Radiologic Technologists Working With Fluoroscopically Guided Interventional Procedures, 1994-2008. AJR Am J Roentgenol. 2016;206(5):1101-8. |
| Ron et al. 1998 | Ron E, Preston DL, prestonkawa M, Kobuke T, Iseki M, Tokuoka S, Tokunaga M, Mabuchi K. Skin tumor risk among atomic-bomb survivors in Japan. Cancer Causes Control. 1998;9(4):393-401. |
| Sanlorenzo et al. 2015 | Sanlorenzo M, Wehner MR, Linos E, Kornak J, Kainz W, Posch C, Vujic I, Johnston K, Gho D, Monico G, McGrath JT, Osella-Abate S, Quaglino P, Cleaver JE, Ortiz-Urda S. The risk of melanoma in airline pilots and cabin crew: a meta-analysis. JAMA Dermatol. 2015;151(1):51-8. |
| Schwartzbaum et al. 1994 | Schwartzbaum JA, Setzer RW, Kupper LL. Exposure to ionizing radiation and risk of cutaneous malignant melanoma. Search for error and bias. Ann Epidemiol. 1994;4(6):487-96. |
| Shimizu et al. 1990 | Shimizu Y, Kato H, Schull WJ. Studies of the mortality of A-bomb survivors. 9. Mortality, 1950-1985: Part 2. Cancer mortality based on the recently revised doses (DS86). Radiat Res. 1990;121(2):120-41. |
| Shimizu et al. 1990 | Shimizu Y, Schull WJ, Kato H. Cancer risk among atomic bomb survivors. The RERF Life Span Study. Radiation Effects Research Foundation. JAMA. 1990;264(5):601-4. |
| Shore 1990 | Shore RE. Overview of radiation-induced skin cancer in humans. Int J Radiat Biol. 1990;57(4):809-27. |
| Talbott et al. 2003 | Talbott EO, Youk AO, McHugh-Pemu KP, Zborowski JV. Long-term follow-up of the residents of the Three Mile Island accident area: 1979-1998. Environmental Health Perspectives. 2003;111(3):341-348. |
| Thompson et al. 1994 | Thompson DE, Mabuchi K, Ron E, Soda M, Tokunaga M, Ochikubo S, Sugimoto S, Ikeda T, Terasaki M, Izumi S, et al. Cancer incidence in atomic bomb survivors. Part II: Solid tumors, 1958-1987. Radiat Res. 1994;137(2 Suppl):S17-67. Erratum in: Radiat Res 1994;139(1):129. |
| Varan und Kebudi 2011 | Varan A, Kebudi R. Secondary malignant neoplasms after childhood cancer. Pediatr Hematol Oncol. 2011;28(5):345-53. |
| Wakeford 2009 | Wakeford R. Radiation in the workplace-a review of studies of the risks of occupational exposure to ionising radiation. J Radiol Prot. 2009;29(2A):A61-79. |
| Wilkison and Wong 2017 | Wilkison BD, Wong EB. Skin cancer in military pilots: a special population with special risk factors. Cutis. 2017;100(4):218-220. |
| Withrow e al. 2017 | Withrow DR, Morton LM, Curtis RE, Schonfeld SJ, Berrington de González A. Radiotherapy for ductal carcinoma in situ and risk of second non-breast cancers. Breast Cancer Res Treat. 2017;166(1):299-306. |
| Wong et al. 1997 | Wong FL, Boice JD Jr, Abramson DH, Tarone RE, Kleinerman RA, Stovall M, Goldman MB, Seddon JM, Tarbell N, Fraumeni JF Jr, Li FP. Cancer incidence after retinoblastoma. Radiation dose and sarcoma risk. JAMA. 1997;278(15):1262-7. |
| Yamazaki und Schull 1990 | Yamazaki JN, Schull WJ. Perinatal loss and neurological abnormalities among children of the atomic bomb. Nagasaki and Hiroshima revisited, 1949 to 1989. JAMA. 1990;264(5):605-9. |
| Yong et al. 2014 | Yong LC, Pinkerton LE, Yiin JH, Anderson JL, Deddens JA. Mortality among a cohort of U.S. commercial airline cockpit crew. Am J Ind Med. 2014;57(8):906-14. |
| Yoshinaga et al. 2005 | Yoshinaga S, Hauptmann M, Sigurdson AJ, Doody MM, Freedman DM, Alexander BH, Linet MS, Ron E, Mabuchi K. Nonmelanoma skin cancer in relation to ionizing radiation exposure among U.S. radiologic technologists. Int J Cancer. 2005;115(5):828-34. |
| Yoshimoto 1990 | Yoshimoto Y. Cancer risk among children of atomic bomb survivors. A review of RERF epidemiologic studies. Radiation Effects Research Foundation. JAMA. 1990;264(5):596-600. Erratum in: JAMA 1990;264(14):1812. |
| Zeeb et al. 2003 | Zeeb H, Blettner M, Langner I, Hammer GP, Ballard TJ, Santaquilani M, Gundestrup M, Storm H, Haldorsen T, Tveten U, Hammar N, Linnersjö A, Velonakis E, Tzonou A, Auvinen A, Pukkala E, Rafnsson V, Hrafnkelsson J. Mortality from cancer and other causes among airline cabin attendants in Europe: a collaborative cohort study in eight countries. Am J Epidemiol. 2003;158(1):35-46. |
| Zeeb et al. 2012 | Zeeb H, Hammer GP, Blettner M. Epidemiological investigations of aircrew: an occupational group with low-level cosmic radiation exposure. J Radiol Prot. 2012;32(1):N15-9 |
| Zielinski et al. 2005 | Zielinski JM, Garner MJ, Krewski D, Ashmore JP, Band PR, Fair ME, Jiang H, Letourneau EG, Semenciw R, Sont WN. Decreases in occupational exposure to ionizing radiation among Canadian dental workers. J Can Dent Assoc. 2005;71(1):29-33. |
| Zielinski et al. 2008 | Zielinski JM, Shilnikova NS, Krewski D. Canadian National Dose Registry of radiation workers: overview of research from 1951 through 2007. Int J Occup Med Environ Health. 2008;21(4):269-75. |
A-3 Übersicht aller identifizierten Studien mit Daten der LSS
| Erstautor: | Publikationsjahr: | Follow-up- Zeitraum: |
Endpunkte: | Fälle: | Dosimetriesystem: |
|---|---|---|---|---|---|
| Thompson | 1994 | 1958-1987 | NMSC, MM/Inzidenz | 245 NMSC, 20 MM |
DS86 |
| Little | 1997 | 1958-1987 | NMSC/Inzidenz | 245 NMSC, 20 MM |
DS02 |
| Ron | 1998 | 1958-1987 | BCC, SCC, MM/Inzidenz | 80 BCC, 69 SCC, 10 MM |
DS86 |
| Kishikawa | 2005 | 1958-1987 | BCC, SCC, MM/Inzidenz | 106 BCC, 81 SCC, 14 MM |
DS86 |
| Preston | 2007 | 1958-1998 | NMSC, BCC, SCC/Inzidenz |
330 NMSC, 166 BCC, 131 SCC |
DS02 |
| Pierce | 1996 | 1950-1990 | NMSC/Mortalität | 28 Todesfälle | DS86 |
| Sugiyama | 2014 | 1958-1996 | BCC, SCC, MM/Inzidenz |
123 BCC, 114 SCC, 10 MM |
DS02 |
(Autoren: Luca Caramenti, Michael Hauptmann)
A-4 Tabellen mit Details des Studiendesigns (bezogen auf Personengruppen)
Tabelle A-4.1 Details der ausgewählten Studien unter Überlebenden der Atombombenexplosionen (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Design/ Study size/ Mean follow-up/ Incidence or mortality |
Number of cases | Period of case diagnoses |
Outcome ascertainment |
Exposure source/ Acute or chronic exposure |
Dosimetry | Exposure metric | Mean dose |
|---|---|---|---|---|---|---|---|---|
| LSS/Sugiyama et al. 2014 | Cohort/80,158/25.2 years/Incidence | 123 BCC, 114 SCC, 10 MM |
1958-1996 | Registries | A-bomb/Acute | Distance to center (DS02) |
Dose to the skin | Not reported |
Tabelle A-4.2 Details der ausgewählten Studien zu therapeutisch exponierten Personen (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Design/ Study size/ Mean follow-up/ Incidence or mortality |
Number of cases | Period of case diagnoses |
Outcome ascertainment |
Exposure source/ Acute or chronic exposure |
Dosimetry | Exposure metric | Mean dose |
|---|---|---|---|---|---|---|---|---|
| Swedish Cancer Registry/ Karlsson et al. 1998 |
Nested case-control/ 122,991 (underlying cohort, 3 controls per case)/7.4 years/ Incidence |
116 sarcoma of connective tissue, breast or skin (angiosarcoma: 40; other sarcomas: 76) |
1959-1992 | Cancer registry (Swedish cancer register) |
Radiation therapy (IR)/Acute |
RT 2D- treatment planning from clinical records |
Integral dose in J (combination of „dose“ and irradiated volume) |
177 J among exposed controls |
| Scalp ringworm cohort/ Shore et al. 2002 |
Cohort/ 2,224 exposed and 1,380 unexposed/ –/ Incidence |
124 exposed BCC and 21 unexposed |
Self-report with physician verification (94.4 %) |
X-ray treatment for scalp ringworm/ Acute |
Phantom- based estimation |
Cumulative scalp dose | 4.8 Gy | |
| Childhood cancer survivors/ Guerin et al. 2003 |
Case control/ 16 cases, 75 controls/ –/ Incidence |
16 MM | 1942-1987 | Cancer registry | Radiotherapy/Acute | Individual simulation based on RT files |
Mean local dose to MM location (case) and corresponding ocation (control) |
mean local dose was 15.5 Gy for cases and 3.1 Gy for controls |
| TBI cohort Schwartz et al. 2009 |
Cohort/ 6,306/ 100 days – 36.2 years/ Incidence |
282 BCC | 1969-2005 | Questionaires of patients |
Radiotherapy/Acute | Prescribed dose from patient record |
Whole body dose | 12.7 Gy |
| German RT patients Landthaler et al. 1995 |
Cohort/ 612 radiation sites of 522 patients/ –/ Incidence |
12 BCC and 9 SCC |
More than 10 years after treatment |
Pathology records and clinical records |
Radiotherapy for mostly cutaneous tumors/Acute |
Treatment planning |
Treatment dose | 80 Gy |
| Skin hemangioma cohort/ Haddy et al. 2012 |
Cohort + nested case-control/ 4,620 cohort members, case- control study with 13 cases and 5 controls per case/ –/ Incidence |
13 MM | 1986-2003 | Self-report with pathological confirmation |
Radiotherapy for skin hemangioma/ Acute |
Phantom- based |
Dose to tumour location (corresponding location in controls) |
1.08 Gy cases, 0.002 Gy controls |
| Tinea capitis cohort/ Ron et al. 1991 |
Cohort/ 27,060/ 24.5 years/ Incidence |
54 BCC | 1950-1980 | Pathology records and cancer registry |
Radiotherapy for tinea capitis/ Acute |
Phantom- based |
Cumulative absorbed scalp dose (Gy) |
6.8 Gy |
Tabelle A-4.3 Details der ausgewählten Studien zu beruflich Strahlenexponierten in Nuklearanlagen und medizinischen Einrichtungen (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Design/ Study size/ Mean follow-up/ Incidence or mortality |
Number of cases | Period of case diagnoses |
Outcome ascertainment |
Exposure source/ Acute or chronic exposure |
Dosimetry | Exposure metric | Mean dose |
|---|---|---|---|---|---|---|---|---|
| USRT (1)/ Freedman et al. 2003 |
Cohort/ 68,588/ 10.2 years/ Incidence |
207 MM | 1926-1998 | Self report | Occupational X-rays (IR)/ Chronic |
No; work history information used instead |
Years of employment in different calendar time periods as surrogate |
|
| LLNL (1)/ Austin et al. 1997 |
Case-control/ 31 cases and 110 individually matched controls, 4 per case/ –/ Incidence |
31 MM | 1969-1980 | Cancer registry (California Tumor Registry) |
Occupational/ Chronic |
No, just occupational exposure history |
Ever vs. never exposed to occupational ionizing radiation and number of exposed years |
not provided, range from 7 to 27 Sv |
| NRRW/ Muirhead et al. 2009 |
Cohort/ 174,541 Workers/ 22 years/ Incidence |
261 MM, 326 NMSC |
1976-2001 | Cancer Registry | Personal records of radiation exposure/ Chronic |
Individual | Cumulative effective dose (mSv) |
24.9 mSv |
| French nuclear workers (1)/ Samson et al. 2011 |
Cohort/ 2 cohorts, external only: 14,796 ext. and int.: 14,408/ Mortality |
ext. only: 4 ext. and int.: 12 |
1968-1994 | Death certificate | Occupational/ Chronic |
Individual dosimeters |
Cumulative effective dose from external sources (mSv) |
Cohort with external exposure only: 3.7 mSv, cohort with external and internal exposure: 12.9 mSV |
| USRT (2)/ Lee et al. 2015 |
Cohort/ 65,719/ 17 years/ Incidence |
3,615 BCC | 1983-2005 | Questionaire and medical reports |
Occupational/ Chronic |
Estimation based on batch readings and workplace information |
Absorbed skin dose |
55.8 mGy |
| Mayak workers (2)/ Azizova et al. 2021 |
Cohort/ 22,377/ BCC 26.3 years, SCC 26.4 years/ Incidence |
295 BCC, 48 SCC |
1948-2018 | Archive, medical records, patients’ hospital charts |
Plutonium production facility/ Chronic |
Individual estimation based on job records |
Cumulative absorbed gamma- ray skin dose (Gy) |
0.50 Gy |
| LLNL employees (2)/ Moore et al. 1997 |
Case-control/ 138 (69 matched controls)/ –/ Incidence, prevalence |
69 MM | 1969-1989 | Skin cancer diagnoses among employees |
Nuclear workers/ Chronic |
Individual estimates from dosimetry records |
Cumulative dose for gamma, neutron, tritium, skin and hand (rem) |
7.6 mSv cases, 7.1 mSv controls |
| Mayak workers (1)/ Azizova et al. 2018 |
Cohort/ 22,377/ MM 25.5 years, NMSC 25.2 years/ Incidence |
60 MM, 294 NMSC |
1948-2013 | Archive, medical records, patients’ hospital charts |
Plutonium production facility/ Chronic |
Individual estimation based on job records |
Cumulative skin dose (Sv) |
0.54 Sv |
| 15-Country Study/ Cardis et al. 2007 |
Cohort/ 407,391/ 12.7 years/ Mortality |
87 MM | Death certificate | Nuclear workers/ Chronic |
Recorded dose |
Cumulative whole body dose (mSv) | 19.4 mSv | |
| Canadian National Dose Registry/ Sont et al. 2001 |
Cohort/ 191,333/ –/ Incidence |
222 MM | 1969-1988 | Cancer registry | Nuclear workers/ Chronic |
Occupational routine measurements |
Cumulative whole body dose 1951-1988 (in Sv lagged by 10 years) |
6.64 mSv |
| French nuclear workers (2)/ Metz-Flamant et al. 2013 |
Cohort/ 59,021/ 25.9 years/ Mortality |
68 MM, 7 NMSC |
1968-2004 | Death certificates | Nuclear workers/ Chronic |
Estimation based on individual dosimeter readings |
Whole body dose | 22.5 mSv among exposed (72 %) |
Tabelle A-4.4 Details der ausgewählten Studien unter Flugpersonal (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Design/ Study size/ Mean follow-up/ Incidence or mortality |
Number of cases | Period of case diagnoses |
Outcome ascertainment |
Exposure source/ Acute or chronic exposure |
Dosimetry | Exposure metric | Mean dose |
|---|---|---|---|---|---|---|---|---|
| Nordic airline pilots/ Pukkala et al. 2002 |
Cohort/ 10,032/ 17.7 years/ Incidence |
56 MM, 27 other skin excluding BCC, 61 BCC |
1943-1997 | National Cancer Registry (Denmark, Finland, Iceland, Norway, Sweden) |
Cosmic/ Chronic |
Block hours, type of flight, altitude |
Effective dose (mSv) |
Mean dose not provided, 11 % of person years > 20 mSv |
| ESCAPE airline pilots/ Langner et al. 2004 |
Cohort 19,184 (male pilots)/ –/ Mortality |
14 MM | 1921-1997 | Death certificate (Denmark, Finland, Germany, Iceland, Italy, Norway, Sweden) |
Cosmic/ Chronic |
Block hours and job exposure matrix (aircraft and calendar year specific dose rates) |
Effective dose (mSv) |
Mean lifetime cumulative dose: 15.3 mSv |
| German aircrew/ Dreger et al. 2020 |
Cohort/ 26,846/ 32 years/ Mortality |
10 MM | 1960-2014 | Death certificate | Cosmic/ Chronic |
Individual estimation based on Federal Radiation Protection Register data |
Cumulative effective dose (Sv) |
Median cumulative effective dose 34.2 mSv (Max: 116 mSv) |
| US flight attendants/ Pinkerton et al. 2018 |
Cohort/ 6,095 female Qx respondents/ –/ Incidence |
125 MM | from 1970 | Self-report, medical records, cancer registry |
Cosmic/ Chronic |
Flight schedule |
Cosmic radiation absorbed dose, lagged 10 years |
Median 7.3 mGy |
| Icelandic pilots Gudmundsdottir et al. 2017 |
Cohort/ 551 male pilots/ 31.8 years/ Incidence |
7 MM 31 BCC |
1955-2015 | Cancer registry | Cosmic/ Chronic |
Block hours, type of flight, altitude |
Cumulative effective dose (mSv) |
Median cumulative effective dose 22.6 mSv per year (for 286 Icelandair pilots) |
| Nordic airline cabin crew Pukkala 2012 |
Cohort/ 8.507 female, 1.599 male/ –/ Incidence |
Female 59 MM, 56 BCC, 13 other skin Male |
1947-2006 | Cancer registry | Cosmic/ Chronic |
Block hours type of flight, altitude |
Cumulative effective dose (mSv) |
30 % > 5-14.9 mSv 29 % 15-34.9 mSv 6 % ≥ 35 mSv |
Tabelle A-4.5 Details der ausgewählten Studien in der radonexponierten Bevölkerung (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Design/ Study size/ Mean follow-up/ Incidence or mortality |
Number of cases | Period of case diagnoses |
Outcome ascertainment |
Exposure source/ Acute or chronic exposure |
Dosimetry | Exposure metric | Mean dose |
|---|---|---|---|---|---|---|---|---|
| Swiss population/ Vienneau et al. 2017 |
Cohort/ 5,249,467/ 7.8 years/ Mortality |
1,900 MM, 838 NMSC |
2000-2008 | Death certificate | Residential radon/ Chronic |
Exposure assessment |
Average annual concentration at place of residence in 4.12.2000, adjusted for floor of residence (Bq m-3) |
91.8 Bq m-3 |
| Danish cohort/ Bräuner et al. 2015 |
Cohort/ 51,445/ 13.6 years/ Incidence |
329 MM, 3,243 BCC, 317 SCC |
1993-2011 | Cancer registry | Residential radon/ Chronic |
Exposure assessment for residential histories |
Time-dependent time-weighted average radon concentration (Bq m-3) |
Median: 38.3 Bq m-3 |
| Czech Uranium miners/ Kulich et al. 2011 |
Case-cohort/ 1,730/ Median: 16.5 years/ Incidence |
23 MM | 1977-1996 | Cancer registry | Occupational radon/ Chronic |
Exposure assessment for occupational histories |
Cumulative Working Level Months (WLM) |
84.0 WLM |
A-5 Tabellen mit Ergebnissen (bezogen auf die Hautkrebs-Subtypen)
Tabelle A-5.1 Ergebnisse der ausgewählten Studien zum Basalzellkarzinom (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Number of cases/ Incidence or mortality |
Confounder control | Type of dose-response analysis | Dose-response result + CI (95 % if not specified otherwise) |
ERR at 100 mGy + CI (95 % if not specified otherwise) |
|---|---|---|---|---|---|
| Danish cohort/ Bräuner et al. 2015 |
3,243/ Incidence |
Age, sex, skin reaction to sunlight, freckles, nevi, BMI, education, SES, outside leisure activities, outdoor occupations, mean daily hours of bright sunshine |
Cox regression with loglinear time-dependent time-weighted average radon concentration |
Incidence Rate Ratio (IRR) per 100 Bq m-3 = 1.14 (1.03; 1.27) |
Not provided |
| Icelandic pilots/ Gudmundsdottir et al. 2017 |
31/ Incidence |
Age | Poisson regression | RR = 1.92 (95 %-CI 0.49; 7.23) for Icelandair pilots with > 0 to < 25 mSv, 3.61 (95 %-CI 1.64; 8.48) for Icelandair pilots with > = 25 mSv vs unexposed pilots, p-trend = 0.0005 |
Not provided |
| Nordic airline pilots/ Pukkala et al. 2002 |
61/ Incidence |
Age, calendar period | Poisson regression with continuous loglinear time-dependent cumulative dose |
RR for categories 3 – < 10 mSv, 10 – < 20, 20+ vs < 3: 1.8 (0.7, 4.8), 1.4 (0.6, 3.4), 1.9 (0.98, 3.5), p-trend = 0.17 |
Not provided |
| USRT (2)/ Lee et al. 2015 |
3,615/ Incidence |
Education, income, smoking, alcohol, BMI, exercise, eye colour, skin complexion, sunburns, dental X-rays, solar UV exposure, gender, age, calendar year |
Poisson regression with linear ERR |
ERR: -0.01 per Gy (-0.43, 0.52) |
|
| German RT patients/ Landthaler et al. 1995 |
12/ Incidence |
None | Case % by dose category | No dose-response: BCC and SCC combined by dose: 1 (4.3 %) for < 30 Gy, 4 (3.9) for 31 – 60 Gy, 13 (3.0) for 61 – 90 Gy, 3 (5.0 %) for > 90 Gy |
Not provided |
| Nordic airline pilots/ Pukkala et al. 2012 |
106/ Incidence |
Matched by country and year of birth |
Conditional logistic regression of continuous (loglinear) and categorical dose |
OR per 10 mSv: 0.95 (0.72; 1.25) |
Not provided |
| TBI cohort/ Schwartz et al. 2009 |
282/ Incidence |
None | Poisson regression, linear ERR model |
ERR by age: 0-9 years at treatment 1.49 (0.64; 3.17), 10-19: 0.55 (0.28; 1.00), 20-39: 0.11 (0.06; 0.18), 40-64: 0.02 (-0.01; 0.06) |
|
| Mayak workers (2)/ Azizova et al. 2021 |
295/ Incidence |
Sex, attained age, calendar period |
Poisson regression with linear ERR |
ERR: 0.57 per Gy (0.27-1.03) | |
| LSS/ Sugiyama et al. 2014 |
123/ Incidence |
City, sex, attained age | Linear ERR via Poisson regression (with threshold) |
0.22 (0.078; 0.29); with threshold at 0.63 (0.3; 0.9) Gy and then slope of 0.2 (0.069; 0.43) per 100 mGy fitted best |
|
| Tinea capitis cohort/ Ron et al. 1991 |
54/ Incidence |
Sex, ethnicity, age, country of birth, year of immigration, number of X-rays, time since exposure |
Poisson regression with linear ERR |
ERR 0.79 per Gy (p < 0.001), calculated from RR provided for two dose values |
|
| Scalp ringworm cohort/Shore et al. 2002 | 145/ Incidence |
Sex, attained age, other risk factors for BCC were identified (light complexion, Caucasian, sunburns) but not adjusted for |
Poisson and Cox regression | Sign elevated SIR (3.3) for exposed vs unexposed, significant elevated risk per dose |
ERR 6.0 per 100 mGy (3.0; 11.0) |
Tabelle A-5.2 Ergebnisse der ausgewählten Studien zum Plattenepithelkarzinom (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Number of cases/ Incidence or mortality |
Confounder control | Type of dose-response analysis | Dose-response result + CI (95 % if not specified otherwise) |
ERR at 100 mGy + CI (95 % if not specified otherwise) |
|---|---|---|---|---|---|
| Danish cohort/ Bräuner et al. 2015 |
317/ Incidence |
Age, sex, skin reaction to sunlight, freckles, nevi, BMI, education, SES, outside leisure activities, outdoor occupations, mean daily hours of bright sunshine |
Cox regression with loglinear time-dependent time-weighted average radon concentration |
Incidence Rate Ratio (IRR) per 100 Bq m-3 = 0.90 (0.70; 1.37) |
Not provided |
| Mayak workers (2)/ Azizova et al. 2021 |
48/ Incidence |
Sex, attained age, calendar period |
Poisson regression with linear ERR |
ERR per Gy: 0.14 (-0.23; 0.91) |
|
| LSS/ Sugiyama et al. 2014 |
114/ Incidence |
City, sex, attained age | Linear ERR via Poisson regression (with threshold) |
-0.012 (< -0.012; 0.025) | |
| German RT patients/ Landthaler et al. 1995 |
9/ Incidence |
None | Case % by dose category | No dose-response: BCC and SCC combined by dose: 1 (4.3 %) for < 30 Gy, 4 (3.9) for 31-60 Gy, 13 (3.0) for 61-90 Gy, 3 (5.0 %) for > 90 Gy |
Not provided |
| Nordic airline pilots/ Pukkala et al. 2002 |
Other skin: 27 (Skin cancer other than melanoma and excluding basal cell carcinoma and, in Denmark, all nonmelanoma skin cancers diagnosed before 1979)/ Incidence |
Age, calendar, period | Poisson regression with continuous loglinear time-dependent cumulative dose |
RR for categories 3- < 10 mSv, 10- < 20, 20+ vs < 3: other skin 0.5 (0.1; 4.3), 1.5 (0.5, 4.5), 1.9 (0.7, 5.0), p-trend = 0.14; |
Not provided |
Tabelle A-5.3 Ergebnisse der ausgewählten Studien zum malignen Melanom (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Number of cases/ Incidence or mortality |
Confounder control | Type of dose-response analysis | Dose-response result + CI (95 % if not specified otherwise) |
ERR at 100 mGy + CI (95 % if not specified otherwise) |
|---|---|---|---|---|---|
| Nordic airline pilots/ Pukkala et al. 2002 |
56/ Incidence |
Age, calendar period | Poisson regression with continuous loglinear time-dependent cumulative dose |
RR for categories 3 – < 10 mSv, 10 – < 20, 20+ vs < 3: 2.1 (0.9; 4.9), 2.2 (1.0; 4.7), 2.8 (1.3; 5.9), p-trend = 0.007 |
Not provided |
| USRT (1)/ Freedman et al. 2003 |
207/ Incidence |
Skin tone, eye and hair color, personal history of nonmelanoma skin cancer, family history of melanoma and indicators of residential sunlight exposure (no estimates of individual radiation doses, and no detailed information about sun exposure, sunburn history) |
Cox proportional hazards regression with time dependent number of years worked in time periods |
RR = 2.4 (0.7; 8.7) for 5+ years worked before 1950, p-trend = 0.03 |
Not provided |
| ESCAPE airline pilots/ Langner et al. 2004 |
14/ Mortality |
Age | Poisson regression with categorical cumulative dose |
RR (0 – 4.99 mSv) = 1.0, (5 – 14,99 mSv) = 0.71 (0.22; 2.18), (15 – 24.99 mSv) = 1.26 (0.45; 3.50), (= > 25mSv) = 0.33 (0.06; 1.85). p-trend = 0.481 |
Not provided |
| German aircrew/ Dreger et al. 2020 |
10/ Mortality |
Age, year, employment status |
Poisson regression with loglinear continuous cumulative effective dose |
RR > = 40 mSv vs < 5: 2.37 (0.21; 26.95). RR per 10 mSv (loglinear term) in male cockpit crew: 1.29 (0.78; 2.40) for MM |
Not provided |
| LLNL (1)/ Austin et al. 1997 |
31/ Incidence |
education, moles, skin cancer family history, previous NMSC, volatile photografic chemicals, age, race and sex |
Conditional logistic regression with loglinear number of exposed years |
OR ever vs never exposed = 2.3 (1.0; 7.6). RR per year exposed: 1.12 (p = 0.017) |
Not provided |
| French nuclear workers (1)/ Samson et al. 2011 |
ext. only: 4 ext. and int.: 12/ Mortality |
Age, sex,calendar year, socioecomonic status, duration of employment |
Poisson regression with continuous fit of 11 categories of cumulative effective dose |
No significant dose-effect relationship observed (no results shown) |
Not provided |
| Swiss population/ Vienneau et al. 2017 |
1 900/ Mortality |
Sex, civil status, education, SES, outdoor occupation with UV exposure, mother tongue, UVErythemal dose |
Cox regression with loglinear radon oncentration |
Hazard Ratio per 100 Bq m3 = 1.16 (1.04; 1.29) |
Not provided |
| Danish cohort/ Bräuner et al. 2015 |
329/ Incidence |
Age, sex, skin reaction to sunlight, freckles, nevi, BMI, education, SES, outside leisure activities, outdoor occupations, mean daily hours of bright sunshine |
Cox regression with loglinear time-dependent time-weighted average radon concentration |
Incidence Rate Ratio (IRR) per 100 Bq m3 = 1.08 (0.77; 1.50) |
Not provided |
| Childhood cancer survivors/ Guerin et al. 2003 |
16/ Incidence |
Alcylating agents and spindle inhibitors, gonadal first primary tumours, country, gender, age at first cancer, calendar year of first cancer |
Conditional logistic regression with continuous dose |
OR = 13 (0.94; 174), > 15 Gy vs no RT, unadjusted. Loglinear OR per Gy: 1.07 (1.00; 1.15), p = 0.05 |
Not provided |
| LLNL (2)/ Moore et al., 1997 |
69/ Prevalence |
Retirement status, sex, age, start of job, years of education, years of work |
Paired sample t-test of dose for matched case-control pairs |
No difference (p-value = 0.82) |
Not provided |
| LSS/ Sugiyama et al. 2014 |
10/ Incidence |
City, sex, attained age | Linear ERR via Poisson regression (with threshold) |
0.086 (-0.14; 0.73) | |
| US flight attendants Pinkerton et al. 2018 |
125/ Incidence |
Age, year of birth, education, race |
Cox regression with loglinear cumulative dose |
HR = 1.01 (0.88; 1.13) per 4.6 mGy absorbed dose |
Not provided |
| Mayak workers (1)/ Azizova et al. 2018 |
60/ Incidence |
Neutron dose, sex, age, calendar year |
Poisson regression with linear ERR |
ERR per Sv 0.15 (-0.41; 1.31) |
|
| Skin hemangioma cohort/ Haddy et al. 2012 |
13/ Incidence |
Sex, age at treatment, calendar year |
Logistic regression of categorical dose |
OR vs no RT: 3.9 (0.5; 32) > 0-0.001 Gy, 3.9 (0.2; 73) 0.001-0.01 Gy, 6.9 (0.5; 99) > 0.01 Gy |
Not provided |
| 15-Country Study/ Cardis et al. 2007 |
87/ Mortality |
Sex, age, calendar period, facility, duration of employment, SES |
Poisson regression with linear ERR |
ERR -0.72 per Sv (90 %: < 0; 1.93) |
|
| Canadian National Dose Registry/ Sont et al. 2001 |
222/ Incidence |
Age, gender, birth year | Poisson regression with linear ERR |
Significantly elevated SIR for MM but ERR non-significant |
ERR per 100 mGy = 0.43 (90 %: < 0; 1.96) |
| Czech uranium workers/ Kulich et al. 2011 |
23/ Incidence |
Age, calendar time, smoking | Cox regression with loglinear cumulative exposure |
HR for 180 vs 3 WLM = 2.92 (0.91; 9.42), RR 10 – 50 WLM = 2.16 (0.67; 6.90), RR 50 – 100 WLM = 5.55 (1.83; 16.86), RR > 100 WLM = 3.38 (0.82; 13.94), relative to < = 10 WLM, p heterogeneity = 0.002 |
|
| NRRW/ Muirhead et al. 2009 |
261/ Incidence |
Age, sex, calendar year, industrial job and first employer |
Linear ERR regression with categorical cumulative dose |
p-trend = 0.26 | ERR per Sv = 1.39 (-0.65; 5.6) |
| French combined nuclear workers (2)/ Metz-Flamant et al. 2013 |
68/ Mortality |
Sex, age, calendar period, company, SES, duration of employment |
Poisson regression with linear ERR model and loglinear model |
ERR < 0, one-sided p-value = 0.72 |
|
| Icelandic pilots/ Gudmundsdottir et al. 2017 |
7/ Incidence |
Age | Poisson regression | RR = 5.07 (0.14; 201.23) for Icelandair pilots with > 0 to < 25 mSv, 9.88 (1.57; 190.78) for Icelandair pilots with > = 25 mSv vs unexposed pilots, p-trend = 0.009 |
|
| Nordic airline pilots/ Pukkala et al. 2012 |
68/ Incidence |
Matched by country and year of birth |
Conditional logistic regression of continuous (loglinear) and categorical dose |
OR per 10 mSv: 0.99 (0.59; 1.66) |
Tabelle A-5.4 Ergebnisse der ausgewählten Studien zum nicht-melanozytären Hautkrebs (NMSC) (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Number of cases/ Incidence or mortality |
Confounder control | Type of dose-response analysis | Dose-response result | ERR at 100 mGy + 95 %-CI if not specified otherwise |
|---|---|---|---|---|---|
| Swiss population/ Vienneau et al. 2017 |
838/ Mortality |
Sex, civil status, education, SES, outdoor occupation with UV exposure, mother tongue, UVErythemal dose |
Cox regression with logline |
Hazard Ratio = 1.14 (0.87; 1.50) |
Not provided |
| Mayak workers (1)/ Azizova et al. 2018 |
294/ Incidence |
Neutron dose, sex, age, calendar year |
Poisson regression with linear ERR |
ERR: 0.51 per Sv (0.22; 0.93) |
|
| NRRW/ Muirhead et al. 2009 |
261/ Incidence |
Age, sex, calendar year, industrial job and first employer |
Linear ERR regression with categorical cumulative dose |
p-trend = 0.04 | ERR: 1.50 per Sv (0.05; 3.85) |
| French combined nuclear workers (2)/ Metz-Flamant et al. 2013 |
7/ Mortality |
Sex, age, calendar period, company, SES, duration of employment |
Poisson regression with linear ERR model and loglinear model |
NMSC: ERR = 126.5 (90 %-CI: 7.03; 1916) |
Tabelle A-5.5 Ergebnisse der ausgewählten Studien zu allen Hautkrebstypen zusammen (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Number of cases/ Incidence or mortality |
Confounder control | Type of dose-response analysis | Dose-response result | ERR at 100 mGy + 95 %-CI if not specified otherwise |
|---|---|---|---|---|---|
| NRRW/ Muirhead et al. 1999 |
30 (incl. 26 MM)/ Mortality |
Age, sex, calendar year, industrial job and first employer |
Linear ERR regression (probably Poisson) |
ERR: 2.07 per Sv (90 %-CI: -1.04–15.1) |
Tabelle A-5.6 Ergebnisse der ausgewählten Studien zum Sarkom (Autoren: Luca Caramenti, Michael Hauptmann)
| Study name/ Reference |
Number of cases/ Incidence or mortality |
Confounder control | Type of dose-response analysis | Dose-response result | ERR at 100 mGy + CI (95 % if not specified otherwise) |
|---|---|---|---|---|---|
| Swedish Cancer Registry/ Karlsson et al. 1998 |
116 sarcoma of connective tissue, breast or skin (angiosarcoma: 40; other sarcomas: 76)/ Incidence |
Age, year of breast cancer diagnosis, county and lymphoedema |
Conditional logistic regression, continuous dose in linear and quadratic terms adjusted for oedema |
Positive significant linear term and negative significant quadratic term for all soft tissue sarcoma and other sarcoma, no positive association for angiosarcome. Integral dose of RT was a predictor of the risk for other sarcomas (OR for 50 J: 2.4 (1.4; 4.2); OR for 100 J: 4.8 (1.6; 14.9); OR for 150 J: 8.0 (1.4; 46.1). All soft tissue sarcome: linear term 1.8 (0.8; 2.7), quadratic term -0.4 (-0.6; -0.1). Other sarcoma: 1.9 (0.8; 3.0), -0.4 (-0.6; -0.1) |
Not provided |
A-6 Risikokoeffizienten und Detriment D auf der Basis von LSS
Tabelle A-6.1: Inzidenz-Risikokoeffizienten RI und Detriment D für Hautkrebs auf der Basis von LSS (Sugiyama et al. 2014) unter Verwendung eines DDREF = 2 sowie des Letalitätsfaktors k = 0,002 für qmin = 0 und qmin = 0,1 nach ICRP 2007, Tabelle A.4.1
| Dosis-Wirkungs-Modell | ERR/EAR- Mischmodell |
RI / (10 000∙Sv)-1 | Min. Einschr. Lebensqual. |
D / (10 000∙Sv)-1 |
|---|---|---|---|---|
| LNT ERR/D = 0,2/Sv … 0,5/Sv |
0:100 | 2,5 | qmin = 0 | 0,01 |
| qmin = 0,1 | 0,25 | |||
| 50:50 wie alle anderen Krebsarten |
150 … 400 | qmin = 0 | 0,6 … 1,6 | |
| qmin = 0,1 | 15 … 40 | |||
| 100:0 | 300 … 800 | qmin = 0 | 1,2 … 3,2 | |
| qmin = 0,1 | 30 … 80 | |||
| Linear mit Schwellendosis bei 0,63 Gy (beste Anpassung) |
Jedes beliebige Verhältnis | 0 | alle | 0 |
| Zum Vergleich: | ||||
| ICRP-Publikation 103 | 100:0 | 1 000 | qmin = 0 | 4 |
- 1
- Unter Hautkrebs werden im vorliegenden Dokument alle Malignome der Haut subsumiert.
- 2
- Gemäß ICRP-Publikation 103 bezeichnet der Risikokoeffizient das Risiko bezogen auf die gesamte Lebenszeit und wird synonym mit dem Begriff „lifetime excess absolute risk“ (LEAR) verwendet.
- 3
- ICRP-Publikation 103 (ICRP 2007) verwendet generell fast ausschließlich den Begriff „skin cancer“. Wie aus einigen Textpassagen jedoch hervorgeht, ist hiermit das BCC gemeint (z. B. A145: „… because radiogenic skin cancer is almost exclusively of the basal cell type …“).
- 4
- Infolge der bestimmungsmäßigen Exposition gegenüber ionisierender Strahlung handelt es sich bei vielen untersuchten Personen um reine Männerkohorten. In einigen Studien wurden Frauen bei der Auswertung ausgeschlossen, da ihre Fallzahl in der untersuchten Gruppe zu klein war. Eine generelle geschlechterneutrale Formulierung wäre daher in vielen Fällen sachlich nicht richtig. Aus diesem Grund scheint es angebracht, an den entsprechenden Stellen dieser Stellungnahme generell die männliche Form zu verwenden.
- 5
- Während der sich über viele Jahrzehnte erstreckenden Beobachtungszeit wurde das den LSS-Auswertungen zugrunde gelegte Dosimetriesystem mehrfach gewechselt. Mit DS86 wird das Dosimetriesystem aus dem Jahr 1986 bezeichnet und mit DS02 das aus dem Jahr 2002.
- 6
- Die Tinea capitis ist eine durch Dermatophyten hervorgerufene und vor allem im Kindesalter auftretende Mykose der behaarten Kopfhaut (AWMF-S1-Leitlinie (013-033)).
- 7
- Standardized Incidence Ratio
- 8
- Working Level Month (WLM) ist eine historische, speziell für den Arbeitsschutz im Uranbergbau eingeführte Einheit für die kumulierte Rn-222-Aktivitätskonzentration. Obwohl WLM keine SI-Einheit ist und daher nicht mehr Verwendung finden sollte, ist sie in der einschlägigen epidemiologischen Literatur noch weit verbreitet. Die Umrechnung in die entsprechende SI-Einheit ergibt unter Einbeziehung des Gleichgewichtsfaktors F:
1 WLM = 0,64 F-1 MBq∙h∙m-3 - 9
- In den Originalarbeiten wird die gewichtete Hautdosis mit der Einheit Gy angegeben. Zur besseren Übersichtlichkeit und wegen des Bezugs der Risikokoeffizienten auf die Organ-Äquivalentdosis mit der Einheit Sv gemäß ICRP-Publikation 103 wird hier und im Folgenden einheitlich der Bezug auf die Einheit Sv genommen.











Kommentar hinterlassen